Если не лечить бактериальную инфекцию что будет
Если не лечить бактериальную инфекцию что будет
Бактериальная инфекция развивается после преодоления бактериями кожных и слизистых барьеров и проникновения в ткани организма. Зачастую организм успешно справляется с возбудителями без внешних признаков заболевания за счет иммунного ответа. Тем не менее у некоторых возбудителей появилась сложная защитная система.
Несмотря на захват клетками хозяина в результате обычного фагоцитоза, они способны предотвратить слияние фагосомы с лизосомой и в результате избегают разрушения. Поскольку стенка защитной вакуоли проницаема для питательных веществ (аминокислоты, углеводы), бактерии растут и делятся до тех пор, пока не погибнет клетка, а выделяющиеся возбудители инфицируют новые клетки хозяина.
Данная тактика используется, например, видами Chlamydia и Salmonella, Mycobacterium tuberculosis, Legionella pneumophila, Toxoplasma gondii и Leishmania. Легко понять, что целенаправленная фармакотерапия особенно затруднена в этих случаях, т. к. препарату для достижения возбудителя необходимо пройти через клеточную мембрану и затем через мембрану вакуоли.
Если бактерии размножаются быстрее, чем защитные силы организма уничтожают их, развивается инфекционное заболеваниес признаками воспаления, например гнойная раневая инфекция и инфекция мочевых путей. Лечебными свойствами обладают вещества, которые повреждают бактерии, что останавливает их дальнейшее размножение без повреждения клеток организма хозяина.
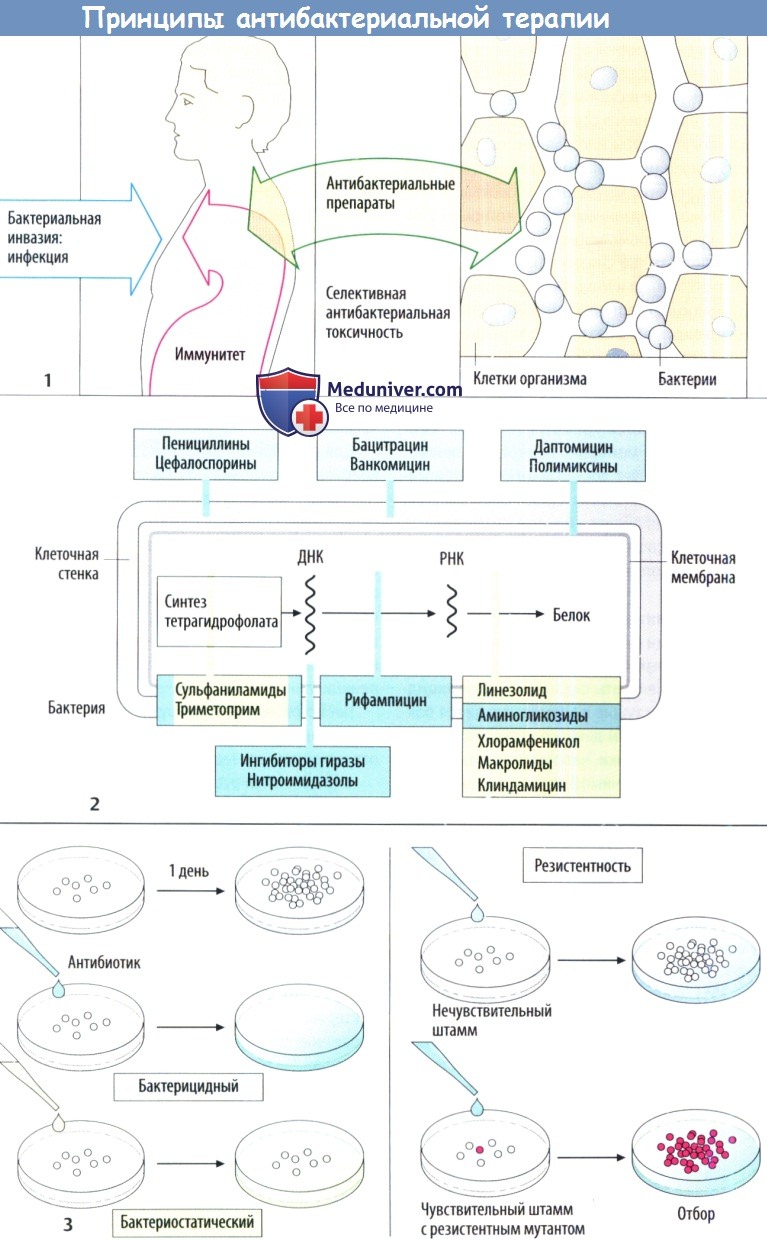
Изолированное повреждение бактерий возможно в случае, когда вещество нарушает метаболизм бактериальных клеток, а не клеток организма хозяина. Таким свойством, очевидно, обладают ингибиторы синтеза клеточной стенки, т. к. в клетках человека или животных отсутствует такая стенка. Точки воздействия антибактериальных препаратов проиллюстрированы с помощью упрощенной схемы строения бактериальной клетки
Действие антибактериальных препаратов можно наблюдать in vitro. Бактерии размножаются в питательной среде в контролируемых условиях. Если среда содержит антибактериальный препарат, то можно ожидать два результата:
а) бактерии уничтожаются — бактерицидный эффект;
б) бактерии выживают, но не размножаются — бактериостатический эффект. Несмотря на то что в организме эффекты могут быть разными, различные классы разделяют по основному механизму действия.
Если антибактериальный препарат не влияет на рост бактерий, то это говорит о бактериальной резистентности. Она может быть вызвана наличием определенных метаболических особенностей, которые обусловливают нечувствительность к препарату у конкретного штамма бактерий (естественная резистентность). В зависимости то того, поражает ли препарат лишь несколько или множество типов бактерий выделяют антибиотики с узким (бензилпенициллин) или широким спектром (тетрациклин).
Штаммы бактерий с естественной чувствительностью могут трансформироваться под влиянием антибактериальных препаратов в резистентные штаммы (приобретенная резистентность) при случайном изменении гена (мутация). Под влиянием препарата чувствительные бактерии погибают, а мутировавшие продолжают размножаться. Чем чаще вводится один и тот же препарат, тем вероятнее появление резистентных штаммов (госпитальные штаммы с множественной резистентностью)!
Резистентность в некоторых случаях приобретается, когда ДНК, ответственная за нечувствительность (так называемые плазмиды резистентности), передается от других резистентных бактерий путем конъюгации или трансдукции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Жизнь без антибиотиков. Что поможет не умереть от инфекции, когда привычные лекарства перестанут работать?
Все об антибиотикорезистентности: от причин до способов борьбы
В 2014 году премьер-министр Великобритании Дэвид Кэмерон заказал у британского экономиста и финансиста Джима О’Нила отчет по росту устойчивости патогенных возбудителей: бактерий, вирусов, грибов и других паразитов — к противомикробным препаратам. Опасения премьер-министра оказались не напрасны. Когда отчет был готов, он показал: к 2050 году, если тренд сохранится, инфекционные заболевания будут забирать 10 млн жизней в год. Для сравнения: от ишемической болезни сердца, самой частой причины смерти, в прошлом году умерли 8,8 млн человек, а от коронавируса — 1,8 млн.
Что же произойдет? Инфекции станут неизлечимы из-за устойчивости — или резистентности, как ее еще называют, — патогенных бактерий к антибиотикам. И тогда, как и до XX века, мы будем умирать из-за незначительных травм, от осложнений после операций, туберкулеза и пневмонии. Всемирная организация здравоохранения называет резистентность бактерий к антибиотикам самой серьезной угрозой здоровью человечества.
Почему же антибиотики теряют эффективность? И как иначе ученые предлагают убивать бактерии — чтобы бактерии не убивали нас?
От золотой эры антибиотиков — к эре разочарования в них
Открытие антибиотиков началось с ошибки. В 1928 году будущий нобелевский лауреат Александр Флеминг начал серию экспериментов с патогенной бактерией Staphylococcus aureus. Бактерию он выращивал в чашке Петри. Однажды Флеминг оставил чашу непокрытой у окна. По правилам работы в лаборатории, так, конечно же, делать нельзя. Но ошибка оказалась судьбоносной. В питательную среду, где выращивалась Staphylococcus aureus, попали споры плесени.
Можно было бы выбросить чашку, но Флеминг заметил: бактерии не росли около колонии плесневых грибов. Ученому удалось выделить и идентифицировать плесень — это оказался представитель рода Penicillium. Флеминг обнаружил, что плесень убивает многие бактерии: возбудителей скарлатины, пневмонии, гонореи, менингита и дифтерии, и догадался, что плесень вырабатывает какой-то «сок», эффективный против бактерий. Этот «сок» Флеминг назвал пенициллином. Но, увы, не смог выделить вещество, а тем более — запустить лекарство в массовое производство. Это удалось сделать только во время Второй мировой войны уже другим ученым, Говарду Флори и Эрнсту Чейну.
Но открытия сопровождали сообщения об устойчивости бактерий к антибиотикам. Тетрациклин ввели в практику в 1950 году, а в 1959-м ученые нашли резистентные к нему штаммы бактерий. К эритромицину, который стали применять в 1953 году, бактерии выработали резистентность в 1968-м. Метициллин 1960-го был новостью для бактериального сообщества всего лишь два года. Та же судьба ждала и другие антибиотики, стоило внедрить их в клиническую практику. А устойчивость бактерий к первому антибиотику, пенициллину, обнаружили еще в 1940 году, аж за три года до введения его в массы.
Некоторые ученые замечали тревожные сигналы еще тогда. Александр Флеминг, например, в 1945 году предупреждал, что злоупотребление пенициллином и другими антибиотиками приведет к росту резистентности к ним бактерий, — и лекарства просто перестанут действовать. Медицинское сообщество не принимало предупреждение всерьез вплоть до 1980-х, когда в больницах начались эпидемии, вызванные резистентными бактериями.
С тех пор потребление антибиотиков только возросло, как и резистентность бактерий. Прежде всего она угрожает жизням людей, которые находятся в больнице и иммунитет которых ослаблен. Сегодня они умирают из-за инфекций кровотока и пневмонии, вызванных Acinetobacter baumannii, Pseudomonas aeruginosa и Enterobacteriaceae: болезни практически не лечатся. Но смертоносными становятся и патогены, поражающие здоровых. Например — банальная Salmonella, причина пищевых отравлений и гонореи, стремительно приспосабливается к сегодняшнему лечению.
При этом открыть новый антибиотик все сложнее. Вещества, которые можно легко и быстро выделить из микроорганизмов и превратить в лекарства, уже выделили и использовали. Если новый антибиотик все же вводился в практику, то в течение пары лет бактерии приспосабливались и к нему — и нужно было разрабатывать еще более новый. Разработка антибиотиков стала просто нерентабельной, и в 1990-х годах половина крупных фармацевтических компаний США и Японии сократили ее финансирование. На создание нового лекарства и прохождение всех этапов тестирования и регистрации нужно потратить миллиарды долларов — при этом продавать антибиотики экономически не так выгодно, как, например, статины или антидепрессанты, которые пациенты принимают месяцами или даже всю жизнь: типичный курс антибактериального препарата длится всего неделю-две. Наступила эра разочарования в антибиотиках.
Почему бактерии победили антибиотики?
Бактерии — специалисты по приспособлению. Об этом говорит хотя бы тот факт, что в их арсенале — целых два вида резистентности: естественная и приобретенная. Естественная — та, которой бактерии обладают изначально, вне зависимости от знакомства с нашими лекарствами. Естественная резистентность бывает внутренней или индуцированной. Внутреннюю бактерии демонстрируют 24/7. Это как полиция, которая все время бдит. А вот индуцированная больше похожа на спецназ: обычно — в спящем режиме, но при воздействии критического количества антибиотика активируется. И тогда бактерия либо уменьшает проницаемость своей внешней мембраны (если такая имеется), чтобы не пустить молекулы антибиотика, либо повышает производство специальных белков-насосов, откачивающих антибиотик, либо запускает синтез веществ, разрушающих антибиотик.
У бактерий есть суперспособность — трансформация: они поглощают чужую ДНК и используют ее. Для этого у них есть специальные рецепторы, которые вылавливают ДНК из внешней среды и втягивают внутрь бактерии. Затем чужую ДНК подхватывают специальные белки, которые встраивают ее в хромосому бактерии — ее жесткий диск, на котором хранится инструкция, как действовать. Когда чужая ДНК встроена, бактерия считывает с нее информацию как с собственной. А если чужеродная ДНК содержит информацию о резистентности, например — о структуре молекулы, разрушающей антибиотики, бактерия сможет ее построить.
Бактерии, как люди, страдают от вирусов. Более того, вирусы, собственно, и появились на Земле как фрагменты органической жизни, атакующей бактерии, — их война идет уже миллиарды лет. Вирусы бактерий называются бактериофагами. При переходе от одной бактерии к другой бактериофаг может случайно занести генетический материал предыдущего хозяина, в том числе такого, который умеет бороться с антибиотиками. Этот процесс называется трансдукция.
Конъюгация — это когда одна бактерия непосредственно передает ДНК другой через физический контакт. Такое происходит часто, причем между бактериями совершенно разных видов. Представьте: есть бактерия, которая несет в себе информацию об устойчивости к антибиотику. Но записана эта информация не в крупной неподвижной хромосоме, а в плазмиде, маленькой порции ДНК. Если хромосома — жесткий диск, плазмида — флешка. Итак, бактерия-донор с плазмидой антибиотикорезистентности находит бактерию-реципиента и стыкуется с ней при помощи специальных структур на поверхности — своей и реципиента. Между бактериями образуется канал, через который бактерия-донор передает плазмиду. Так абсолютно безвредная, но стойкая бактерия может одарить резистентностью к антибиотику менее удачливого, но патогенного собрата.
Бактерии умеют приспособиться так хорошо, что перестают работать даже «антибиотики последней надежды», которые врачи используют редко, только если пациент страдает от инфекции, вызванной мультирезистентными бактериями. Так произошло с карбапенемами. Их применяли с 1980 года — исключительно в отделениях реанимации. Но в 2000-е годы исследовали все равно обнаружили слабую резистентность к карбапенемам у бактерии Klebsiella pneumoniae, которая убивает половину инфицированных ею пожилых людей. Klebsiella pneumoniae научилась синтезировать особую молекулу, фермент карбапенемазу, которая разрушает карбапенемы. Причем информацию о карбапенемазе бактерия хранила в плазмиде, удобной для конъюгации. К 2003 году резистентность распространилась на 21% бактерий рода Klebsiella в нью-йоркских больницах. В 2005 году — достигла Израиля, Италии, Колумбии, Великобритании и Швеции, а в 2014 году — и России.
Антибиотики — проблема без решения?
Использование антибиотиков увеличивает давление отбора на популяцию бактерий: выживают только самые устойчивые, которые к тому же охотно делятся генами со всем бактериальным сообществом. Мы убиваем их — они становятся сильнее.
Ситуацию радикально ухудшает бесконтрольное использование антибиотиков. В половине случаев, когда люди применяют их, они вовсе не нужны. Антибиотики эффективны только против бактерий — но многие пытаются ими лечить вирусы. Коронавирус, например. А еще лекарство неправильно подбирают. Пациенту, которому подошли бы антибиотики узкого спектра, нацеленные на конкретные возбудители, выписывают антибиотики более широкого спектра действия, то есть направленные на многие виды бактерий. Сразу многим видам бактерий приходится бороться и вырабатывать устойчивость, шанс, что они станут резистентными и передадут свойство собратьям, — выше.
Чтобы замедлить скорость распространения резистентности, ВОЗ составила классификацию антибиотиков «AWaRE» — Access («доступ»), Watch («наблюдение») and Reserve («резерв»). Группа «доступа» — антибиотики широкого спектра действия, к которым бактерии сложнее выработать резистентность. Антибиотики под «наблюдением» устаревают быстрее, поэтому применять их нужно редко, только по назначению врача и при определенных симптомах. В группе «резерва» — антибиотики против бактерий с множественной резистентностью, они же «антибиотики последней надежды». Это ценный и невозобновляемый ресурс. По планам ВОЗ, к 2023 году 60% антибиотиков на рынке должны относиться к группе «доступа». Но реально ли это? Исследователи подсчитали: с 2000 по 2015 год глобальное потребление антибиотиков группы «наблюдения» выросло на 90,9%. Если тенденция сохранится, цель ВОЗ просто невыполнима.
Медицина — не единственный рассадник мультирезистентных бактерий. Антибиотики используют при выращивании растений, разведении рыбы, на животных фермах. В Чили, во втором по величине производителе лосося в мире, скормили 382 тонны антибиотиков лососю в течение 2016 года. Предприятия выращивают много рыбы в тесных условиях, единственный способ сохранить ее здоровье и фертильность — антибиотики. То же и с растениеводством, и с животноводством. В 2010 году животным скормили 63 000 тонн антибиотиков. К 2030 году эта цифра вырастет на 67% — потому что спрос на мясо растет, и предприятия продолжают выращивать большое количество животных при плотной посадке и используют антибиотики, некоторые типы которых еще и стимулируют рост.
К чему это приводит? Куча антибиотиков попадает в кишечник животного — и взаимодействует с местными бактериями, которые учатся выживать. Затем антибиотик выходит вместе с экскрементами, выбрасывается в среду — и образуются целые резервуары мультирезистентных бактерий. Потом эти хорошо обученные защищаться бактерии возвращаются к человеку, когда тот гладит животное, ест его мясо или просто пьет воду. А от человека — к другим людям.
Как еще можно бороться с бактериями?
Способность бактерий быстро эволюционировать подталкивает ученых искать новые способы борьбы с ними — и вспоминать полузабытые старые.
Фаговая терапия
Вообще-то бактериофаги обнаружили раньше антибиотиков, еще в 1915 году — а спустя два года уже использовали для лечения бактериальных инфекций домашнего скота. В 1910–1920-х даже были получены бактериофаги, облегчающие симптомы холеры у человека. Но с открытием антибиотиков — простых в производстве, стабильных, с большим спектром действий — внимание переключилось на них. Сейчас интерес вернулся.
Большой плюс бактериофагов как лекарства — их селективность, способность убивать только определенные бактерии. При применении же антибиотиков страдают не только патогены, но и родные, полезные бактерии человека — комменсальные бактерии.
Организм человека реагирует на бактериофаги как на вторжение и вырабатывает иммунитет. Это значит, что вылечить бактериофагами пациента можно будет только один раз. В следующий раз иммунитет эффективно очистит организм от бактериофагов еще до того, как они успеют расправиться с патогенными бактериями.
Есть опасения, что при лизисе, то есть разрушении бактерии, из бактерии будут выделяться эндотоксины, которые могут привести к сепсису.
Зафиксированы случаи резистентности бактерий и к бактериофагам. Пока сложно сказать, насколько это серьезно и как повлияет на фаговую терапию будущего.
Антимикробные пептиды и бактериоцины
И антимикробные пептиды, и бактериоцины разрушают мембрану бактерий. Бактериоцин турицин CD из почвенной бактерии Bacillus thuringiensis, например, таким образом убивает бактерию Clostridium difficile. Инфекции, вызванные ей, развиваются из-за антибиотиков. Почему же антибиотик вызывает инфекцию, а бактериоцин ее вылечивает? Бактерия Clostridium difficile — условно патогенный житель нашего кишечника, который не вредит нам, пока его не слишком много. Антибиотики широкого спектра действия нарушают микробиоту кишечника, убивают полезные для человека комменсальные бактерии освобождают место для резистентной Clostridium difficile. Она разрастается и вызывает инфекцию. Турицин CD селективно убивает Clostridium difficile — и не вредит микробиоте.
Как и антибиотики, антимикробные пептиды убивают все бактерии. Зато бактериоцины более селективны.
Есть данные о резистентности бактерий к антимикробным пептидам и бактериоцинам. Для борьбы бактерии могут выпускать из себя молекулы, разрушающие антимикробные пептиды и бактериоцины, или модифицировать свою мембрану. Как и в случае с бактериофагами, ученые указывают на необходимость подробного изучения механизмов резистентности. Но уже сейчас можно сказать, что частота возникновения устойчивости бактерий к антимикробным пептидам и бактериоцинам ниже, чем к антибиотикам. Почему — пока неизвестно.
Изменение микробиоты кишечника
Пробиотики — препараты, которые содержат полезные для человека бактерии, а фекальная трансплантация — введение микробиома здорового донора в больной кишечник. Цель одна: заселить кишечник комменсальными бактериями, то есть бактериями, полезными для человека. А комменсальные бактерии могут воздействовать на патогены следующим образом:
Колонизируют просвет кишечника и конкурируют с патогенами за место и ресурсы.
Синтезируют антибактериальные вещества.
Усиливают ответ иммунной системы. Например, некоторые стимулируют эпителиальные клетки кишечника, позволяя секретировать антибактериальный пептид RegIIIγ. Потеря бактерий, стимулирующих выброс RegIIIγ, приводит к восприимчивости к возбудителям Salmonella typhimurium и к патогенам из рода Enterococcus.
И пробиотики, и фекальная трансплантация уже сейчас успешно используются для лечения инфекций, вызванных C. difficile (особенно опасны для людей старше 65 лет: умирает каждый одиннадцатый). Но такая терапия помогает только при инфекциях желудочно-кишечного тракта.
Бактерии-хищники
В отличие от антибиотиков, B. bacteriovorus полностью избавляются от цели, поэтому внутренние токсины умершей клетки не вызывают воспаления у хозяина. Они почти не вызывают иммунную реакцию и, по-видимому, нетоксичны. В исследованиях на животных бактерия-хищник смогла уменьшить количество патогенов, вызывающих пневмонию и сальмонеллез. Но пока данных слишком мало, чтобы B. bacteriovorus начали лечить людей.
Система CRISP/Cas9
CRISP/Cas9 система — нашумевшая технология, которую используют для редактирования генома высших организмов, — подходит и для бактерий. Идея следующая: мы вводим в бактерию плазмиду, маленькую порцию ДНК, с сюрпризом. Бактерия считывает ее как свою собственную — и синтезирует гидовую молекулу и белок cas9, потому что в плазмиде написано: «нужно синтезировать именно это». Гидовая молекула взаимодействует с определенным участком ДНК бактерии и говорит белку cas9: «вот этот участок ты должен порезать». Нужная нам гидовая молекула прикажет cas9 порезать ДНК бактерии так, чтобы отключить определенные гены. Например — те, что отвечают за устойчивость к антибиотикам, развитие биопленок, секрецию факторов вирулентности. Идея красивая, верно? Но пока нет методики для доставки подобных плазмид в бактерии, живущие внутри животных или человека.
«Оживление» старых антибиотиков
На самом деле есть и способ сделать старые антибиотики снова эффективными. Для этого антибиотики используют в тандеме со специальными веществами, которые мешают патогенам защищаться и облегчают работу антибиотикам. Процесс называется потенциацией антибиотиков, а сами вещества-помощники — потенциаторами.
Какие минусы? Во-первых, как в случае любой комбинированной терапии, есть опасность вредного для человека взаимодействия между лекарствами. Во-вторых, даже если комбинация потенциатора и антибиотика успешна против патогена, у лекарств могут быть несовместимые фармакологические свойства. Например, если молекула-помощник быстро выводится из организма, а антибиотику, наоборот, нужно время, чтобы достичь бактерии в организме, то воздействовать сообща они не смогут.
Что делать с резистентностью сейчас?
Пока альтернативные способы борьбы в процессе развития. Но есть очень простые действия, которые может сделать каждый из нас, чтобы защитить себя и близких, замедлить темпы роста антибиотикорезистентности и дождаться лучшего лекарства. Согласно рекомендациям ВОЗ, стоит:
Пульмонолог «СМ-Клиника» рассказала о бактериальной пневмонии у взрослых
По данным статистики бактериальными пневмониями в среднем около 1000 пациентов на 100 тысяч населения. Особенно часто эта форма болезни бывает у пожилых людей, старше 75 лет или тех, кто страдает хроническими патологиями
АЛЕНА ПАРЕЦКАЯ
Врач-патофизиолог,
иммунолог, эксперт ВОЗ
ЕЛЕНА ЗАРЯНОВА
К.м.н., врач-пульмонолог высшей категории,
сомнолог «СМ-Клиника»
Бактериальная пневмония – частое осложнение у пациентов, которые лечатся в стационаре и поликлинике. В последние годы отмечен рост тяжелых форм, которые приводят к летальному исходу.
Что нужно знать о бактериальной пневмонии
Что такое бактериальная пневмония
Бактериальная пневмония – это воспаление легких, которое провоцируют патогенные бактерии, проникающие в дыхательную систему.
Такое воспаление формируется при двух условиях: или сам организм ослаблен, когда иммунная система не может эффективно бороться с бактериями, или это очень агрессивные бактерии, которые преодолевают сопротивляемость организма. Обычно в той или иной мере присутствуют оба варианта.
Причины бактериальной пневмонии у взрослых
Бактериальная пневмония чаще всего вызвана бактериями, которые считаются частью микрофлоры дыхательных путей. Эти микроорганизмы относятся к категории условно-патогенных. Если организм здоров, не ослаблен, иммунная система работает исправно, бактерии никак не вредят. Но при стрессе, операциях, обострении хронических болезней, тяжелых ОРВИ бактерии могут стать опасны.
Есть два варианта бактериальных пневмоний – внебольничная и внутрибольничная. Они сильно различаются по виду бактерий, которые вызывают воспаление.
При внебольничной пневмонии воспалительный процесс обычно провоцирует пневмококк, гемофильная палочка или стрептококк.
Внутрибольничную пневмонию вызывают особо агрессивные бактерии, устойчивые ко многим антибиотикам. Эти возбудители обычно живут в клиниках – золотистые стафилококки, синегнойная палочка, энтеробактерии и некоторые другие. Нередко такая пневмония возникает у людей, которым проводят ИВЛ.
Если пациенты страдают иммунодефицитом, у них пневмонию может вызывать легионелла, микоплазма, пневмококк, гемофильная палочка и пневмоцисты.
Бактерии проникают в легкие из воздуха, с током крови из воспалительных очагов в теле или с током лимфы, напрямую, при ранениях груди. Факторы риска, повышающие вероятность пневмонии, это:
Симптомы бактериальной пневмонии у взрослых
Во многом симптомы воспаления легких зависят от того, какая бактерия их вызывает. Чем агрессивнее микроб, тем тяжелее проявления. Самые типичные проявления бактериальной пневмонии:
Лечение бактериальной пневмонии у взрослых
Диагностика
Врач ориентируется на жалобы пациента и данные, которые он видит и слышит. Если доктор прослушает грудную клетку фонендоскопом, он услышит типичные хрипы, изменения дыхания и так называемую крепитацию (шум пораженного воспалением легкого). Подтвердить бактериальную пневмонию могут:
Современные методы лечения
Лечить бактериальную пневмонию в легких и среднетяжелых случаях можно дома, под контролем врача. При тяжелых формах – в клинике, палате интенсивной терапии и реанимации. Показаны постельный режим, легкое диетическое питание и обильный прием жидкости (или введение ее внутривенно).
Основное лечение – антибиотики: врач подбирает их, основываясь на данных анализов. Чаще всего используют пенициллины, цефалоспориновую группу или макролиды. Если это отдельные формы пневмонии – подбирают более узконаправленные препараты. Лекарства принимают перорально внутрь или в инъекциях внутримышечно до 14 дней, при тяжелом течении их вводят внутривенно.
Профилактика бактериальной пневмонии у взрослых в домашних условиях
Меры профилактики достаточно простые:
Популярные вопросы и ответы
Хотя бактериальная инфекция лечится антибиотиками, это не такое простое заболевание, как может показаться на первый взгляд. Воспаление легких может в короткие сроки привести к серьезным осложнениям, о которых нам рассказала врач-пульмонолог Елена Зарянова.
Чем отличается бактериальная пневмония от вирусной?
При бактериальной пневмонии первично поражаются альвеолы – они воспаляются и отекают, в них скапливается жидкость (экссудат), который пропитывает легочную ткань и приводит к ее уплотнению (инфильтрации и консолидации), уменьшению воздушности и нарушению газообмена в легких. Эти изменения приводят к падению уровня кислорода в крови, кислородному голоданию всего организма, развитию дыхательной недостаточности. Очаговые поражения в легких можно заподозрить при общем осмотре пациента и подтвердить при рентгенологическом исследовании легких.
Вирусная пневмония в отличие от бактериальной развивается в несколько этапов. Респираторные вирусы в первую очередь поражают эпителий верхних дыхательных путей, а затем спускаются в нижние дыхательные пути и поражают клетки альвеол (альвеоциты). Патогенное воздействия вирусов проявляется в ухудшении работы мукоцилиарного клиренса (аппарата нижних дыхательных путей, который обеспечивает защиту и очищение легких от воспалительных агентов). При этом облегчается проникновение бактерий в нижние отделы дыхательных путей, подавляется защитная, в том, числе антибактериальная функция клеток иммунитета, в результате чего создаются условия для формирования вирусно-бактериальных ассоциаций.
Микст-инфекция приводит к более тяжелому течению и изменению клинической картины заболевания, нарушению дренажной функции легких, к затяжному разрешению воспаления.
Какие могут быть осложнения при бактериальной пневмонии?
К наиболее частым осложнениям внебольничной пневмонии можно отнести развитие бронхо-обструктивного синдрома, который проявляется сужением дыхательных путей и характеризуется:
Еще одним серьезным осложнением, требующим госпитализации пациента, является разрушение ткани в результате легочного воспаления с формированием в легких полостей, заполненных гнойным содержимым (абсцессов) и развитием системного септического воспаления, которое может привести к поражению различных органов и систем, развитию острой и тяжелой дыхательной, сердечной, почечной и печеночной недостаточности.
У пациентов пожилого возраста, лиц с иммунодефицитными состояниями, имеющими хронические заболевания, риск осложнений от пневмонии очень высок, в связи с чем таких пациентов целесообразно сразу госпитализировать в стационар.
Когда вызывать врача на дом при бактериальной пневмонии?
Только врач может определить дальнейшую тактику ведения и лечения пациента. Не каждая пневмония требует госпитализации в стационар. Легкие и неосложненные формы пневмонии могут лечиться не дому. Но, если врачом принято решение о домашнем лечении, то больной должен находиться под пристальным наблюдением медицинских работников поликлиники или службы медицинской помощи на дому. В первые 6 часов после установления диагноза больному необходимо получить первую дозу антибиотика, рекомендованного врачом.
Если у больного к 3-му дню заболевания нет улучшения состоянии от назначенной антибактериальной терапии или отмечает постепенное нарастание дыхательных симптомов, повышение температуры тела и симптомов общей интоксикации к 7-му дню заболевания, то необходимо вызвать на дом врача или бригаду скорой помощи для решения вопроса о замене антибактериального препарата и возможной госпитализации с целью дальнейшего подбора лечения и дообследования в условиях стационара.
Бактериальная пневмония развивается быстро, начинается остро и проявляется следующими симптомами:
Можно лечить бактериальную пневмонию народными средствами?
Антибиотики являются основными и эффективными препаратами для лечения бактериальных пневмоний. Никакой речи о народных средствах в качестве первой линии лечения при пневмонии идти не может. Народные средства могут быть использованы только в качестве дополнительных средств для облегчения некоторых симптомов заболевания.