Если забеременела на дюфастоне что делать
Клиника «Центр ЭКО»
Бесплодным считается брак, в котором отсутствует беременность у женщины при регулярной половой жизни партнеров без использования каких-либо противозачаточных средств. Ошибочно полагается, что бесплодие относится только к женщинам. В 45 процентах случаев это патология со стороны женщин, а в 40 процентах – у мужчин. Еще в 5-10 процентах случаев нарушения обнаруживаются сразу у обоих партнеров.
Клиническое бесплодие бывает:
Наиболее распространены следующие формы бесплодия:
В клинике бесплодия первой жалобой пациентов является отсутствие беременности либо выкидыши с невозможностью выносить и родить малыша. Также выявляются жалобы, связанные с первичной или сопутствующей патологией. Анамнез также подтверждает нарушения менструального цикла, перенесенные операции и аборты, воспалительные заболевания, или заболевания щитовидной железы, надпочечников, либо травму головного мозга. При физикальном обследовании могут выявиться ожирение, клиника синдрома Иценко-Кушинга, который также провоцирует бесплодие, признаки гиперандрогении (повышение андрогенов – мужских половых гормонов), либо нервная анорексия, клинически также приводящая к бесплодию.
Почему стоит выбрать клинику «Центр ЭКО»?
Преимущества клиники «Центр ЭКО»:
Комфорт и удобство клиники «Центр ЭКО»
Подробно узнать о ВРТ-программах клиники «Центр ЭКО» вы можете в разделе «Наши услуги».
Мы поможем вам осуществить вашу мечту о детях!
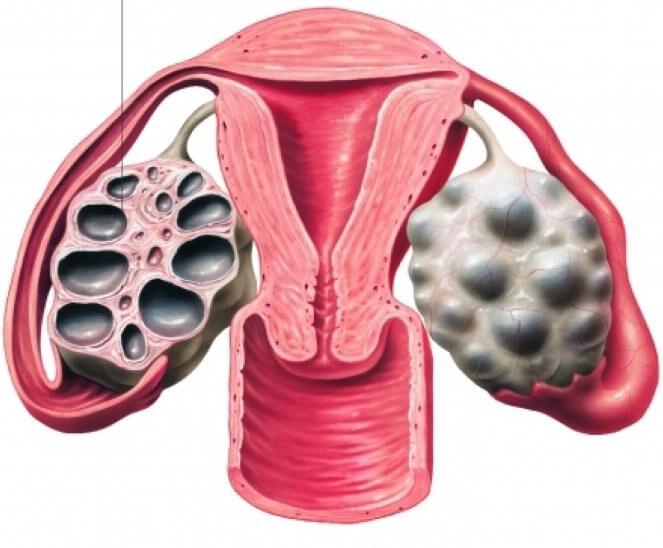
Синдром поликистозных яичников или мультифолликулярные яичники
Врачи на УЗИ нередко видят достаточно типичную картину, которую называют мультифолликулярными яичниками. Для некоторых пациенток мультифолликулярные яичники — синоним поликистоза, при котором также много фолликулов. Между тем, это совершенно разные понятия.
Для начала опишем УЗИ-картину яичников при поликистозе:
Однако описанная картина иногда бывает лишь ошибочно похожа на поликистозные яичники. Например, весьма похожая картина может быть в 1 фазе цикла (на 5-7 день) вследствие чисто физиологических изменений, которые естественно протекают в половой системе женщины. Кроме того, подобные изменения бывают у женщин на фоне длительного приема оральных контрацептивов, в рамках гипогонадотропной аменореи и, наконец, у девушек в периоде полового созревания.
Таким образом, мультифолликулярные яичники — лишь ультразвуковой симптом менструального цикла в рамках нормы. Однако, учитывая, что картина может быть нечеткой, что есть определенные варианты течения поликистоза яичников, при выявлении картины мультифолликулярных яичников необходимо провести дифференциальную диагностику. Для этого исследуют содержание в крови ЛГ и ФСГ, тестостерона, инсулина. При мультифолликулярных яичниках уровень этих гормонов находится в пределах нормы. А при поликистозе яичников соотношение ЛГ/ФСГ больше 2,5-3, увеличен уровень общего и свободного тестостерона, а также инсулина. Кроме того, о наличии поликистозных яичников свидетельствует также и клиническая картина заболевания.
То же относится и к девушкам периода полового созревания, у которых состояние называют также «формирующийся синдром поликистозных яичников». У них специфическую ультразвуковую картину сопровождают специфические гормональные и внешние изменения.
Таким образом, мультифолликулярные яичники — диагноз не заболевания, а определенного состояния, которое само по себе не является причиной бесплодия, нарушений менструального цикла и т.д. Но проводить дифференциальный диагноз с более тяжелыми состояниями все-таки необходимо.
Для дифференциальной диагностики мультифолликулярных и поликистозных яичников можно использовать следующие признаки:
Часто мультифолликулярные яичники принимают за поликистозные яичники, однако мультифолликулярные яичники следует рассматривать как вариант нормы, а поликистоз яичников — заболевание.
Женские половые органы – яичники, маточные трубы, матка, подвержены изменениям в зависимости от фазы менструального цикла. В начале менструального цикла в яичниках начинают созревать 5-7 фолликулов, но дозревает только один из них. При картине мультифолликулярных яичников одновременно дозревают более 7 фолликулов. Мультифолликулярные яичники часто встречаются в начале полового созревания, когда только устанавливается менструальная функция, у женщин длительно принимающих пероральные контрацептивы, а также на 5-7 день нормального менструального цикла. Иногда синдром мультифолликулярныхяичников может сопровождаться нарушениями менструального цикла, чаще всего это связано с недостаточностью лютеинизирующего гормона, что может быть вызвано резкой потерей веса, или наоборот его набором. При этом может наблюдаться аменорея или олигоменорея. Нарушения менструального цикла, сопровождающие мультифолликулярные яичники, может свидетельствовать о начальной стадии поликистоза яичников.
Часто, только лишь по данным УЗИ, бывает сложно отдифференцировать синдром мультифолликулярный яичников от синдрома поликистозных яичников. В таких случаях, необходимо динамическое наблюдение у гинеколога и определение гормонального фона. Однако, есть ряд УЗИ-признаков, отличающих мультифолликулярные яичники от поликистозных. Главным отличительным признаком является размер яичника, при синдроме мультифолликулярных яичников он нормальный, при поликистозных яичниках увеличен. Количество фолликулов при синдроме мультифолликулярных яичников 8-10, диаметр фолликулов 4-8 мм, приполикистозе более 10, диаметр фолликулов более 10 мм. Мультифолликулярные яичники не сопровождаются гормональными нарушениями, в отличии от поликистозных яичников.
Причины СПКЯ
СПКЯ – часто распространенное гормональное расстройство среди женщин репродуктивного возраста, приводящее к стойкому бесплодию. Несмотря на актуальнось проблемы, точные причины возникновения СПКЯ до сих пор неизвестны.
Помимо гормональных причин, к предрасполагающим факторам, ведущим к развитию СПКЯ, относят:
Симптомы СПКЯ
Молочные железы развиты правильно, у каждой третьей женщины имеет место фиброзно-кистозная мастопатия, развивающаяся на фоне хронической ановуляции и гиперэстрогении.
Практически все пациенки с СПКЯ имеют повышенную массу тела. При этом излишки жира откладываются, как правило,на животе (“центральный” тип ожирения). Поскольку уровень инсулина при СПКЯ повышен, довольно часто заболевание сочетается с сахарным диабетом 2 типа. СПКЯ способствует раннему развитию сосудистых заболеваний, таких какгипертоническая болезнь и атеросклероз.
Поскольку симптомов заболевания много, СПКЯ легко можно перепутать с любым дисгормональным нарушением. В молодом возрасте жирную кожу, угри и прыщи принимают за естественные возрастные особенности, а повышенная волосатость и проблемы с лишним весом зачастую воспринимаются как генетические особенности. Поэтому если менструальный цикл не нарушен и женщина еще не пробовала беременеть, то к гинекологу такие пациентки обращаются редко. Важно знать,что любые подобные проявления не являются нормой и при обнаружении у себя подобных симптомов следует очно проконсультироваться у гинеколога-эндокринолога.
Диагностика СПКЯ
Структурные изменения яичников при СПКЯ характеризуются:
Диагностика СПКЯ включает:
После пробы с дексаметазоном содержание андрогенов незначительно снижается, примерно на 25% (за счет надпочечниковой фракции).
Проба с АКТГ отрицательная, что исключает надпочечниковую гиперандрогению, характерную для адреногенитального синдрома. Отмечено также повышение уровня инсулина и снижение ПССГ в крови.
В клинической практике простым и доступным методом определения нарушения толерантности глюкозы к инсулину является сахарная кривая. Определяется сахар крови сначала натощак, затем — в течение 2 ч после приема 75 г глюкозы. Если через 2 ч уровень сахара крови не приходит к исходным цифрам, это свидетельствует о нарушенной толерантности к глюкозе, т. е. об инсулинрезистентности, что требует соответствующего лечения.
Критериями для постановки диагноза СПКЯ являются:
Лечение СПКЯ
Лечение СПКЯ определяется с учетом выраженности симптомов и желанием женщины забеременеть. Обычно начинают с консервативных методов лечения, при неэффективности показано хирургическое лечение.
Если у женщины имеется ожирение, то лечение следует начать с коррекции массы тела. В противном случае консервативное лечение у таких пациенток не всегда дает желаемый результат.
При наличии ожирения проводятся:
Консервативное лечение СПКЯ
При нарушенном углеводном обмене лечение бесплодия начинают с назначения гипогликемических препаратов из группы бигуанидов (Метформин). Препараты корректируют уровень глюкозы в крови, курс лечения составляет 3-6 месяцев, дозы подбирают индивидуально.
Для стимуляции овуляции применяют гормональный препарат-антиэстроген Кломифен-цитрат, который стимулирует выход яйцеклетки из яичника. Препарат применяют на 5-10 день менструального цикла. В среднем, после применения Кломифена овуляция восстанавливается у 60 % пациенток, беременность наступает у 35 %.
При отсутствии эффекта от Кломифена, для стимуляции овуляции применяют гонадотропные гормоны, такие как Пергонал, Хумегон. Стимуляция гормонами должна проводится под строгим контролем гинеколога. Эффективность лечения оценивают при помощи УЗИ и показателей базальной температуры тела. Если женщина не планирует беременность, для лечения СПКЯ назначают комбинированные оральные контрацеативы (КОК) с антиандрогенными свойствами для восстановления менструального цикла.Такими свойствами обладают КОКи Ярина, Диане-35, Жанин, Джес. При недостаточном антиандрогенном эффекте КОКов, возможно совместное применение препаратов с антиандрогенами (Андрокур) с 5 по 15-й день цикла. Лечение проводят с динамическим контролем показателей гормонов в крови. Курс лечения составляет в среднем от 6 месяцев до года.
Высоким антиандрогенным свойством обладает калийсберегающий диуретик Верошпирон, который также используют при поликистозе яичников. Препарат снижает синтез андрогенов и блокирует их действие на организм. Препарат назначают минимум на 6 месяцев.
Стимуляция овуляции при СПКЯ
Кломифен относится к нестероидным синтетическим эстрогенам. Механизм его действия основан на блокаде рецепторов эстрадиола. После отмены кломифена по механизму обратной связи происходит усиление секреции ГнРГ, что нормализует выброс ЛГ и ФСГ и, соответственно, рост и созревание фолликулов в яичнике. Таким образом, кломифен не стимулирует яичники непосредственно, а оказывает воздействие через гипоталамо-гипофизарную систему. Стимуляция овуляции кломифеном начинается с 5-го по 9-й день менструального цикла, по 50 мг в день. При таком режиме повышение уровня гонадртропинов, индуцированное кломифеном, происходит в то время, когда уже завершился выбор доминантного фолликула. Более раннее назначение кломифена может стимулировать развитие множества фолликулов и увеличивает риск многоплодной беременности. При отсутствии овуляции по данным УЗИ и базальной температуры дозу кломифена можно увеличивать в каждом последующем цикле на 50 мг, достигая 200 мг в день. Однако многие клиницисты полагают, что если нет эффекта при назначении 100-150 мг кломифена, то дальнейшее увеличение дозы нецелесообразно. При отсутствии овуляции при максимальной дозе в течение 3 месяцев пациентку можно считать резистентной к кломифену.
Критериями эффективности стимуляции овуляции служат:
При наличии этих показателей рекомендуется введение овуляторной дозы 7500-10000 МЕ человеческого хорионического гонадотропина — чХГ (профази, хорагон, прегнил), после чего овуляция отмечается через 36-48 ч. При лечении кломифеном следует учитывать, что он обладает антиэстрогенными свойствами, уменьшает количество цервикальной слизи («сухая шейка»), что препятствует пенетрации сперматозоидов и тормозит пролиферацию эндометрия и приводит к нарушению имплантации в случае оплодотворения яйцеклетки. С целью устранения этих нежелательных эффектов препарата рекомендуется после окончания приема кломифена принимать натуральные эстрогены в дозе 1-2 мг. или их синтетические аналоги (микрофоллин) с 10-го по 14-й день цикла для повышения проницаемости шеечной слизи и пролиферации эндометрия.
При недостаточности лютеиновой фазы рекомендуется назначить гестагены во вторую фазу цикла с 16-го по 25-й день. При этом предпочтительнее препараты прогестерона (дюфастон, утрожестан).
Частота индукции овуляции при лечении кломифеном составляет примерно 60-65%, наступление беременности — в 32-35% случаев, частота многоплодной беременности, в основном двойней, составляет 5-6%, риск внематочной беременности и самопроизвольных выкидышей не выше, чем в популяции. При отсутствии беременности на фоне овуляторных циклов требуется исключение перитонеальных факторов бесплодия при лапароскопии.
При резистентности к кломифену назначают гонадотропные препараты — прямые стимулятороы овуляции. Используется человеческий менопаузальный гонадотропин (чМГ), приготовленный из мочи женщин постменопаузального возраста. Препараты чМГ содержат ЛГ и ФСГ, по 75 МЕ (пергонал, меногон, менопур и др.). При назначении гонадотропинов пациентка должна быть информирована о риске многоплодной беременности, возможном развитии синдрома гиперстимуляции яичников, а также о высокой стоимости лечения. Лечение должно проводится только после исключения патологии матки и труб, а также мужского фактора бесплодия. В процессе лечения обязательным является трансвагинальный УЗ-мониторинг фолликулогенеза и состояния эндометрия. Овуляция инициируется путем однократного введения чХГ в дозе 7500-10000 МЕ, когда имеется хотя бы один фолликул диаметром 17 мм. При выявлении более 2 фолликулов диаметром более 16 мм. или 4 фолликулов диаметром более 14 мм. введение чХГ нежелательно из-за риска наступления многоплодной беременности.
При стимуляции овуляции гонадотропинами частота наступления беременности повышается до 60%, риск многоплодной беременности составляет 10-25%, внематочной — 2,5-6%, самопроизвольные выкидыши в циклах, закончившихся беременностью, достигают 12-30%, синдром гиперстимуляции яичников наблюдается в 5-6% случаев.
Хирургическое лечение СПКЯ
Несмотря на достаточно высокий эффект при стимуляции овуляции и наступлении беременности, большинство врачей отмечают рецидив клинической симптоматики СПКЯ примерно через 5 лет. Поэтому послебеременности и родов необходима профилактика рецидива СПКЯ, что важно, учитывая риск развития гиперпластических процессов эндометрия. С этой целью наиболее целесообразно назначение КОК, предпочтительнее монофазных (марвелон, фемоден, диане, мерсилон и др.). При плохой переносимости КОК, что бывает при избыточной массе тела, можно рекомендовать гестагены во вторую фазу цикла: дюфастон в дозе 20 мг. с 16-го по 25-й день цикла.
Женщинам, не планирующим беременность, после первого этапа стимуляции овуляции кломифеном, направленного на выявление резервных возможностей репродуктивной системы, также рекомендуется назначение КОК или гестагенов для регуляции цикла, уменьшения гирсутизма и профилактики гиперпластических процессов.
Физиотерапия и фитнесс для лечения СПКЯ
Физиотерапевтические процедуры также показаны при СПКЯ. Применяют гальванофорез лидазы для активации ферментативной системы яичников. Электроды устанавливают в надлобковой области. Курс лечения-15 дней ежедневно.
Лечение поликистоза яичников длительное, требующее тщательного наблюдения у гинеколога-эндокринолога. Всем женщинам с СПКЯ рекомендуется, по возможности, как можно раньше беременеть и рожать, поскольку симптомы заболевания, увы, с возрастом довольно часто прогрессируют.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
Специальный репортаж
Репродуктивное здоровье женщины и гормоны
13 октября, в рамках VI российского форума «Мать и дитя», при поддержке компании Солвей Фарма, состоялся научный симпозиум «Репродуктивное здоровье женщины и гормоны». На этом мероприятии, посвященном принципам гормональной терапии женщин фертильного возраста, ведущие специалисты-гинекологи смогли представить результаты своих последних исследований и поделиться с коллегами впечатлениями от применения препарата Дюфастон компании Солвей Фарма, представляющего собой аналог природного прогестерона.
В первом докладе профессор НЦАГиП РАМН Вера Михайловна Сидельникова рассмотрела вопросы гормональной поддержки при привычной потере беременности.
Идея применения стероидных гормонов (эстрогенов и прогестерона) для сохранения беременности, в случаях отклонения в эндокринной системе матери, возникла давно. Но длительное время главным препятствием оставались побочные действия на плод существующих препаратов.

Благодаря дальнейшим исследованиям, было выявлено участие прогестерона в процессе беременности. Именно он готовит эндометрий к имплантации, обеспечивая его рост, развитие и васкуляризацию, а за счет нейтрализации окситоцина и снижения синтеза простагландинов обеспечивает состояние покоя матки. Наиболее же интересным оказалось его участие в иммунном взаимодействии матери и эмбриона.
Дело в том, что снижение количества прогестерона, и увеличение числа NK-клеток (что может быть, например, при хроническом эндометрите), запускает синтез провоспалительных цитокинов, оказывающих прямое эмбриотоксическое действие, и активацию протромбиназы, в результате чего происходит отслойка хориона с образованием заоболочечной гематомы и отторжением плода.
Таким образом, стало ясно, что прогестерон играет важную роль при беременности. Но только появление аналогов натурального прогестерона, каким является препарат Дюфастон, позволило избежать появления побочных эффектов у плода, благодаря отсутствию у Дюфастона антигонадотропной, глюкокортикоидной и антиминералокортикоидной активности и большему, по сравнению с натуральным гестагеном, сродству к прогестероновым рецепторам.
Поэтому уже с 1995г, наряду со стимулицией овуляции для формирования более полноценного фолликула, в гинекологической практике применяется и Дюфастон в виде циклической гормональной терапии (2-3 цикла) : фемостон 2/10 с 1-го дня цикла и 10 мг Дюфастона с 14 по 25 день цикла. При наступлении беременности продолжают его прием до 16 недель. И самое главное, наблюдение за детьми, родившимися за эти годы после указанного лечения, не выявляет отклонений в их физическом и психическом развитии.

В последние годы наблюдается четкая тенденция к позднему материнству вследствие различных причин (карьера, повторные браки, и позднее обращение по поводу бесплодия). К сожалению, физиологические процессы запрограммированы так, что число фолликулов начинает уменьшаться уже с 27 лет, и этот процесс резко усиливается после 35 лет. Кроме этого, в старшем возрастном периоде, даже при наличиии регулярного месячного цикла, уровень прогестерона в лютеиновую фазу начинает снижаться. Но если и сохраняется нормальный уровень прогестерона, наблюдается недостаточность секреторной трансформации эндометрия. Все это приводит к тому, что женщина уже в 36-37 лет начинает резко терять репродуктивный потенциал и способность к зачатию.
Профессор Назаренко Т.А. представила присутствующим результаты обследования 200 пациенток, обратившихся по поводу лечения бесплодия, разделенных на 3 группы: 36-40, 41-45 и 46-50 лет. При тщательном обследовании у каждой третьей пациентки были обнаружены соматические и гинекологические заболевания: сахарный диабет, гипретоническая болезнь, холецистит, миома матки, аденомиоз, сальпингоофорит и др. Часты были сочетанные патологии. Выявлено выраженное угасание функционального состояния репродуктивной системы с увеличением возраста. Такая же возрастная корреляция наблюдалась при определении состояния овариального резерва с помощью ультразвукового и доплерометрического исследований. Динамика фолликулогенеза по ультразвуковым и гормональным параметрам показала процентное увеличение ановуляторного цикла с возрастом.
Во всех трех группах проводились стимуляция овуляции и индукция овуляции мочевыми гонадотропинами или рекомбинантным ФСГ, в сочетании с антагонистами и агонистиами гонадотропин-РГ. В результате, в группе женщин до 40 лет частота наступления беременности составила 23%, до 45 лет- всего 8%, в третьей группе беременность ни у одной пациентки не наступила.
Дюфастон в этом исследовании применялся для подготовки пациенток, в течение 2-4 месяцев. Он был определен как эффективный препарат для коррекции гинекологических заболеваний пациенток старшего возраста, благодаря его способности пролиферативный эндометрий переводить в секреторный. Важными оказались именно в данной возрастной категории, отсутствие отрицательного влияния на ЦНС и функции печени, и возможность приема Дюфастона у женщин с артериальной гипертензией и венозными нарушениями.
Патогенез дисфункциональных маточных кровотечений заключается в нарушении циклической функции гипоталамо-гипофизарно-яичниковой системы, результатом чего является ановуляция, гиперэстрогения и гиперплазия тканей эндометрия. И патогенетически обоснованным в этом случае является, после остановки кровотечения, применение гестагенов для профилактики рецидивов, и, в частности Дюфастона, эффективность которого при этой патологии составляет 86,7%. Не менее эффективным оказалось его применение при олигоменорее и некоторых формах аменореи, особенно в период становления менструальной функции.
Механизм действия гестагенов влияет и на процессы, лежащие в основе дисменореи. Влияние его основано на снижении концентрации эстрогенов, уменьшении митотической активности клеток миометрия и сократительной активности миометрия. Также гестагены препятствуют пролиферации эндометрия и вызывают его секреторную трансформацию, снижая одновременно уровень простагландинов в эндометрии. И большой клинический опыт показывает, что комплексное лечение с применением Дюфастона приводит к положительному результату в 69,4%.
Применение Дюфастона в климактерическом периоде восполняет возрастной дефицит прогестерона, предотвращая ряд патологических состояний репродуктивной системы и пролонгирует менструальную функцию при достаточной секреции эстрогенов.
Таким образом, высокая активность и биодоступность Дюфастона, при отсутствии побочных эффектов, делает предпочтительным применение его в качестве циклической гормональной терапии при различных нарушениях менструального цикла.

При эндометриоз-ассоциированном бесплодии применяется лечение, включающее в себя хирургическое удаление очагов эндометриоза и дальнейшую гормональную терапию. А так как первый год после лапароскопии является наиболее благоприятным для наступления беременности, к гормональному препарату предъявляются особые требования: он не должен снижать эффектов гонадотропинов и тормозить овуляцию, оказывать неблагоприятное воздействие на секреторную трансформацию эндометрия, препятствовать оплодотворению и имплантации. Андрогенная и минералокортикоидная активность также должна быть исключена. Препарат Дюфастон соответствует всем вышеперечисленным требованиям, но и при его применении эффективность лечения не превышает 30%. Все дело в том, что при малых формах эндометриоза снижается число рецепторов к прогестерону, на которые и оказывает действие Дюфастон.
Прошедший симпозиум еще раз подтвердил, что спектр применения Дюфастона многообразен. Это позволяет врачам-гинекологам широко использовать его в клинической практике для поддержания репродуктивной активности женщины, даря ей радость материнства и в не самых благоприятных условиях.
Материал подготовил: обозреватель РМС, Лилия Махмутова