Европий в честь чего назван элемент
Европий
Содержание
История
Элемент был выделен в 1886 году из смеси редкоземельных элементов французским химиком Э. А. Демарсе. Его существование было подтверждено спектральным анализом лишь через 15 лет.
Происхождение названия
После подтверждения существования нового элемента Демарсе дал ему название европий — в честь Европы.
Получение
Цены на оксид европия чистотой 99,9—99,99% в 2006 году составили 298—900 долларов США за 1 кг.
Физические свойства
Химические свойства
На воздухе быстро окисляется, поэтому его хранят в банках или ампулах под слоем жидкого парафина.
Применение
Ядерная энергетика
Атомно-водородная энергетика
Оксид европия применяется при термохимическом разложении воды в атомно-водородной энергетике (европий-стронций-йодидный цикл).
Лазерные материалы
Ионы европия служат для генерации лазерного излучения в видимой области спектра с длиной волны 0,61 мк (оранжевые лучи), поэтому оксид европия используется для создания твердотельных, и менее распространённых жидкостных лазеров.
Электроника
Люминофоры
Вольфрамат европия практически очень важный используемый микроэлектроникой люминофор.
Европий в медицине
Катионы европия давно и успешно используются в медицине в качестве флуоресцентных зондов. Радиоактивные изотопы европия применяются при лечении некоторых форм рака.
Другие сферы применения европия
Биологическая роль
Ссылки
af:Europium bn:ইউরোপিয়াম bs:Europijum ca:Europi co:Europiu cs:Europium da:Europium de:Europium el:Ευρώπιο en:Europium eo:Eŭropio es:Europio et:Euroopium fi:Europium fr:Europium gl:Europio (elemento) he:אירופיום hr:Europij hu:Európium hy:Եվրոպիում id:Europium io:Europio it:Europio ja:ユウロピウム jbo:ronjinme ko:유로퓸 la:Europium lb:Europium lt:Europis lv:Eiropijs nl:Europium nn:Europium pl:Europ pt:Európio sh:Europijum sk:Európium sl:Evropij sr:Еуропијум sv:Europium th:ยูโรเพียม ug:يېۋروپىي uk:Європій zh:铕
Европий (Eu) Europium
Быстрый поиск по тексту
Открытие Европия
История данного элемента началась в 1886 году с известного химика по имени Крукс. Он исследовал материал самарскит, где впервые нашёл среди тогда неизвестного никому элемента. Крукс никак особо не отреагировал на свою находку и даже не присвоил этому элементу имя, он обозначил его индексом – «Я». Через некоторое время учёный Буабодран в 1892 году также обнаружил данный элемент при стереоскопическом анализе самариевой земли. Но и этим учёным найденный элемент не был особо обозначен, он дал ему вместо названия индекс Z. Спустя ещё несколько лет, известный химик Демарсэ тоже обнаружил этот элемент, но уже совсем в другом материале. Именно Демарсэ дал этому элементу окончательное название – Европий, в честь названия континента.
За счёт своей редкости и уникальных свойств, Европий достаточно дорогой материал. Его цена варьируется от 700 до 2500 долларов за 1 килограмм. Оксид Европия стоит порядка 450 долларов за 1 килограмм.
Химические свойства
Хочется упомянуть о том, что Европий является самым исследуемым минералом среди всех редкоземельных металлов. По своим химическим свойствам, Европий очень похож на обычные металлы. Он вступает в нормальные реакции практически со всеми неметаллами. Среди всех редкоземельных металлов, Европий обладает самой высокой реакционной способностью. Поверхность данного металла всегда содержит небольшую плёнку оксида, которая защищает металл от внутреннего окисления. В этом смысле Европий достаточно быстро окисляется на открытом воздухе, при этом никак не разрушая свою внутреннюю кристаллическую решётку.
Данный материал обладает очень своеобразной системой хранения. Как правило, данный металл хранят в специальных капсулах, которые покрыты парафином и залиты определённым слоем керосина. Реакции с этими элементами предотвращают процесс окисления. Если нагреть данный материал до температуры в 180 градусов Цельсия, он сразу воспламеняется. В результате этого процесса получается оксид Европия. Одной из особенностей данного металла является его способность к вытеснению любого металла из раствора солей. Также, данный материал легко растворяется в аммиаке. В результате этой реакции получается раствор синего оттенка, что обуславливается большому выделению сольватированных электронов.
Физические свойства Европия
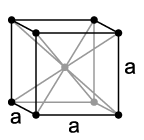
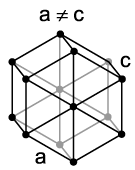
Как и многие другие редкоземельные металлы, Европий представляет из себя достаточно невзрачный серебристо-белый элемент, который достаточно мягкий и гибкий. Данный металл обладает практически самой низкой плотностью, которая составила 5,243 грамма на сантиметр кубический. Несмотря на это, у него достаточно низкая температура плавления, примерно 820 градусов Цельсия, и небольшая температура внутреннего кипения – 1440 градусов Цельсия. Как и другие редкоземельные металлы, Европий обладает высокой гибкостью, тягучестью и ковкостью. Благодаря своим физическим и химическим свойствам, данный металл обладает высокой способностью к физической и механической обработке. Одной из уникальных особенностей данного металла является то, что в зависимости от взаимодействия с внешней окружающей средой, Европий может изменять внутреннюю структуру кристаллической решётки. Если окружающее давление превышает 12,5 ГПа, то кристаллическая решётка Европия представляет собой объёмный шестиугольник. В нормальной же среде, кристаллическая решётка Европия принимает форму обычного объёмного куба, как и у многих других редкоземельных металлов.
Сфер, в которых применяют Европий достаточно много. Можно составить небольшой список основных сфер применения:
В каждой из сфер применения, Европий проявляется различные качества и особенности. Этот материал достаточно востребован, за счёт этого и формируется его высокая цена.
Добыча Европия
В природе, в чистом виде данный материал не встречается. Он выделяется из других редкоземельных металлов, каждый из которых образуется в небольшие месторождения по всему миру. Стоит упомянуть о том, что Европий является самым редким металлом, среди всех редкоземельных элементов. Он также является одним из самых редких материалов из всей периодической таблицы Менделеева. Именно из-за своей редкости, Европий стал одним из самых дорогих и востребованных металлов. В мире существует всего несколько месторождений Европия, которые находятся в различных страна, таких как: Россия, Казахстан, США, Индия, Бразилия, Кения. Самое крупное месторождение данного металла находится в Кении. Именно в этой стране происходит полномасштабная добыча металлов, содержащих в своем составе Европий.
Искусственный синтез
Несмотря на то, что месторождений данного материала не так уж и мало, его доля в этих месторождениях достаточно мала. Именно в этих целях, чаще всего Европий искусственно синтезируется в специальных лабораториях. Существует два способа, при помощи которых можно искусственно вывести Европий в чистом виде. Первый из них используется достаточно часто, он заключается в том, что оксид Европия восстанавливается и обогащается при помощи углерода или лантана. В ходе данной реакции соблюдается абсолютный вакуум, который способствует корректному протеканию реакции. Второй способ менее популярен. Суть данного способа заключается в химическом электролизе расплава Европия. Оба способа процесса протекают достаточно долго, и требуют значительную сумму денежных средств на своё проведение.
Всего в мире производится порядка 140 тысяч тонн данного редкоземельного металла. Большую долю производства взяла на себя Кения, поскольку на её территории самое крупное месторождения металлов, которые содержат Европий.
Европий
Европий / Europium (Eu), 63
Евро́пий — химический элемент, относящийся к группе лантаноидов.
Содержание
История
Элемент был выделен в 1896 году из смеси редкоземельных элементов французским химиком Э. А. Демарсе. Его существование было подтверждено спектральным анализом лишь через 15 лет.
Нахождение в природе
Месторождения
Происхождение названия
После подтверждения существования нового элемента Демарсе дал ему название европий — в честь Европы.
Получение
Металлический европий получают восстановлением Eu2O3 в вакууме лантаном или углеродом, а также электролизом расплава EuCl3.
Физические свойства
Химические свойства
На воздухе быстро окисляется, на поверхности металла всегда есть оксидная пленка. Хранят в банках или ампулах под слоем жидкого парафина или в керосине. Очень активен, может вытеснять из растворов солей почти все металлы. В соединениях, как и большинство РЗЭ, проявляет преимущественно степень окисления +3, при определённых условиях (например, электрохимическим восстановлением, восстановлением амальгамой цинка и др.) можно получить степень окисления +2. Также при изменении окислительно-восстановительных условий возможно получение степени окисления +2 и +3, что соответствует оксиду с химической формулой Eu3O4.
Применение
Ядерная энергетика
Европий используется в качестве поглотителя нейтронов (в основном окись европия, гексаборид и борат европия) в атомных реакторах, но окись постепенно «выгорает», и по срокам эксплуатации уступает карбиду бора в 1,5 раза (хотя имеет преимущество в почти полном отсутствии газовыделения и распухания в мощном потоке нейтронов, например реактор БН-600). Сечение захвата тепловых нейтронов европием (природной смесью изотопов) составляет около 4500 барн, самым активным в отношении захвата нейтронов является европий-151 (9200 барн).
Атомно-водородная энергетика
Оксид европия применяется при термохимическом разложении воды в атомно-водородной энергетике (европий-стронций-йодидный цикл).
Лазерные материалы
Ионы европия служат для генерации лазерного излучения в видимой области спектра с длиной волны 0,61 мкм (оранжевые лучи), поэтому оксид европия используется для создания твердотельных, и менее распространённых жидкостных лазеров.
Электроника
Европий является легирующей примесью в моносульфиде самария (термоэлектрогенераторы), а также как легирующий компонент для синтеза алмазоподобного (сверхтвердого) нитрида углерода. Силицид европия в виде тонких пленок находит применение в интегральной микроэлектронике.
Моноокись европия, а также сплав моноокиси европия и моноокиси самария применяются в виде тонких пленок в качестве магнитных полупроводниковых материалов для стремительно развивающейся функциональной электроники, и в частности МДП — электроники.
Люминофоры
Европий в медицине
Катионы европия давно и успешно используются в медицине в качестве флуоресцентных зондов. Радиоактивные изотопы европия применяются при лечении некоторых форм рака.
Другие сферы применения европия
Влияние на качество воды
В своих реакциях с водой европий химически ведет себя как кальций. При уровнях рН ниже 6 европий способен мигрировать в воде в ионном виде. При более высоких уровнях рН европий образует плохо растворимые и, соответственно, менее подвижные гидроксиды. При контакте с кислородом воздуха происходит дальнейшее окисление до Eu2O3. Максимально наблюдаемые концентрации европия в природных маломинерализованных водах составляют менее 1 мкг/л (в морской воде — 1,1·10 −6 мг/л). Влияние на качество воды при таких концентрациях представляется незначительным. Предельно допустимая концентрация (ПДК) в воде нормируется только российскими нормами и равна (для питьевой воды) 0,3 мг/л.
Пути поступления в организм
Вероятность попадания европия в организм человека представляется незначительной. Возможно поступление европия в организм с водой в микроскопических количествах. Нельзя исключать вероятности и других путей попадания в организм у людей, сталкивающихся с соединениями европия на производстве.
Потенциальная опасность для здоровья
Европий относится к малотоксичным элементам. По крайней мере, не удалось добыть какой-либо информации о последствиях воздействия европия на организм человека. Однако, можно с большой степенью достоверности утверждать, что в силу своих химических свойств, европий (как и другие лантаноиды) может замещать в биологических системах кальций и магний, что приводит к ухудшению здоровья.
Физиологическое значение
На данный момент нет данных о какой-либо биологической роли европия в организме человека.
Примечания
Ссылки
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||








 Электрохимический ряд активности металлов
Электрохимический ряд активности металлов