Fe2 co3 3 что это
Fe2 co3 3 что это
Степень окисления +3 характерна для железа.
Полиморфные модификации оксида железа (III)
α-форма – минерал гематит, кристаллизуется в тригональной сингонии.
γ-форма – маггемит, кристаллизуется в кубической сингонии.
δ-форма – кристаллизуется в тригональной сингонии.
Температуры фазовых переходов:
α-Fe2O3 

Проявляет слабовыраженные амфотерные свойства с преобладанием основных. Легко реагирует с кислотами:
С растворами щелочей не реагирует, но при сплавлении образует ферриты:
Проявляет окислительные и восстановительные свойства. При нагревании восстанавливается водородом или оксидом углерода (II), проявляя окислительные свойства:
В присутствии сильных окислителей в щелочной среде проявляет восстановительные свойства и окисляется до производных железа (VI):
При температуре выше 1400°С разлагается:
Получается при термическом разложении гидроксида железа (III):
или окислением пирита:
Гидроксид железа (III) Fe(OH)3 – кристаллическое или аморфное вещество бурого цвета. Как и оксид, проявляет слабовыраженные амфотерные свойства с преобладанием основных. Легко реагирует с кислотами:
Реагирует с концентрированными растворами щелочей с образованием гексагидроксоферратов (III):
при сплавлении со щелочами или щелочными реагентами образует ферриты:
В присутствии сильных окислителей в щелочной среде проявляет восстановительные свойства и окисляется до производных железа (VI):
При нагревании разлагается:
Получается при взаимодействии солей железа (III) с растворами щелочей:
Соли железа (III). Железо (III) образует соли практически со многими анионами. Обычно соли кристаллизуются в виде бурых кристаллогидратов: Fe(NO3)3·6H2O, FeCl3·6H2O, NaFe(SO4)2·12H2O (железные квасцы) и др. В растворе соли железа (III) значительно более устойчивы, чем соли железа (II). Растворы солей имеют желто-бурую окраску и, вследствие гидролиза, кислую среду:
Соли железа (III) гидролизуют в большей степени, чем соли железа (II), по этой причине соли железа (III) и слабых кислот нельзя выделить из раствора, они мгновенно гидролизуют с образованием гидроксида железа (III):
Проявляют все свойства солей.
Обладают преимущественно восстановительными свойствами:
Качественная реакция на катион Fe 3+ – взаимодействие с гексацианоферратом (II) калия (желтой кровяной солью) 
Кроме того, ионы Fe 3+ определяют по характерному кроваво-красному окрашиванию роданида железа (III), который образуется в результате взаимодействия соли железа (III) с роданидом калия или аммония:
Карбонат железа(II)
| Карбонат железа(II) | |
| Общие | |
|---|---|
| Систематическое наименование | Карбонат железа(II) |
| Традиционные названия | Углекислое железо |
| Химическая формула | FeCO3 |
| Физические свойства | |
| Состояние (ст. усл.) | белые кристаллы |
| Молярная масса | 115,86 г/моль |
| Плотность | 3,8; 3,82-3,90 г/см³ |
| Термические свойства | |
| Температура плавления | разл. 490 °C |
| Энтальпия образования (ст. усл.) | -741 кДж/моль |
| Оптические свойства | |
| Показатель преломления | 1,635; 1,875 |
Карбонат железа(II) — неорганическое соединение, соль металла железа и угольной кислоты с формулой FeCO3, белые кристаллы, не растворяется в воде, образует кристаллогидрат.
Содержание
Получение
Физические свойства
Карбонат железа(II) образует белые кристаллы тригональной сингонии, пространственная группа R 3 c, параметры ячейки a = 0,582 нм, α = 47,75°, Z = 2.
Образует кристаллогидрат состава FeCO3•H2O.
Не растворяется в воде.
Химические свойства
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Карбонат железа(II)» в других словарях:
карбонат железа(II) — углекислое железо(II) … Cловарь химических синонимов I
ЖЕЛЕЗА ЗАКИСНОГО КАРБОНАТ С САХАРОМ — Ferri carbonas saccharatus. Синоним: железо углекислое закисное с сахаром. Свойства. Аморфный зеленовато серый порошок сладкого, слабовяжущего вкуса. Нерастворим в воде, растворим в разведенной соляной кислоте. Содержит не менее 10 % железа в за … Отечественные ветеринарные препараты
Карбонат марганца(II) — Карбонат марганца(II) … Википедия
КАРБОНАТ КАЛЬЦИЯ — (СаСО2), соединение белого цвета, нерастворимое в воде, встречающееся в природе в таких формах, как мрамор, мел, известняк и кальцит. Из него состоят также раковины моллюсков. Кристаллы имеют шестигранное строение, форма их варьирует от… … Научно-технический энциклопедический словарь
Карбонат бериллия — Под вечный гул вертящихся колес. Карбонат бериллия Общие Химическая формула BeCO3 Физические свойства Молярная масса 69.0211 г/моль Термические свойства … Википедия
железа(III) карбонат — geležies(III) karbonatas statusas T sritis chemija formulė Fe₂(CO₃)₃ atitikmenys: angl. ferric carbonate; iron(III) carbonate rus. железа(III) карбонат; железо углекислое ryšiai: sinonimas – digeležies tris(trioksokarbonatas) … Chemijos terminų aiškinamasis žodynas
железа(II) карбонат — geležies(II) karbonatas statusas T sritis chemija formulė FeCO₃ atitikmenys: angl. ferrous carbonate; iron(II) carbonate rus. железа(II) карбонат ryšiai: sinonimas – geležies trioksokarbonatas … Chemijos terminų aiškinamasis žodynas
Сульфат железа(II) — У этого термина существуют и другие значения, см. Сульфат железа. Сульфат железа(II) … Википедия
Хлорид железа(II) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(II) … Википедия
Углерод
Углерод
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Природные соединения
Получение
Химические свойства
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
Может восстановить и собственный оксид:
В реакциях с кислотами углерод проявляет себя как восстановитель:
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Углерод
Углерод
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Природные соединения
Получение
Химические свойства
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
Может восстановить и собственный оксид:
В реакциях с кислотами углерод проявляет себя как восстановитель:
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
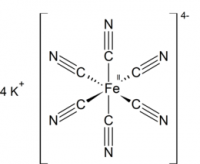
Желтая кровяная соль
| Калий железистосинеродистый | |
|---|---|
 | |
 |
наименование
тригидрат — бледно-жёлтые кристаллы
650 °C
Гексацианоферрат (II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферроат калия, жёлтая кровяная соль) — комплексное соединение двухвалентного железа K4[Fe(CN)6], существующее обычно в виде тригидрата K4[Fe(CN)6]·3H2O.
Содержание
История открытия и тривиальные названия
Тривиальное название появилось из-за того, что ранее «жёлтую кровяную соль» получали путём сплавления отходов с боен (в частности, крови) с поташом и железными опилками. Это, а также жёлтый цвет кристаллов, обусловили название соединения.
Получение
В настоящее время в промышленности получают из отработанной массы после очистки газов на газовых заводах (содержит цианистые соединения); эту массу обрабатывают суспензией Ca(OH)2; фильтрат, содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он также может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. цианид калия переводит Fe 2+ в белый осадок гексацианоферрата(II) железа(II) (а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого цианида со щёлочью: 3Fe(CN)2 + 4KOH → 2Fe(OH)2↓ + K4[Fe(CN)6]):
2. затем осадок растворяется в избытке KCN с образованием «жёлтой кровяной соли»:
Fe2[Fe(CN)6] + 12CN − → 3[Fe(CN)6] 4−
Химические свойства
Светло-жёлтые кристаллы с тетрагональной решеткой, существующие в виде тригидрата K4[Fe(CN)6]·3H2O.
Плотность 1,853 г/см³ при 17 °C. Растворимость в воде 31,5 г/100 г при 25 °C, 48,3 г при 50 °C. Практически не растворяется в эфире, этаноле, пиридине, анилине, этилацетате.
Гексацианоферрат(II) калия диамагнитен.
Выше 87,3 °C (по другим данным, выше 120 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается:
В реакции с соляной кислотой выделяется белый осадок железистосинеродистой кислоты (H4[Fe(CN)6]).
С концентрированной серной кислотой реагирует по уравнению:
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
С солями металлов в степени окисления +2 и +3, образует малорастворимые соединения гексацианоферратов(II) (см. в разделе «применение»).
В водных растворах окисляется хлором и другими окислителями, такими, как пероксид водорода до K3[Fe(CN)6]:
Токсичность
Нейтральное вещество, не разлагается в воде и внутри человеческого организма. Летален при приёме перорально дозы в 6400 мг/кг (испытания на крысах).
Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
1. Fe 3+ : образуется малорастворимый синий осадок «берлинской лазури»:
или, в ионной форме
Получающийся гексацианоферрат(II) калия-железа(III) слабо растворим (с образованием коллоидного раствора), поэтому носит название «растворимая берлинская лазурь».
2. Zn 2+ : образуется белый осадок гексацианоферрата(II) цинка-калия:
или, в ионной форме
3. Cu 2+ : из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
или, в ионной форме
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. Применяется как добавка к поваренной соли.
Мнемоническое правило
Для того, чтобы запомнить формулу желтой кровяной соли K4[Fe(CN)6] и не спутать её с красной кровяной солью K3[Fe(CN)6], существует мнемоническое правило:
аммония • бария • железа(II) • железа(III) • калия • кальция • кобальта • магния • марганца • меди(II) • натрия • никеля • олова • свинца • стронция • таллия • цинка • Железистосинеродистая кислота H4[Fe(CN)6]
железа(II) • железа(II,III) • калия • кальция • кобальта • меди(I) • натрия • неодима(III) • олова • свинца • Железосинеродистая кислота H3[Fe(CN)6]

















