Fe2 so4 что это
Сульфат железа(III)
| Сульфат железа(III) | |
 | |
   | |
| Общие | |
|---|---|
| Систематическое наименование | сульфат железа(III) |
| Традиционные названия | сернокислое железо(III), тетрасульфид(VI) железа(III) |
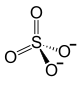
| Химическая формула | Fe2(SО4)3 |
| Эмпирическая формула | Fe2O12S3 |
| Физические свойства | |
| Состояние (ст. усл.) | безводный — светло-жёлтый порошок |
| Молярная масса | (безв.) 399.88 г/моль |
(пентагидрат) 489.96 г/моль
(безв.) растворим в разбавленной серной кислоте, ацетоне
15244-10-7 (для всех гидратов с формулой Fe2(SО4)3·nН2О (где n=1, 3, 4, 6, 7, 9, 10, 12)
Содержание
Физические свойства
Безводный сульфат железа(III) — светло-желтые, парамагнитные, очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм,c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде и ацетоне, не растворяется в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 3. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа(III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды) и этаноле, не растворяется в ацетоне. В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Все перечисленные выше природные гидраты железа являются непрочными соединениями и в открытом состоянии быстро выветриваются.
Получение
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:

Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммиака и калия, и вода:

Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
Нагрев пентагидрат до температуры 70—175 °C получим безводный сульфат железа(III):
Сульфат железа(II) можно окислить таким экзотическим окислителем, как оксид ксенона(III):
Химические свойства
Сульфат железа(III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:


Горячая вода или пар разлагают сульфат железа(III):
Безводный сульфат железа(III) при нагревании разлагается:

Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:

Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа(III) и железа(II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа(III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа(III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа(III) (гетерозит):
Сульфат железа и железный купорос, характеристика, свойства и получение, химические реакции
Сульфат железа и железный купорос, характеристика, свойства и получение, химические реакции.
Сульфат железа – неорганическое вещество, имеет химическую формулу FeSO4.
Краткая характеристика сульфата железа:
Сульфат железа – неорганическое вещество белого или бесцветного цвета.
Химическая формула сульфата железа FeSO4.
С водой сульфат железа образует кристаллогидраты: гептагидрат сульфата железа FeSO4·7H2O, именуемый также железный купорос (прозрачные кристаллы светлого голубовато-зелёного цвета), тетрагидрат сульфата железа FeSO4·4H2O (прозрачные кристаллы зелёного цвета), моногидрат сульфата железа FeSO4·H2O.
Сульфат железа негорюч, пожаро- и взрывобезопасен.
В природе сульфат железа встречается в виде минерала мелантерита (FeSO4·7H2O).
Краткая характеристика железного купороса:
Железный купорос – неорганическое вещество светлого голубовато-зелёного цвета.
Химическая формула железного купороса FeSO4·7H2O.
Железный купорос – гептагидрат сульфата железа.
Хорошо растворяется в воде.
На воздухе постепенно выветривается (теряет кристаллизационную воду).
Железный купорос негорюч, пожаро- и взрывобезопасен.
Железный купорос относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.007.
Физические свойства сульфата железа:
| Наименование параметра: | Значение: |
| Химическая формула | FeSO4 |
| Синонимы и названия иностранном языке | iron (II) sulfate (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м 3 | 1898 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см 3 | 1,898 |
| Температура кипения, °C | — |
| Температура плавления, °C | — |
| Температура разложения, °C | 680 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 151,932 |
| Растворимость в воде (20 o С), г/100 г | 26,3 |
Физические свойства железного купороса:
| Наименование параметра: | Значение: |
| Химическая формула | FeSO4·7H2O |
| Синонимы и названия иностранном языке | гептагидрат сульфата железа (II) |
iron (II) sulfate heptahydrate (англ.)
железный купорос (рус.)
Получение сульфата железа:
В промышленности сульфат железа получают как побочный продукт при травлении железных листов, проволоки, удалении окалины и пр., а также как побочный продукт производства оксида титана из ильменита.
Сульфат железа в промышленности может быть получен путем окислительного обжига пирита (FeS2).
В лаборатории сульфат железа получают в результате следующих химических реакций:
Сульфат железа: что это, свойства, применение, побочные эффекты и пр
Получение
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
2FeS2+14H2SO4⟶Fe2(SO4)3+15SO2↑+14H2O<\displaystyle <\mathsf <2FeS_<2>+14H_<2>SO_<4>\longrightarrow Fe_<2>(SO_<4>)_<3>+15SO_<2>\uparrow +14H_<2>O>>>
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммония и калия, и вода:
Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
При нагревании пентагидрата до температуры 70—175 °C получается безводный сульфат железа(III):
Сульфат железа(II) можно окислить триоксидом ксенона:
Методы получения
Взаимодействие сульфатов железа(II) и калия
Для получения грамм сульфата железа(II)-калия требуется грамм сульфата железа(II) и грамм сульфата калия.
Вещества раздельно растворяют в горячей воде, затем оба раствора сливают в одну емкость, тщательно смешивая. При охлаждении или испарении начинает кристаллизоваться двойная соль. Осадок отфильтровывают, промывают небольшим количеством этанола или ацетона, растворяют в воде, после чего раствор используют для выращивания кристаллов.
Взаимодействие хлорида или нитрата железа(II) и сульфата калия
Для получения грамм сульфата железа(II)-калия требуется грамм хлорида и грамм сульфата калия.
В емкость с насыщенным раствором соли железа комнатной температуры вливают концентрированный раствор сульфата калия и перемешивают. При замораживании смеси выделяется большое количество кристаллического осадка двойной соли. После завершения реакции для очистки от избытка непрореагировавших веществ в раствор добавляют большое количество холодного этанола или ацетона, соль осаждается на дно в виде мелких кристаллов или порошка. Осадок отфильтровывают, промывают небольшим количеством того же холодного растворителя, растворяют в воде, после чего раствор используют для выращивания кристаллов.
Взаимодействие сульфата железа(II) и нитрата или хлорида калия
Для получения грамм сульфата железа(II)-калия требуется грамм хлорида или грамм нитрата калия и грамм сульфата железа(II).
В емкость с насыщенным раствором сульфата железа(II) комнатной температуры вливают концентрированный раствор соли калия и перемешивают. При замораживании смеси выделяется большое количество кристаллического осадка двойной соли. После завершения реакции для очистки от избытка непрореагировавших веществ в раствор добавляют большое количество холодного этанола или ацетона, соль осаждается на дно в виде мелких кристаллов или порошка. Осадок отфильтровывают, промывают небольшим количеством того же холодного растворителя, растворяют в воде, после чего раствор используют для выращивания кристаллов.
Взаимодействие железокалиевых квасцов, чистого железа и серной кислоты
Для получения грамм сульфата железа(II)-калия требуется грамм железокалиевые квасцы, грамм железа и грамм серной кислоты.
В емкость с разбавленной кислотой небольшими порциями добавляют соответствующее соединение железа, а также чистое металлическое железо и перемешивают до его полного растворения. После завершения реакции для очистки от избытка непрореагировавших веществ в раствор добавляют большое количество холодного этанола или ацетона, соль осаждается на дно в виде мелких кристаллов или порошка. Осадок отфильтровывают, промывают небольшим количеством того же холодного растворителя, растворяют в воде, после чего раствор используют для выращивания кристаллов.
Применение железного купороса в садоводстве
Сульфат железа применяют в саду в качестве:
От болезней
Сульфат железа – выборочный гербицид, контактный минеральный фунгицид и натуральный антисептик.
Защитное действие железного купороса при обработке деревьев и винограда:
От вредителей
Важно обработать сад осенью или ранней весной для избавления от жучков, садовых муравьев и других вредных насекомых. Вредители оставляют в коре личинки, нужно уничтожить их до того момента, когда вредители активизируются
Осенняя побелка с добавлением сульфата железа защитит сад (особенно молодые деревья и кусты) от зайцев и грызунов. За зимний период они объедят кору до самых скелетных веток.
Избавить лозу от мучнистого червеца и виноградной подушечницы поможет осенняя обработка железным купоросом винограда и приствольного пространства раствором из расчета 45-50 г на 1 л воды.
Отличия медного и железного купороса
В чем разница между железным и медным купоросом? Медным купоросом опрыскивают листву и зеленые части растений. А железным купоросом обрабатывают стволы и ветви деревьев, кустарников, винограда, причем до распускания почек или поздней осенью.
В отличие от медного, железный купорос практически не содержит токсичных элементов. Однако его передозировка опасна побочными эффектами.
Использование сульфата железа в строительстве
Это химическое вещество исстари применяли для увеличения долговременности деревянных построек.
Начиная с античных греков люди искали материалы, которые помогали бы защитить древесину домов от гниения. Они покрывали их растительными маслами, затем различными красками и лаками. Эффект, в лучшем случае, был не долговременным. Краски и лаки отшелушивались и в этих местах быстро начинали развиваться процессы гниения.
Много более эффективным оказался путь уничтожения бактерий и грибков, разрушающих древесину при помощи различных химических веществ. Сегодня такой метод называется биоцидным. В его основе – пропитка древесины импрегнантами (антисептическими растворами) Среди наиболее эффективных импрегнантов – железный купорос.
Для защиты древесины раствор железного купороса:
Еще больший позитивный эффект дает промышленное обрабатывание сернокислым железом деревянных конструкций. Его выполняют одним из ниже приведенных методов:
В сельских местностях скандинавских стран и по сегодня применяют старинный специальный состав для окрашивания домов и заборов с целью их защиты от гниения на основе сульфата железа. В состав входят:
В муку постепенно вводят 1/3 части воды и размешивают до получения клейстера, который процеживают и затем нагревают постоянно тщательно размешивая, а затем вводят соль, известковый пигмент и железный купорос – после их полного растворения добавляют остаток воды, предварительно нагрев его.
В случае желания придания краске какого-либо цвета – в неё добавляют соответствующие пигменты. Краску на деревянные поверхности наносят без грунтовки и в два слоя. Расход краски при этом составляет 0,3 килограмма на квадратный метр. Минимальный срок эксплуатации таких поверхностей при атмосферных условиях Норвегии, северных областей Финляндии – двадцать лет.
К достоинствам пропиток на основе сульфата железа строители относят его хорошую водорастворимость (в холодной воде можно приготовить 25% раствор, в горячей – 55%), а также то, что такие растворы не корродируют железные детали.
В России был изобретен и забинтован метод изготовления древесно-волокнистых и древесно-стружечных плит для строительной и мебельной промышленности из древесных материалов, содержащих целлюлозу и лигнин путем их поэтапной обработки. На одном из этапов основным элементом сложной технологии выступает такой модифицирующий агент, как сульфат железа, который вводят в разогретую паром древесную массу при t=190°C, а затем прессуют в плиты при t=190°C.
Поскольку в данном методе не используются вещества фенольной природы – получаются экологически безопасные плиты повышенной прочности, не подверженные процессам гниения и не выделяющие при эксплуатации формальдегидов. Такие плиты также просты в обработке, влагоустойчивы, мало горючи.
Модифицирующая добавка из сульфата железа одновременно значительно повышает прочность плиточного материала, укорачивает время, нужное для изготовления плит. В строительной промышленности сульфат железа применяют и при изготовлении клинкерных смесей, сухих штукатурок, цементов для удаления ионов шестивалентного хрома.
Как разводить препарат
Чтобы развести железный купорос для обработки растений, нужна тара из стекла, керамики или пластика без остатков других веществ. Порядок действий будет таким:
Количество железного купороса подбирается в зависимости от целей использования и вида обрабатываемых культур (о них подробнее ниже). Например, чтобы сделать 3%-й раствор, требуется 300 г препарата на 10 л воды. Чтобы получить 1%-ю концентрацию, нужно 100 г, 5%-ю – 500 г вещества.
Когда нет весов необходимое количество сульфата железа поможет отмерить спичечный коробок, куда вмещается 22 г, столовая ложка – 16 г, чайная – 5 г.
Нахождение в природе
Минералогическая форма сульфата железа(III) — микасаит (англ. mikasaite), смешанный сульфат железа-алюминия. Его химическая формула — (Fe3+, Al3+)2(SO4)3. Этот минерал содержит безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще, например:
Кокимбит (англ. coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.

Кристаллическая структура кокимбита
Все перечисленные выше природные гидраты железа на поверхности Земли нестабильны. Но их запасы постоянно пополняются благодаря окислению других минералов (в основном пирита и марказита).
Сульфат железа и ярозит были обнаружены двумя марсоходами: «Спирит» и «Оппортьюнити». Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года «Спирит» застрял, когда ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта. Вследствие того, что сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Молекулярная масса
Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Физические свойства железного купороса:
| Наименование параметра: | Значение: |
| Химическая формула | FeSO4·7H2O |
| Синонимы и названия иностранном языке | гептагидрат сульфата железа (II) |
iron (II) sulfate heptahydrate (англ.)
железный купорос (рус.)
Все вещества состоят из атомов и молекул
В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ
Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Методы получения
Взаимодействие чистого железа, нитрата аммония и серной кислоты
Для получения грамм сульфата железа(III)-аммония требуется грамм железа, грамм нитрата аммония и грамм серной кислоты.
В емкость с кислотой небольшими порциями добавляют соответствующее соединение железа и перемешивают до его полного растворения. После завершения реакции раствор фильтруют и используют для выращивания кристаллов.В раствор кислоты добавляют нитрат аммония
Осторожно, выделяющийся оксид азота сильно раздражает глаза и легкие! Процедуру проводить исключительно в вытяжном шкафу или на открытом воздухе!
Взаимодействие сульфатов железа и аммония
Для получения грамм сульфата железа(III)-аммония требуется грамм сульфата железа(III) и грамм сульфата аммония.
Вещества раздельно растворяют в горячей воде, затем оба раствора сливают в одну емкость, тщательно смешивая. При охлаждении или испарении начинает кристаллизоваться двойная соль.
Взаимодействие соли Мора и перекиси водорода в растворе серной кислоты
Для получения грамм сульфата железа(III)-аммония требуется грамм соли Мора, грамм перекиси водорода и грамм серной кислоты.
В емкость с раствором серной кислоты добавляют перекись водорода и затем небольшими проциями при перемешивании добавляют соль Мора до прекращения выделения газа.
Взаимодействие нитрата или хлорида железа(III) и сульфата аммония
Для получения грамм сульфата железа(III)-аммония требуется грамм нитрата железа(III) или грамм хлорида железа(III) и грамм сульфата аммония.
Вещества раздельно растворяют в горячей воде, затем оба раствора сливают в одну емкость, тщательно смешивая. При охлаждении или испарении начинает кристаллизоваться двойная соль. Осадок отфильтровывают, промывают небольшим количеством этанола или ацетона, растворяют в воде, после чего раствор используют для выращивания кристаллов.
Взаимодействие сульфата железа(III) и нитрата или хлорида аммония
Для получения грамм сульфата железа(III)-аммония требуется грамм сульфата железа(III) и грамм нитрата аммония или грамм хлорида аммония.
Вещества раздельно растворяют в горячей воде, затем оба раствора сливают в одну емкость, тщательно смешивая. При охлаждении или испарении начинает кристаллизоваться двойная соль. Осадок отфильтровывают, промывают небольшим количеством этанола, растворяют в воде, после чего раствор используют для выращивания кристаллов.
Взаимодействие нашатырного спирта, гидроксида железа(III) и серной кислоты
Для получения грамм сульфата железа(III)-аммония требуется грамм нашатырного спирта, грамм гидроксида железа(III) и грамм серной кислоты.
В емкость с кислотой небольшими порциями добавляют соответствующее соединение аммония и железа и перемешивают до его полного растворения, а в случае с карбонатом – до прекращения выделения углекислого газа. После завершения реакции раствор фильтруют и используют для выращивания кристаллов.
Состав и свойства
Железный купорос (сульфат железа) – вещество в виде порошка или кристаллов бледно-зеленого цвета без запаха, являющееся результатом взаимодействия двухвалентного железа (обычно не менее 53%) с серой. Оно используется как основа раствора для полива и опрыскивания растений в саду и на огороде. Тем более, что за счет хорошей растворимости в теплой воде приготовить его очень легко.
Благодаря активным компонентам препарат способен обеспечить защиту растений и почвы от вредоносной микрофлоры, восполнить в них запасы железа – микроэлемента, участвующего в окислительных и восстановительных процессах в клетках
Важно не путать его с медным купоросом, поскольку последний имеет светло-синий оттенок, отличается худшей растворимостью в воде и имеет более высокий класс опасности
Получение
В настоящее время в промышленности получают из отработанной массы после очистки газов на газовых заводах (содержит цианистые соединения); эту массу обрабатывают суспензией Ca(OH)2; фильтрат, содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он также может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. цианид калия переводит Fe2+ в белый осадок гексацианоферрата(II) железа(II) (а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого цианида со щёлочью: 3Fe(CN)2 + 4KOH → 2Fe(OH)2↓ + K4[Fe(CN)6]):
2. затем осадок растворяется в избытке KCN с образованием «жёлтой кровяной соли»:
Описание действующего вещества Железа сульфат/ Ferrous sulfate.
Формула: FeSO4, химическое название: Железа (II) сульфат.Фармакологическая группа: гематотропные средства/ стимуляторы гемопоэза; метаболики/ макро- и микроэлементы.Фармакологическое действие: противоанемическое, восполняющее дефицит железа.
Фармакологические свойства
Сульфат железа обеспечивает (субстратно) продукцию метаболитов, содержащих железо (гемоглобин, миоглобин, многие ферменты). Обычны железо поступает с пищей, в двенадцатиперстной кишке всасывается и переносится транспортными белками (трансферретины) в тканевые депо. При недостаточности железа (включая и нарушение всасывания, недостаточное содержание железа в пище, дефицит трансферринов, паразитарные инвазии, кровопотерю) развивается сидероахрестический синдром и гипохромная железодефицитная анемия.
Показания
Терапия и профилактика железодефицитных состояний, которые вызваны разнообразными причинами: кровотечения (включая метроррагию, полименорею, роды, язвенную болезнь, геморрой, частые носовые кровотечения, хирургические вмешательства, кровопотери при прочей патологии); нарушение всасывания железа или недостаточность его поступления с пищей (ахлоргидрия, хроническая диарея, гастрэктомия, болезнь Крона, целиакия, энтерит, синдром мальабсорбции), повышенная потребность в железе (период лактации, беременность, интенсивного роста, ожоги, донорство, гемодиализ).
Способ применения железа сульфата и дозы
Сульфат железа принимается внутрь, 0,3 – 0,4 г 3 – 4 раза в сутки.
Возможно стойкое потемнение зубов, окрашивание фекалий в коричнево-черный цвет. Почечная или/и печеночная недостаточность повышают вероятность кумуляции железа
С осторожностью использовать сульфат железа при язвенной болезни, язвенном колите, энтерите
Противопоказания к применению
Гиперчувствительность, гемохроматоз, нарушение обмена железа в организме, гемосидероз, талассемия, гемолитическая и апластическая анемия, дисфункции желудочно-кишечного тракта, которые препятствуют всасыванию железа.
Побочные действия железа сульфата
Нервная система: головная боль, слабость, головокружение, раздражительность, энцефалопатия с эпилептическим синдромом (редко);сердечно-сосудистая система: ощущение давления за грудиной;система пищеварения: тошнота, диарея или запор, рвота, зубная боль, боли в животе;аллергические реакции: сыпь, зуд, анафилактический шок (редко);прочие: боли в горле, гиперемия кожи.
Взаимодействие железа сульфата с другими веществами
Железа сульфат уменьшает активность пеницилламина и тетрациклинов (при совместном использовании в желудочно-кишечном тракте формируются плохо всасывающиеся комплексы). Аскорбиновая кислота увеличивает, а антациды снижают всасывание железа.
Передозировка
При передозировке сульфатом железа появляются тошнота, боли в животе, рвота, диарея, учащенный пульс, повышенная проницаемость капилляров, сердечно-сосудистый коллапс. Необходимо: промывание желудка, применение дефероксамина, связывающего ионы железа.
































