Fe2o3 что за оксид
Оксид железа(III)
| Оксид железа(III) | |
 | |
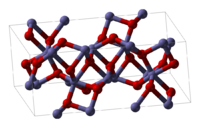 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид железа(III) |
| Традиционные названия | окись железа, колькотар, крокус, железный сурик |
| Химическая формула | Fe2O3 |
| Эмпирическая формула | Fe2O3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 159,69 г/моль |
| Плотность | 5,242 г/см³ |
| Термические свойства | |
| Температура плавления | 1566 °C |
| Классификация | |
| Рег. номер CAS | 1309-37-1 |
Содержание
Свойства
Оксид железа(III) — амфотерный оксид с большим преобладанием основных свойств. Красно-коричневого цвета. Термически устойчив до высоких температур. Образуется при сгорании железа на воздухе. Не реагирует с водой. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели.
В природе встречается как широко распространённый минерал гематит, примеси которого обуславливают красноватую окраску латерита, красноземов, а также поверхности Марса.
Получение
Термическое разложение соединений солей железа(III) на воздухе:

Химические свойства
1. Взаимодействие с разбавленной соляной кислотой:
4. Восстановление железа водородом:
Применение
Применяется как сырьё при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель аналоговой и цифровой информации (напр. звука и изображения) на магнитных лентах, как полирующее средство (красный крокус) для стали и стекла.
В пищевой промышленности используется в качестве пищевого красителя (E172).
См. также
Литература
Полезное
Смотреть что такое «Оксид железа(III)» в других словарях:
Оксид хрома(III) — Оксид хрома(III) … Википедия
Оксид железа(II,III) — Общие Систематическое наименование О … Википедия
Оксид железа(II) — Общие Систематическое наименование Оксид железа(II) Химическая формула FeO … Википедия
Оксид железа — Оксиды железа соединения железа с кислородом. Известно 3 наиболее распространённых оксида железа: Fe3O4, Магнетит распространённый минерал железа, FeO вюстит (см. ниже) Fe2O3 гематит (см. ниже) Оксид железа(II) Оксид железа FeO чёрные кристаллы,… … Википедия
Оксид железа (II) — Оксиды железа соединения железа с кислородом. Известно 3 наиболее распространённых оксида железа: Fe3O4, Магнетит распространённый минерал железа, FeO вюстит (см. ниже) Fe2O3 гематит (см. ниже) Оксид железа(II) Оксид железа FeO чёрные кристаллы,… … Википедия
железа(III) оксид — geležies(III) oksidas statusas T sritis chemija formulė Fe₂O₃ atitikmenys: angl. colcothar; ferric oxide; iron minium; iron sesquioxide; ironic oxide; iron(III) oxide; Prussian red; red iron oxide; red ocher, US; red ochre, GB; Spanish oxide rus … Chemijos terminų aiškinamasis žodynas
Сульфат железа(III) — У этого термина существуют и другие значения, см. Сульфат железа. Сульфат железа(III) … Википедия
Бромид железа(III) — У этого термина существуют и другие значения, см. Бромид железа. Бромид железа(III) Общие Традиционные названия Трибомид железа Химическая формула FeBr3 Физические свойства Сос … Википедия
Фторид железа(III) — У этого термина существуют и другие значения, см. Фторид железа. Фторид железа(III) Общие Систематическое наименование Фторид железа(III) Традиционные названия Фтористое железо Химическая формула FeF3 … Википедия
Оксид железа (III), свойства, получение, химические реакции
Оксид железа (III), свойства, получение, химические реакции.
Оксид железа (III) – неорганическое вещество, имеет химическую формулу Fe2O3.
Краткая характеристика оксида железа (III):
Оксид железа (III) – неорганическое вещество красно-коричневого цвета.
Оксид железа (III) содержит три атома кислорода и два атома железа.
Химическая формула оксида железа (III) Fe2O3.
В воде не растворяется. С водой не реагирует.
Оксид железа (III) – амфотерный оксид с большим преобладанием основных свойств. Как амфотерный оксид проявляет в зависимости от условий либо основные, либо кислотные свойства.
Модификации оксида железа (III):
Известны следующие кристаллические модификации железа: α-Fe2O3, γ-Fe2O3.
Физические свойства оксида железа (III)*:
| Наименование параметра: | Значение: |
| Химическая формула | Fe2O3 |
| Синонимы и названия иностранном языке | iron(III) oxide (англ.) |
красный железняк (рус.)
* оксид железа α-форма.
Получение оксида железа (III):
В природе встречается в виде минералов гематита (красный железняк), лимонита и маггемита.
Оксид железа (III) получают в результате следующих химических реакций:
Химические свойства оксида железа (III). Химические реакции оксида железа (III):
Оксид железа (III) относится к амфотерным оксидам, но с большим преобладанием основных свойств.
1. реакция оксида железа (III) с алюминием:
В результате реакции образуется оксид алюминия и железо.
2. реакция оксида железа (III) с углеродом:
В результате реакции образуется железо и оксид углерода.
3. реакция оксида железа (III) с водородом:
В результате реакции в первом случае образуется оксид железа (II) и вода, во втором – железо и вода, в третьем – оксид железа (II, III) и вода.
4. реакция оксида железа (III) с железом:
В результате реакции образуется оксид железа (II).
5. реакция оксида железа (III) с оксидом натрия :
В результате реакции образуется соль – феррат натрия.
6. реакция оксида железа (III) с оксидом магния :
В результате реакции образуется соль – феррит магния.
7. реакция оксида железа (III) с оксидом меди ( II ) :
В результате реакции образуется соль – феррит меди.
8. реакция оксида железа (III) с оксидом титана:
В результате реакции образуется соль – феррит титана.
9. реакция оксида железа (III) с оксидом марганца:
В результате реакции образуется соль – феррит марганца.
10. реакция оксида железа (III) с оксидом никеля:
В результате реакции образуется соль – феррит никеля.
11. реакция оксида железа (III) с оксидом кадмия:
В результате реакции образуется соль – феррит кадмия.
12. реакция оксида железа (III) с оксидом цинка :
В результате реакции образуется оксид железа-цинка.
13. реакция оксида железа (III) с оксидом кальция :
В результате реакции образуется оксид кальция-железа.
14. реакция оксида железа (III) с оксидом углерода :
15. реакция оксида железа (III) с гидроксидом натрия:
В результате реакции образуется соль – феррит натрия и вода. Реакция протекает при избыточном давлении.
16. реакция оксида железа (III) с карбонатом натрия:
В результате реакции образуется соль – феррит натрия и оксид углерода.
17. реакция оксида железа (III) с плавиковой кислотой:
В результате химической реакции получается соль – фторид железа и вода.
18. реакция оксида железа (III) с азотной кислотой:
В результате химической реакции получается соль – нитрат железа и вода. Азотная кислота – разбавленный раствор.
Аналогично проходят реакции оксида железа и с другими кислотами.
19. реакция оксида железа (III) с бромистым водородом (бромоводородом):
20. реакция оксида железа (III) с йодоводородом:
21. реакция оксида железа (III) с хлоридом железа:
В результате химической реакции получается оксид хлорида-железа.
22. реакция термического разложения оксида железа (III):
Применение и использование оксида железа:
Оксид железа используется в металлургии для выплавки чугуна, как катализатор в химической и нефтехимической промышленности, как пищевая добавка (E172), как компонент керамики, красок и пр. целей.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид железа реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида железа
реакции с оксидом железа
Оксид железа (III)
| Оксид железа (III) | |
|---|---|
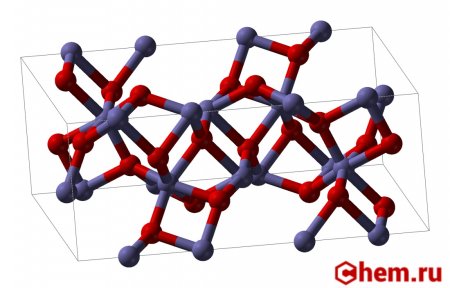 | |
| Систематическое наименование | Оксид железа (III) |
| Традиционные названия | окись железа, колькотар, крокус, железный сурик |
| Хим. формула | Fe2O3 |
| Рац. формула | Fe2O3 |
| Состояние | твёрдое |
| Молярная масса | 159,69 г/моль |
| Плотность | 5,242 г/см³ |
| Температура | |
| • плавления | 1566 °C |
| • кипения | 1987 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Рег. номер CAS | 1309-37-1 |
| PubChem | 518696 |
| Рег. номер EINECS | 215-168-2 |
| SMILES | |
| Кодекс Алиментариус | E172(ii) |
| RTECS | NO7400000 |
| ChEBI | 50819 |
| ChemSpider | 14147 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид железа (III) — сложное неорганическое вещество, соединение железа и кислорода с химической формулой Fe2O3.
Содержание
Свойства
Оксид железа (III) — амфотерный оксид с большим преобладанием осно́вных свойств. Красно-коричневого цвета. Термически устойчив до температур выше температуры испарения (1987 °C). Образуется при сгорании железа на воздухе. Не реагирует с водой. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели.
В природе встречается как широко распространённый минерал гематит, примеси которого обусловливают красноватую окраску латерита, краснозёмов, а также поверхности Марса; другая кристаллическая модификация встречается как минерал маггемит.
Получение
Термическое разложение соединений солей железа (III) на воздухе:
Обезвоживание метагидроксида железа прокаливанием:
В природе — оксидные руды железа гематит Fe2O3 и лимонит Fe2O3· n H2O
Химические свойства
1. Взаимодействие с разбавленной соляной кислотой:
2. Взаимодействие с карбонатом натрия:
3. Взаимодействие с гидроксидом натрия при сплавлении:
4. Восстановление до железа водородом:
Физические свойства
Применение
В пищевой промышленности используется в качестве пищевого красителя (E172).
В ракетомоделировании применяется для получения катализированного карамельного топлива, которое имеет скорость горения на 80 % выше, чем обычное топливо.
Является основным компонентом железного сурика (колькотара).
В нефтехимической промышленности используется в качестве основного компонента катализатора дегидрирования при синтезе диеновых мономеров.
Fe2o3 что за оксид
Степень окисления +3 характерна для железа.
Полиморфные модификации оксида железа (III)
α-форма – минерал гематит, кристаллизуется в тригональной сингонии.
γ-форма – маггемит, кристаллизуется в кубической сингонии.
δ-форма – кристаллизуется в тригональной сингонии.
Температуры фазовых переходов:
α-Fe2O3 

Проявляет слабовыраженные амфотерные свойства с преобладанием основных. Легко реагирует с кислотами:
С растворами щелочей не реагирует, но при сплавлении образует ферриты:
Проявляет окислительные и восстановительные свойства. При нагревании восстанавливается водородом или оксидом углерода (II), проявляя окислительные свойства:
В присутствии сильных окислителей в щелочной среде проявляет восстановительные свойства и окисляется до производных железа (VI):
При температуре выше 1400°С разлагается:
Получается при термическом разложении гидроксида железа (III):
или окислением пирита:
Гидроксид железа (III) Fe(OH)3 – кристаллическое или аморфное вещество бурого цвета. Как и оксид, проявляет слабовыраженные амфотерные свойства с преобладанием основных. Легко реагирует с кислотами:
Реагирует с концентрированными растворами щелочей с образованием гексагидроксоферратов (III):
при сплавлении со щелочами или щелочными реагентами образует ферриты:
В присутствии сильных окислителей в щелочной среде проявляет восстановительные свойства и окисляется до производных железа (VI):
При нагревании разлагается:
Получается при взаимодействии солей железа (III) с растворами щелочей:
Соли железа (III). Железо (III) образует соли практически со многими анионами. Обычно соли кристаллизуются в виде бурых кристаллогидратов: Fe(NO3)3·6H2O, FeCl3·6H2O, NaFe(SO4)2·12H2O (железные квасцы) и др. В растворе соли железа (III) значительно более устойчивы, чем соли железа (II). Растворы солей имеют желто-бурую окраску и, вследствие гидролиза, кислую среду:
Соли железа (III) гидролизуют в большей степени, чем соли железа (II), по этой причине соли железа (III) и слабых кислот нельзя выделить из раствора, они мгновенно гидролизуют с образованием гидроксида железа (III):
Проявляют все свойства солей.
Обладают преимущественно восстановительными свойствами:
Качественная реакция на катион Fe 3+ – взаимодействие с гексацианоферратом (II) калия (желтой кровяной солью) 
Кроме того, ионы Fe 3+ определяют по характерному кроваво-красному окрашиванию роданида железа (III), который образуется в результате взаимодействия соли железа (III) с роданидом калия или аммония:
Оксид железа и гидроксид железа: реакции, взаимодействие, примеры
Содержание:
Железо – элемент, расположенный в четвертом периоде в восьмой побочной подгруппе. В природе его нельзя обнаружить в чистом виде, поэтому железо добывают из горных пород. Оно входит в состав таких сплавов, как сталь и чугун. Железо, как правило, проявляет степени окисления +2 или +3.
Оксиды
Оксид железа (II) FeO
Оксид железа (II) – черное кристаллическое вещество, которое нерастворимо в воде и проявляет свойства основания. Оксид железа (II) взаимодействует с растворами, расплавами и другими соединениями.
Оксид получают путем следующей реакции:
Оксид железа (III) Fe2O3
Оксид железа (III) – красно-коричневый нерастворимый в воде порошок. Он может существовать в трех формах – α, β, γ. Оксид железа (III) не взаимодействует с растворами щелочей. Он обладает амфотерными свойствами и реагирует с рядом веществ.
Оксид железа (III) получают двумя путями:
Оксид железа (III) содержится в буром железняке, из которого изготавливают чугун.
Гидроксиды
Гидроксид железа (II) Fe(OH)2
Гидроксид железа (II) – белый порошок, который на воздухе приобретает зеленый оттенок. Он не растворим в воде и являются основаниями. Гидроксид железа (2) реагирует с растворами и рядом других соединений.
Гидроксид железа (II) получают путем следующего взаимодействия:
FeCl2 + 2 NaOH ⟶ Fe(OH)2 +2 NaCl
Гидроксид железа (III) Fe(OH)3
Гидроксид железа (III) – бурое рыхлое вещество. Он обладает амфотерными свойствами. Гидроксид железа (III) реагирует с различными соединениями.
Гидроксид железа (III) получают при взаимодействии солей и щелочей.
FeCl3 + 3 NaOH = Fe(OH)3 + 3 NaCl
Общие характеристики оксидов и гидроксидов железа
Оксид и гидроксид железа (2) взаимодействуют с растворами кислот, но не реагируют со щелочами. Т. е. они обладают основными свойствами. Оксиду и гидроксиду железа (III) характерны слабые амфотерные свойства.
Соединения двухвалентного железа – восстановители, т. е. в реакциях они отдают электроны элементам. Они просто окисляются на воздухе. Соединения трехвалентного железа – окислители. Они длительное время могут находиться в растворе.

















