Flt3 мутация что это
Flt3 мутация что это
Рецептор FLT3 относится к семейству клеточных белков, которые совмещают в себе функции рецептора и внутриклеточной тирозинкиназы. Нарушение процесса рецепторной регуляции внутриклеточных структур является основным звеном в патогенезе острого миелолейкоза. Мутации FLT3 приводят к независимой от лиганда димеризации и неконтролируемой активации рецептора. В большом количестве исследований показано негативное влияние мутации гена FLT3 на течение и результаты терапии при ОНЛЛ.
Острый миелолейкоз с нормальным кариотипом (НК-ОМЛ).
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
OMIM
Локализация гена на хромосоме
Общая информация об исследовании
Ген FLT3 находится на длинном плече хромосомы 13, в локусе 13q12, и кодирует белок, известный как FMS-подобная тирозинкиназа 3 (FLT3), который является частью семейства протеинов, называемых рецепторными тирозинкиназами (РТК). РТК передают сигналы с поверхности клетки в клетку посредством процесса, называемого трансдукцией сигнала.
FLT3 находится на поверхности определенных типов клеток. Он высоко экспрессируется на CD34+ гемопоэтических стволовых клетках (ГСК) и менее выражен на поверхности более зрелых элементов моноцитарной линии. Также его экспрессия обнаружена в клетках печени, селезенки, тимуса и плаценты. Активация белка FLT3 происходит на поверхности клетки в результате связывания его с лигандом (FL), относящимся к семейству цитокинов. Он представляет собой трансмембранный белок, который может переходить в растворимую форму во внеклеточном пространстве и взаимодействовать с рецептором. FL продуцируется клетками костномозгового микроокружения и некоторыми гемопоэтическими клетками. Связывание с FL активирует белок FLT3, который запускает каскад реакций, относящихся к различным сигнальным путям. Сигнальные пути, которые стимулируются FLT3, контролируют клеточный рост, пролиферацию (деление) и продолжительность жизни клеток, особенно гемопоэтических.
Мутации в гене FLT3 участвуют в развитии такой формы миелолейкоза, как цитогенетически нормальный острый миелоидный лейкоз (ЦН-ОМЛ), или острый миелолейкоз с нормальным кариотипом (НК-ОМЛ). На эту форму приходится около половины случаев ОМЛ. Мутации гена FLT3, участвующие в развитии НК-ОМЛ, обнаруживаются исключительно в злокачественных клетках и не наследуются.
FLT3 состоит из внеклеточного домена и двух цитоплазматических тирозинкиназных доменов, связанных друг с другом трансмембранным доменом. Рецепторная часть, расположенная на клеточной мембране, состоит из пяти иммуноглобулиноподобных доменов, которые могут связываться с лигандом. Внутриклеточная часть состоит из юкстамембранного или подмембранного домена (juxtamembrane domain, JMD) и двух каталитических тирозинкиназных доменов (tyrosine kinase domains, TKD1 и TKD2).
При ОМЛ встречаются два типа мутаций гена FLT3. Наиболее распространенной аномалией, на которую приходится до 34 % случаев НК-ОМЛ, является внутреннее тандемное удвоение нуклеотидов (internal tandem duplication, ITD), иногда со вставками добавочных нуклеотидов в экзонах 14-15. При этом типе мутации короткая последовательность ДНК копируется и вставляется непосредственно после исходной последовательности. Дублированная последовательность ДНК может варьироваться по размеру, но 75 % FLT3-ITD мутаций приводят к изменениям именно в области юккамембранного домена. Измененный домен позволяет рецептору FLT3 активировать сигнальные пути без связывания с FL. Постоянная сигнализация приводит к неконтролируемой пролиферации аномальных, незрелых лейкоцитов, которые являются отличительной чертой острого миелоидного лейкоза.
Больные ОМЛ с мутацией FLT3-ITD имеют неблагоприятный прогноз заболевания с высокой частотой рецидивов и короткой средней продолжительностью жизни.
Прогноз заболевания значительно хуже у больных с бóльшим количеством мутировавших клеток. Также существует мнение, что локализация мутации вне JMD связана с худшим прогнозом заболевания. Пациентам с ОМЛ и мутацией FLT3-ITD показана аллогенная трансплантация ГСК (аллоТГСК) при первой полной ремиссии. Также выполнение аллоТГСК позволяет надеяться на хороший прогноз у больных ОМЛ с высоким аллельным соотношением.
Мутации FLT3-TKD1 отличаются от FLT3-ITD по своим трансформирующим возможностям. Мутация FLT3 довольно часто встречается вместе с другими генетическими нарушениями, особенно с такими, как мутации DNMT3A, NPM1, WT1, RUNX1, MLL, C/EBPα и CBF. В данном случае течение заболевания будет определяться наличием FLT3-ITD, так как она всегда определяет плохой прогноз и даже нивелирует благоприятное прогностическое значение других сопутствующих мутаций, например NPM1 или TET2.
Примерно у 30 % пациентов тип мутации FLT3-ITD в начале заболевания может отличаться от типа при его рецидиве. Кроме того, нередко FLT3-ITD выявляется впервые только при рецидиве болезни.
В настоящее время разрабатывается и/или изучается в клинических исследованиях целый ряд препаратов, направленных против тирозинкиназной активности FLT3. Различные препараты характеризуются разной степенью эффективности. Также нередко выявляется резистентность (нечувствительность) при монотерапии. Одним из механизмов приобретенной устойчивости к некоторым ингибиторам тирозинкиназы является присутствие мутации FLT3-TKD1 при рецидиве заболевания. Кроме этого, есть данные, что бласты с мутацией FLT3-TKD1 не проявляют достаточной чувствительности к ингибиторам тирозинкиназы.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения: мутация не обнаружена.
Определение экспрессии гена FLT3 (кровь) в Москве
Исследование предназначено для определения прогноза и подбора оптимального лечения при остром миелоидном лейкозе. Исследование не следует использовать для оценки минимальной остаточной болезни после проведенной терапии.
Приём и исследование биоматериала
Когда нужно сдавать анализ Определение экспрессии гена FLT3 (кровь)?
Определение прогноза и подбор оптимальной терапии при остром миелоидном лейкозе.
Подробное описание исследования
Ген FLT3 кодирует одноименный белок FLT3, выступающего в качестве клеточного рецептора. Основной функцией этого рецептора является передача сигнала извне клетки к её ядру с использованием специальных молекул-посредников. При помощи этих сигналов белок-рецептор FLT3 регулирует рост, деление и развитие кроветворных клеток. При развитии мутации в гене FLT3 процесс клеточного деления становится автономным и перестает зависеть от сигналов рецептора FLT3. Это способствует неконтролируемому росту кроветворной клетки, которая впоследствии превращается в опухоль.
Известно, что наибольшее прикладное значение генетические мутации FLT3 имеют у пациентов с острым миелоидным лейкозом.
Острый миелоидный лейкоз (ОМЛ) – это злокачественное поражение миелоидного ростка кроветворения, которое проявляется в виде аномального и бесконтрольного размножения незрелых лейкоцитов. Заболевание преимущественно протекает у людей старше 60-65 лет. Основными факторами риска развития ОМЛ являются радиационное/ионизирующее излучение, курение, предшествующая химио- или лучевая терапия. Острый миелоидный лейкоз развивается в результате приобретенных генетических мутаций, которые не передаются по наследству (мутация в гене FLT3 не исключение).
Использованная литература
Подготовка к исследованию
Противопоказания и ограничения
Абсолютных противопоказаний нет.
Интерпретация результата
Результат анализа не является диагнозом и должен быть интерпретирован только врачом.
Flt3 мутация что это
Авторы: А.С. Бавыкин 1, М.А. Волкова 2
1Институт молекулярной биологии РАН, 2Российский Онкологический научный центр им. Н.Н. Блохина РАМН, Москва
Современная интенсивная терапия острых нелимфобластных лейкозов (ОНЛЛ) нередко проводится на грани возможностей организма больного перенести ее. В первую очередь это относится к больным старше 60 лет, которые, составляя не менее половины всех больных ОНЛЛ, часто не получают интенсивной терапии и не включаются в рандомизированные исследования эффективности различных лечебных режимов из-за опасности развития угрожающих жизни осложнений. В то же время использование лекарственных средств, действие которых направлено на устранение молекулярного дефекта, лежащего в основе развития лейкоза, как показывает опыт терапии острого промиелоцитарного лейкоза полностью трансретиноевой кислотой (ATRA), может проводиться независимо от возраста и давать одинаково высокие результаты во всех возрастных группах [1–3].
В течение последних двух десятилетий ведутся активные исследования молекулярных изменений при лейкозах и разработка лекарственных средств, направленных на устранение молекулярных дефектов. Использование выявленных молекулярных маркеров в качестве прогностических факторов позволяет разделить пациентов на группы, требующие терапии различной интенсивности. Успехи цитогенетики и изучение молекулярных дефектов, обусловленных хромосомными аберрациями, позволили разделить ОНЛЛ на 3 группы. Первая – группа со сбалансированными хромосомными аберрациями, т.е. с аберрациями, при которых не происходит потери генетического материала. Эта группа представлена в основном реципрокными транслокациями с образованием химерных генов, в результате чего нарушается функция генов, кодирующих транскрипционные факторы, играющие ключевую роль в гемопоэзе. Больные с аберрациями этой группы при современной терапии имеют благоприятный прогноз [4]. Вторая – группа с несбалансированными хромосомными аберрациями, т.е. с аберрациями, при которых происходит потеря генетического материала, главным образом с делециями – потерей части или утратой целых хромосом. Плохой прогноз у больных с хромосомными аберрациями этого типа позволяет предполагать в патогенезе ОНЛЛ этой группы роль антионкогенов, утрачиваемых в результате хромосомных потерь [5]. Третью группу, в которую входят около половины всех больных ОНЛЛ, составляют больные с нормальным кариотипом. Отсутствие видимых цитогенетических нарушений затрудняет поиски молекулярных дефектов, поэтому патогенез лейкозов данной группы остается неясным. Больные с нормальным кариотипом традиционно относятся к группе с промежуточным прогнозом. Однако результаты применения различных лечебных программ показывают, что внутри этой группы существуют прогностически различные подгруппы.
В последние годы выявлены некоторые типы нарушений клеточного генома, которые не обусловлены или, по крайней мере, не всегда обусловлены видимыми хромосомными аберрациями, но вовлекают гены, играющие важную роль в гемопоэзе и в патогенезе лейкозов.
Первой аномалией, обнаруженной при ОНЛЛ с нормальным кариотипом, была реаранжировка гена MLL (ген смешанной лейкемической линии – mixed lineage leukemia) [6]. Ген MLL локализован на хромосоме 11 в районе 11q23. Транслокации, вовлекающие район 11q23 и различные другие хромосомы (всего обнаружено более 30 различных транслокаций с участием 11q23), встречаются при ОНЛЛ и при острых лимфобластных лейкозах (ОЛЛ) с экспрессией миелоидных маркеров. Изучение изменений гена MLL у больных с различными аберрациями, вовлекающими район 11q23, показало, что при трисомии 11 с очень высокой частотой встречается частичное тандемное удвоение MLL [7, 8]. Вскоре было обнаружено, что такая же реаранжировка гена MLL встречается у 6-8% больных ОНЛЛ с нормальным кариотипом [8, 9]. Исследование больших групп больных показало, что частичное тандемное удвоение гена MLL никогда не встречается при транслокациях, ассоциированных с хорошим прогнозом – t(8;21), t(15;17), inv 16. Среди больных ОНЛЛ с нормальным кариотипом обнаружение реаранжировки MLL предвещает плохой прогноз [9, 10]. Вторая генная реаранжировка, обнаруженная у больных ОНЛЛ с нормальным кариотипом, – реаранжировка гена FLT3.
Рецептор FLT 3: структура и функции
Рецептор FLT3, или CD 135, относится к семейству клеточных белков, которые совмещают в себе функции рецептора и внутриклеточной тирозинкиназы. Из членов этого семейства наиболее известны такие рецепторы, как рецептор к фактору роста эндотелия сосудов (VEGFR 2), рецептор к фактору роста стволовых клеток (c-kit) и а- и в-рецепторы к фактору роста, продуцируемому тромбоцитами (PDGFR). Белок FLT3 кодируется геном flt3, который расположен на длинном плече хромосомы 13 (13q12.2). Ген flt3 состоит из 24 экзонов, длина его транскрипционной РНК составляет 2979 пар оснований. Молекулярная масса FLT3-тирозинкиназы – 112804 Д при длине в 993 аминокислоты.Молекулу FLT3 можно условно разделить на две функциональные единицы: рецептор и тирозиновую киназу, связанные друг с другом трансмембранным доменом (ТМ). Рецепторная часть расположена на клеточной мембране, она имеет характерную структуру – состоит из пяти иммуноглобулиноподобных доменов, которые могут связываться с лигандом (рис. 1). Внутриклеточная часть состоит из подмембранного домена (JM- юкстамембранный) и двух каталитических (киназных) доменов (TK1 и TK2).
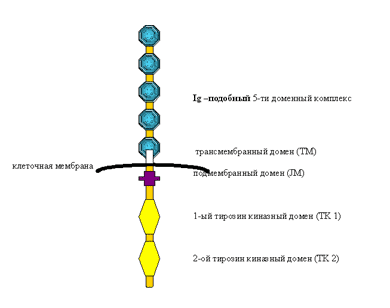
Рис. 1. Схема строения одиночной молекулы рецептора FLT3
Экспрессия FLT3-тирозинкиназы обнаружена преимущественно на стволовых CD34+-кроветворных клетках и на гемопоэтических клетках- предшественниках в костном мозге, на лимфоцитах тимуса и лимфоузлов, менее выраженная экспрессия обнаружена на клетках плаценты, головного мозга, мозжечка и на половых клетках [11, 12].
Лиганд для FLT3 (FL) представляет собой пока еще не вполне охарактеризованную молекулу, которую по ее свойствам относят к семейству цитокинов. FL состоит из 235 аминокислот и представляет собой трансмембранный белок, который может переходить в растворимую форму во внеклеточном пространстве и взаимодействовать со своим рецептором. FL продуцируется клетками костномозгового микроокружения, включая фибробласты, а также гемопоэтическими клетками миелоидного и B- и T-клеточного лимфоидных рядов. FL является ростовым фактором для стволовых клеток и миелоидных предшественников и способствует пролиферации CD34+-клеток в культуре и in vivo в опытах на животных [13–17]. Как и некоторые другие лиганды (например, фактор Стила – лиганд c-kit), FL не может самостоятельно эффективно индуцировать пролиферацию нормальных миелоидных и лимфоидных предшественников, он действует совместно с другими гемопоэтическими ростовыми факторами и интерлейкинами [18, 19]. Поскольку FLT3-киназа экспрессирована на тех же CD34+-клетках, на которых определяется высокий уровень экспрессии c-kit (CD117), их лиганды (FL и фактор Стила), очевидно, действуют в данной популяции клеток синергично [20]. В культуре клеток и в опытах на мышах была показана способность FL совместно с гранулоцитарно-макрофагальным фактором и интерлейкином-4 индуцировать дифференцировку дендритных клеток, а совместно с интерлейкином-15 – увеличивать число натуральных киллеров [21–24].
В неактивном состоянии рецептор представлен в виде одиночных молекул (см. рис. 1). Взаимодействие лиганда с рецептором вызывает димеризацию двух одиночных молекул (рис. 2, а), и в этом состоянии рецептор становится активным. Этот процесс сопровождается фосфорилированием тирозиновых остатков тирозинкиназного домена TK 2 (рис. 2, б). Эти аминокислотные остатки формируют так называемые зоны связывания для внутриклеточных белков – Src-киназ, что приводит к запуску каскада реакций (по MAP-киназному пути для FLT3), итогом которых является экспрессия генов, отвечающих за пролиферацию и рост клеток.
Механизм экспрессии FLT3 в норме и при гемобластозах
Нарушение процесса рецепторной регуляции внутриклеточных структур является основным звеном в патогенезе острого миелолейкоза. Мутации FLT3 приводят к независимой от лиганда димеризации и неконтролируемой активации рецептора (см. рис. 2). Процессы в норме показаны на рис. 2, а красными линиями и стрелками в серединной части рисунка, синими стрелками – при патологии (см. рис. 2, б; помимо нормальной передачи сигнала через Src-белки включается дополнительная передача пролиферативного сигнала через STAT5). Особое внимание следует обратить на так называемую А (активационную) петлю, которая служит для связывания внутриклеточных киназ. Процесс связывания в норме зависит от двух основных факторов: активированное (димеризованное) состояние рецептора и его сродство к Src-киназам (адапторные белки). В неактивном состоянии рецептора (одиночные молекулы FLT3) отсутствует контакт с Src-киназами. При мутации в А-петле (см. рис. 2, б) изменяется аминокислотная последовательность в ней, и это может быть чревато сразу несколькими аномальными явлениями. Во-первых, А-петля в результате произошедшей мутации, как правило, переходит в состояние постоянной активации и проводит сигнал вне зависимости от контакта FLT3-рецептора с лигандом. В этом случае запускаемый каскад реакций становится более продолжительным, чем в норме, что может привести к неконтролируемой стимуляции экспрессии соответствующих генов, направленных на пролиферацию и ангиогенез. Во-вторых, А-петля становится доступной не только для Src-киназ, но и для других активационных факторов, например STAT 5. Эти факторы, в свою очередь, запускают активацию уже «своих» генов, что, в частности, может приводить к блокированию клеточного апоптоза.
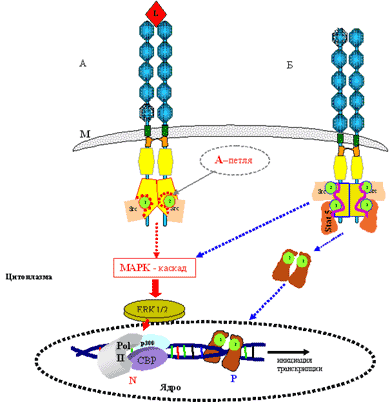
Рис. 2. Схематическое изображение активации FLT3 L – лиганд, М – цитоплазматическая мембрана, N – активация рецептора в норме, P – активация рецептора в патологии.
Исследование экспрессии FLT3 на бластных клетках при гемобластозах показало ее высокий уровень у 70–100% больных ОНЛЛ и у 87-100% больных В- и Т-клеточными острым лимфобластным лейкозом (ОЛЛ) [25–27]. Экспрессия FLT3 не была обнаружена на клетках крови и костного мозга больных хроническим миелолейкозом, но очень высокий уровень экспрессии обнаружен при бластном кризе независимо от его иммунологического варианта [28]. Уровень экспрессии FLT3 бластными клетками миелоидной, В- и Т-лимфоидных лейкемических линий значительно превосходит уровень ее экспрессии клетками нормального костного мозга. Это позволило предположить, что экспрессия FLT3 может играть роль в пролиферации и выживании лейкемических клеток [26]. В одном из исследований было показано, что в 40 из 110 изученных клеточных линий человеческих лейкозов и лимфом на лейкемических клетках была обнаружена одновременно экспрессия FLT3 и FL. Это позволяет предполагать возможность существования аутокринного механизма пролиферации лейкемических клеток [29].
Мутации гена FLT3
Мутации в юкстамембранном домене. Впервые мутации гена FLT3 при ОНЛЛ были обнаружены в 1996 г. M. Nakao и соавт. [30]. Изучая с помощью полимеразной цепной реакции структуру гена FLT3 у больных ОНЛЛ, они неожиданно обнаружили удлинение фрагментов РНК юкстамембранного (подмембранного) домена у 5 из 30 больных. Исследуя ДНК генома FLT3 этих больных, они исключили возможность удлинения домена за счет альтернативного сплайсинга нуклеотидов и показали, что во всех случаях удлинение было обусловлено тандемным удвоением в последовательности нуклеотидов, иногда со вставками добавочных нуклеотидов. Удвоенный участок варьировал по величине и локализации у разных больных, но всегда находился в пределах экзонов 14 и 15 юкстамембранного домена FLT3. Поскольку образующиеся при этом последовательности нуклеотидов всегда находились в пределах рамки считывания и не нарушали ее, было очевидно, что эти изменения не препятствуют продукции функционально активной FLT3-тирозинкиназы. Последующие многочисленные исследования показали, что обнаруженное внутреннее тандемное удвоение нуклеотидов в ДНК юкстамембранного домена FLT3 (FLT3/ITD – internal tandem duplication) является наиболее частой мутацией у больных ОНЛЛ, в том числе у больных с нормальным кариотипом. Частота FLT3/ITD при ОНЛЛ, по данным разных исследований, составляет от 13,2 до 32% у взрослых больных [31, 32]. Эта мутация была обнаружена у 3% больных с миелодиспластическими синдромами [33, 34], у отдельных больных ОЛЛ, чаще с бифенотипическим иммунофенотипом [33, 35] и не обнаружена при хроническом миелолейкозе, хроническом лимфолейкозе, неходжкинских лимфомах [34] и у здоровых доноров в клетках костного мозга и пуповинной крови, имеющих физиологически высокую экспрессию FLT3 [36, 37]. Исследование роли произошедшей мутации на культуре клеток Cos7 с трансфектным геном FLT3/ITD показало, что в них происходит независимое от лиганда фосфорилирование рецептора при любой длине и локализации удвоенного участка и что при этом одновременно происходит фосфорилирование FLT3 дикого типа на другом аллеле в тех же клетках [38]. Трансфекция FLT3/ITD в линии клеток, рост которых в норме происходит только в присутствии ростовых факторов, вызывала пролиферацию клеток без добавления этих факторов. При этом в клетках активизировались сигнальные пути с участием STAT5 и RAS/MAP-киназ [23, 24].
На сегодняшний день считается, что процесс димеризации в норме пространственно ограничивается структурным строением подмембранного домена (JM). В случае ITD структура домена JM нарушается таким образом, что процесс сближения двух рецепторных молекул оказывается в значительной степени облегченным и может происходить и без наличия лиганда.
Тандемные удвоения в юкстамембранном домене FLT3 у больных ОНЛЛ с этим дефектом значительно различаются по длине удвоенного участка – от 3 до более чем 400 пар оснований [39]. Имеются также различия в локализации тандемного участка, однако в него всегда оказывается включенным тирозин в 589, 591, 597 или 599-й позиции в молекуле FLT3 [40]. Поскольку данная мутация не всегда оказывается простым тандемным удвоением, а часто сопровождается добавочными включениями нуклеотидов, нередко вместо термина «внутреннее тандемное удвоение FLT3» (FLT3/ITD) в настоящее время применяется термин «мутация длины FLT3» (FLT3 length mutation – FLT3-LM). Мутации в киназном домене FLT3 В 2001 г. двумя независимыми группами исследователей была описана еще одна разновидность мутаций гена FLT3 – точечные нуклеотидные замены [41, 42]. Наиболее часто встречающейся и поэтому наиболее известной в настоящее время является мутация во втором киназном домене (ТК2), в нуклеотидном триплете 835, который кодирует аминокислоту аспарагин. Чаще всего происходит замена аспарагиновой кислоты на тирозин, иногда на валин, гистидин или другую аминокислоту. Помимо этой мутации при ОНЛЛ могут встречаться и другие замены. Преимущественно они локализуются в области между 835 и 842-м триплетами. Наиболее известной является замена метионина на изолейцин в 836-м триплете [41, 42]. Указанные триплеты кодируют аминокислоты, которые являются структурными элементами А-петли домена TK2.
В клетках линии Cos7 с трансфекцией FLT3 с мутациями в киназном домене происходит фосфорилирование тирозина без участия лиганда, а в клеточной линии 32D, для роста которой в обычных условиях необходим интерлейкин-3, – пролиферация без добавления интерлейкина [41]. Эти исследования показывают, что мутации в киназном домене гена FLT3 в клеточной культуре вызывают такой же, хотя и менеее выраженный, пролиферативный эффект, как FLT3/ITD. Частота мутаций в киназном домене FLT3 при ОНЛЛ, по данным разных исследований, составляет 3–7%. Наличие всего одной точечной мутации достаточно для изменения конфигурации А-петли, которая становится доступной не только для Src-киназ, но и для белков STAT 5, которые принадлежат семейству STAT (Signal Transducers and Activators of Transcription) – факторов активаторов транскрипции (см. рис. 2, б). Известно, что избыточная экспрессия белков семейства STAT может провоцировать онкогенез, поскольку они регулируют экспрессию генов, которые кодируют регуляторы клеточного цикла – циклины D1/D2, С-myc, индуктор ангиогенеза – VEGF и ингибитор апоптоза – Bcl-xL. STAT относятся к цитоплазматическим факторам и имеют в своем составе ТК- и ДНК-связывающиеся домены. После связывания с тирозинкиназными доменами рецептора тирозиновые остатки STAT5 фосфорилируются, происходит димеризация двух отдельных молекул и активированный STAT 5-комплекс мигрирует в ядро к промоторным зонам соответствующих генов.
Частота встречаемости FLT3/ITD при различных вариантах ОНЛЛ
Исследования, проведенные на больших группах больных, показали, что частота мутаций не связана с возрастом и полом, хотя в отдельных работах указывается более частая встречаемость мутации FLT3/ITD у женщин [43]. Наиболее часто у взрослых больных FLT3/ITD встречается при остром промиелоцитарном лейкозе (ОПЛ), особенно часто при его вариантной форме – М3v [44, 45]. На втором месте по частоте обнаружения FLT3/ITD находится острый монобластный лейкоз, его вариант М5b. Реже данная мутация обнаруживается при М1-, М2- и М4-вариантах ОНЛЛ, а при М0, М6 и М7 – лишь у отдельных больных. Особенно редко FLT3/ITD встречается у больных с t(8;21), аберрациями 11q23, del 5q и комплексными изменениями кариотипа. Все различия в частоте встречаемости, по данным имеющихся исследований, оказались высокодостоверными (р 50
Во всех исследованиях у взрослых больных с FLT3/ITD были достоверно выше количество лейкоцитов и процент бластных клеток в крови и костном мозге. Это подтверждает возможную роль FLT3 в пролиферации бластных клеток. В то же время у детей с FLT3/ITD не обнаружено ни характерного для взрослых более высокого лейкоцитоза, ни более высокого процента бластных клеток в крови и костном мозге.
Частота мутаций в киназном домене FLT3(FLT3/TKD) у взрослых больных ОНЛЛ Мутации в киназном домене FLT3 – FLT3/TKD встречаются значительно реже, чем FLT3/ITD. При ОНЛЛ, по данным разных исследований, частота FLT3/TKD колеблется от 6,4 до 7,7%. Эти мутации также встречаются чаще у больных с нормальным кариотипом [41–43]. FLT3/TKD обнаружена у 3,4% больных миелодиспластическими синдромами [41]. По данным немецкого кооперированного исследования, включившего 2535 больных ОНЛЛ, мутации в тирозинкиназном домене FLT3 (FLT3/TKD) обнаружены у 8,6% больных с нормальным кариотипом и у 4,7% больных с хромосомными аберрациями. Наиболее часто мутации в киназном домене встречались у больных с М4 эозинофильным вариантом и inv16 и при М5-варианте, особенно при M5b [48]. Частота FLT3/TKD при М3, по разным данным, составляет 8,8–19% и так же, как FLT3/ITD, чаще встречается при М3v. Как и внутренние тандемные удвоения, мутации в киназном домене почти не встречаются при М6- и М7-вариантах ОНЛЛ [41, 43, 48]. Частота FLT3/TKD при ОНЛЛ у детей достоверно неизвестна в связи с редкостью у них этого вида острого лейкоза и единичными проведенными исследованиями.
Мутации в киназном домене FLT3 у детей с ОЛЛ Оба вида рассмотренных мутаций гена FLT3 крайне редки у взрослых больных с ОЛЛ – они обнаружены лишь у 2–3% пациентов [33, 41]. В то же время мутации в киназном домене обнаружены с высокой частотой у детей с ОЛЛ, при этом, в отличие от ОНЛЛ, гораздо чаще у больных с хромосомными аберрациями, главным образом, у больных с гиперплоидией или с реаранжировкой гена MLL. По данным T. Taketani и соавт. [49], ни у одного из 162 детей с ОЛЛ не было обнаружено FLT3/ITD. В то же время мутации в киназном домене обнаружены у 18,2% больных детей с реаранжировкой гена MLL и у 21,5% – с гиперплоидией. FLT3/TKD чаще встречалась у маленьких детей: у 5,4% детей старше 1 года и у 16% в возрасте до 1 года. Не было обнаружено корреляции частоты мутаций в киназном домене с полом ребенка, высотой лейкоцитоза, числом тромбоцитов, наличием гепато- и спленомегалии и нейролейкемии [49]. Эти данные подтверждены S. Armstrong и соавт. [50], которые обнаружили мутации в киназном домене FLT3 у 25% детей с ОЛЛ с гиперплоидией. По их данным, мутации гораздо реже встречались при реаранжировке MLL [50]. В табл. 2 суммированы данные о частоте FLT3/TKD. По имеющимся данным, мутации в киназном домене FLT3 не влияли на результаты терапии детей.
Таблица 2. Частота FLT3/TKD при различных вариантах острых лейкозов