За счет чего притягиваются молекулы
Виды межмолекулярных сил притяжения
Вы будете перенаправлены на Автор24
Общие положения
Электростатическое притяжение
проявляются на больших расстояниях;
Электростатическое притяжение характеризуется тремя типами межмолекулярного взаимодействия:
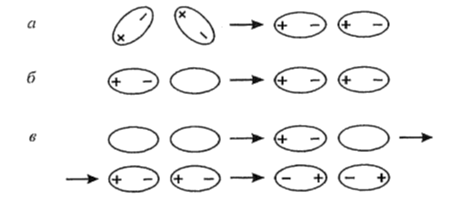
Индукционное взаимодействие. Обусловлено электростатическим взаимодействием полярной и неполярной молекул (Рис. 1). Полярная молекула своим полем воздействует на неполярную, в результате чего появляется наведенный (индуцированный) диполь, способный притягиваться к диполю полярной молекулы. Индуцированный диполь усиливает дипольный момент полярной молекулы. Энергия такого взаимодействия определяется электрическим диполем полярной молекулы и поляризуемостью неполярной молекулы.
Дисперсионное взаимодействие. Появляется как результат притяжения мгновенных диполей (микродиполей). Такие диполи появляются, если не совпадают электрические центры тяжести электронного облака и ядер, что вызвано их независимыми колебаниями. Одновременное появление и исчезновение микродиполей молекул сопровождается их притяжением. Если синхронность отсутствует, происходит отталкивание. Дисперсионное взаимодействие может проявляться между любыми молекулами, а потому является универсальным.
Готовые работы на аналогичную тему
Величина энергий отдельных частей системы в общую энергию межмолекулярного взаимодействия зависит от полярности и поляризуемости молекулы.
проявляется в первичных процессах многих химических реакций;
обусловливает сольвацию молекул и ионов в растворе;
лежит в основе каталитических процессов;
приводит к образованию новых соединений.
Межмолекулярная водородная связь
фтором ($25-40$ кДж/моль);
кислородом ($13-29$ кДж/моль);
азотом ($8-21$ кДж/моль);
Чем выше электроотрицательность и меньше размеры атома, тем выше энергия связи.
Водородная связь важна при:
процессах растворения, кристаллизации;
электролитической диссоциации и др.
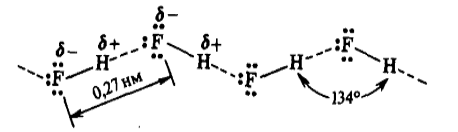
Например: молекулы фторида водорода в любом агрегатном состоянии ассоциированы в зигзагообразные цепочки вида:
что обусловлено водородной связью.
Водородные связи легко возникают и легко разрываются при комнатной температуре вследствие своей непрочности.
Межмолекулярные водородные связи приводят к изменению некоторых свойств веществ. Повышаются:
температура кипения и плавления;
теплоты плавления и парообразования;
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 30 03 2021
Аллотропия. Взаимодействие между молекулами
Содержание
Мы уже знаем, что молекула и атомы — наименьшие частицы, составляющие то или иного вещества. Однако, иметь знания о составляющих вещество молекулах недостаточно, чтобы описать его свойства. Например, пар и лед состоят из одинаковых молекул воды, но свойства у них отличаются.
Вспомните конструктор «Лего». Мы высыпаем из коробки просто кучу деталей, которые можно собрать и построить дом или автомобиль, в зависимости от того, каким образом одни и те же детали будут нами соединены.
Аналогично обстоит дело и с веществом. Чтобы его описать, необходимо не только знать атомный и молекулярный состав, но и способы соединения частиц, а также их взаимодействия.
Свойство разных простых веществ состоять из одинаковых частиц называется аллотропией, а сами вещества — аллотропными модификациями.
Самым большим количеством аллотропных модификаций обладает углерод (рисунок 14). Его атом получил свое название от вещества, состоящего из атомов угля.
Из таких же самых атомов состоят сажа, графит и алмаз. Просто атомы в них по-другому расположены и по-другому взаимодействуют. Поэтому, их свойства сильно отличаются: из твердого алмаза делают режущие инструменты, а из мягкого графита — стержни для карандашей.
Рисунок 15. Аллотропные модификации углерода.
Взаимное притяжение молекул
Если же все молекулы находятся в беспрерывном движении, почему твердые и жидкие тела не распадаются? Значит, молекулы как-то взаимодействуют между собой, взаимно притягиваются друг к другу.
Но, если вы сломаете карандаш, он же не склеится обратно? Из этого можно сделать просто вывод, что притяжение между молекулами действует только на очень коротком расстоянии. Притяжение между молекулами разных тел неодинаково, что объясняется различной прочностью.
Рассмотрим следующий опыт: если у двух цилиндров идеально ровно срезать поверхности и прижать их друг к другу, вам удастся разорвать их только при большой нагрузке (рисунок 16).
Рисунок 16 Сцепление двух свинцовых цилиндров.
Заметим, что притяжение между молекулами становится заметным, когда расстояние между ними не превышает размеров самих молекул.
Если мы попытаемся таким же образом соединить осколки стекла, то из-за неровностей у нас ничего не выйдет – расстояние между молекулами окажется слишком велико.
Но если нагреть куски стекла, то стекло станет возможно починить. На том же принципе происходит соединение кусков металла при сварке или пайке.
Но почему тогда между молекулами существуют промежутки? По логике вещей, они должны намертво слипнуться. Но этого не происходит, поскольку между молекулами (атомами) в то же время существуют силы отталкивания.
На расстояниях, сравнимых с размерами самих молекул (атомов), заметнее проявляется притяжение, а при дальнейшем сближении – отталкивание (рисунок 17).
Рассмотрим примеры, подтверждающие существование отталкивания между молекулами. Если вы несильно скомкаете лист бумаги, постепенно он начнет расправляться, так как при сжатии молекулы оказались настолько близко друг к другу, что начало проявляться отталкивание. Другие явление связаны со смачиванием твердого тела жидкостью. Взгляните на рисунок 18.
Рисунок 18. Иллюстрация опыта, доказывающего притяжения между молекулами вещества и демонстрирующего эффект смачивания.
На пружине с помощью нитей закреплена стеклянная пластина, ее подносят к емкости с водой так, чтобы она легла на поверхность жидкости.
Когда мы пытаемся оторвать платину от поверхности воды, пружина заметно растягивается. Это доказывает существование притяжения между молекулами.
К тому же, мы можем заметить, что стеклянная пластина теперь покрыта тонким слоем воды – это значит, что разрыв произошел там, где молекулы воды соприкасаются друг с другом, а не с поверхностью стекла.
Благодаря эффекту смачивания мы можем вытирать мокрые предметы, но с другой стороны, вода может и не смачивать тела (парафин/воск/жир) – это означает, что молекулы жидкости притягиваются друг к другу с большей силой, чем к молекулам твердого тела.
Урок 8. Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул
Цели урока: дать представление о взаимодействии молекул вещества; выяснить физический смысл взаимодействия молекул; сформировать представления о значении явления смачивания и несмачивания в природе, в быту.
Методические цели урока:
Образовательные: вызвать объективную необходимость изучения нового материала; способствовать овладению знаниями по теме «Взаимное притяжение и отталкивание молекул».
Развивающие: развивать умения анализировать ход эксперимента, на его основе проводить сравнение, выделять главное, формулировать логические выводы; содействовать развитию речи, мышления, познавательных умений; содействовать овладению методами научного исследования: анализа и синтеза; формировать логическое мышление, умение обобщать.
Воспитательные: формировать добросовестное отношение к учебному труду, положительной мотивации к учению, коммуникативных умений, способствовать воспитанию гуманности, дисциплинированности, эстетического восприятия мира, развивать познавательный интерес учащихся, формировать умения использовать теоретические знания для понимания сущности явлений происходящих в природе, в быту.
Тип урока: комбинированный
1. Организационный этап
Приветствие учителя. Проверка наличия учебных принадлежностей. Проверка присутствующих. Запись домашнего задания.
2. Повторение изученного материала
2. На местах все: Л.№65, 68…
3. Этап постановки целей и задач урока
Вокруг нас очень много твёрдых тел: линейка, карандаш, мел. Почему твердые тела хорошо держат свою форму? Что заставляет молекулы держаться вместе? Чтобы ответить на эти вопросы, недостаточно знать о том, что все вещества состоят из молекул, между которыми есть промежутки, и о том, что молекулы вещества движутся непрерывно и беспорядочно. Из этих положений, наоборот, следует, что вещества могут распадаться на отдельные молекулы, но в реальном мире этого не происходит. Чтобы дать объяснения, нам предстоит познакомиться с ещё одним положением – о взаимодействии молекул вещества.
Тема нашего сегодняшнего урока «Взаимное притяжение и отталкивание молекул».
— Как вы думаете, какая цель будет стоять перед нами на этом уроке?
Цель, которую мы ставим сегодня перед собой: получить представление о взаимодействии молекул, установить, при каких условиях молекулы вещества притягиваются, а при каких – отталкиваются, что такое явления смачивания и несмачивания, как эти явления используется в быту, технике.
Откройте свои рабочие тетради и запишите тему сегодняшнего урока «Взаимное притяжение и отталкивание молекул».
4. Этап получения новых знаний
По теме урока вы уже догадались, что сегодня нам предстоит убедиться в том, что между молекулами веществ существует взаимодействие: притяжение и отталкивание.
Если два куска пластилина привести в соприкосновение прижатием, то они не распадутся, т. е. слипаются.
— Как это можно объяснить?
— Какой вывод можно сделать из этого опыта?
Между молекулами пластилина возникает взаимное притяжение. При этом молекулы кусков сближаются на расстояние меньше, чем 0,000001см. Заметить притяжение между двумя молекулами невозможно. Если притягиваются миллионы таких молекул, то взаимное притяжение становится заметным. Поэтому трудно разломить деревянную линейку, разорвать нить или проволоку.
Притяжение между молекулами в разных веществах неодинаково. Этим объясняется разная прочность тел.
Проведём опыт с двумя цилиндрами из свинца. Как вы думаете можно ли заставить соединиться свинцовые цилиндры, так же как можно соединить два кусочка пластилина? (Показать, как соединяются два кусочка пластилина).
Два отполированных куска свинца при соединении также не распадаются из-за сил притяжения между молекулами.
Притяжение проявляется, если молекулы очень близко расположены. Если это расстояние увеличить, то силы притяжения резко убывают. Сломанный мелок нельзя «склеить» простым прижатием. Точно также нельзя срастить осколки стекла, даже плотно прижимая их. Из-за неровностей не удаётся их сблизить на расстояние, на котором частицы могут притянуться друг к другу. При расстоянии 0,000001 см этих сил практически нет.
Чтобы совместить в одну две стеклянные палочки, их концы разогревают и сваривают.
Запишите вывод в тетрадь: между молекулами (атомами) существует взаимное притяжение, которое проявляется на расстояниях, сравнимых с размерами молекул (атомов).
Набрать в шприц (без иглы) воду, закрыть отверстие и попытаться сжать воду в шприце с помощью поршня.
— Что происходит с поршнем?
— Почему я не могу перемещать поршень?
— Как это можно объяснить?
— Какой вывод можно сделать из этого опыта?
Какое вещество сжимается? Вода – жидкость. Почему при сжатии она становится упругой? Ведь вода состоит из молекул, между которыми есть промежутки. Этот факт можно объяснить, если предположить, что промежутки между молекулами уменьшаются до определенных пределов. Затем между молекулами возникает отталкивание, препятствующие дальнейшему сжатию воды.
Нам известно, что любое сжатое тело распрямляется. Это происходит от того, что при сжатии молекулы оказываются на таком расстоянии друг от друга, когда начинает проявляться отталкивание.
Запишите вывод в тетрадь: между молекулами (атомами) существует отталкивание, которое проявляется на расстояниях, меньших размера молекул (атомов).
Возьмём две стеклянные пластинки попробуем их соединить и разъединить. Затем из шприца выдавим 2-3 капли воды на поверхность одного стекла, соединим стёкла и попробуем их разъединить.
— Что происходит с пластинками в первом случае (поверхности сухие)?
— Что происходит с пластинками во втором случае (поверхности мокрые)?
— Почему я не могу разъединить пластинки во втором случае?
Сравним результаты и сделаем вывод: взаимное притяжение между молекулами стекла и воды больше, чем притяжение между молекулами воды.
Рассмотрим опыт по отрыву кусочка стекла (пластинки) от поверхности воды. На опыте ученики наблюдают, что в момент отрыва динамометр показывает силу, большую, чем сила тяжести пластинки. Значит, молекулы разных веществ притягиваются друг к другу с разной силой. Важным элементом опыта является тот факт, что нижняя поверхность пластинки остается влажной.
Делается вывод: сила притяжения между молекулами стекла и воды больше, чем сила притяжения между молекулами воды.
По этой же причине мы наблюдаем подъем воды в тонкой трубочке (капилляре).
Целая система длинных каналов и пор имеется у растений и деревьев. Диаметры этих каналов меньше сотых долей миллиметра. Благодаря этому капиллярные силы поднимают почвенную влагу на значительную высоту (до нескольких десятков метров!) и разносят воду по телу растения.
В тех случаях, когда молекулы жидкости притягиваются к молекулам твердого тела сильнее, чем друг к другу, мы говорим о смачивании твердого тела. Вода смачивает стекло, дерево, хлопок, кожу.
Но есть и другой вид взаимодействия: если опустить на поверхность воды парафиновую, либо покрытую жиром стеклянную пластинку, то на поверхности пластинки воды не будет.
Это указывает на то, что сила притяжения между молекулами воды больше, чем между молекулами воды и твердого тела. В таких случаях говорят о несмачиваемости поверхностей. На таких поверхностях небольшие объемы воды не растекаются, а собираются в виде капли.
Явление смачивания и несмачивания обязательно учитывают в быту и технике. Применение фитилей для ламп, стирка, склеивание — все это предполагает хорошее смачивание.
Водоплавающие птицы, наоборот, свои перья обрабатывают жиром, чтобы покров не намок, и птицы не замерзли.
Стволы деревьев пронизаны мельчайшими трубочками — капиллярами (диаметр около миллиметра), по которым к кроне поднимаются питательные вещества, растворенные в воде.
При строительстве домов фундамент изолируют от кирпичных стен, чтобы они не сырели. Для этого на фундамент кладут либо рубероид, либо другой материал, в котором капилляры отсутствуют.
5. Этап обобщения и закрепления нового материала
— Верно ли утверждение, что молекулы газа движутся, а молекулы твердого тела нет?
— Что означают слова: молекулы взаимодействуют?
— Верно ли утверждение: молекулы газа отталкиваются, а молекулы твердого тела и жидкости притягиваются?
Проверку знаний можно провести и в виде опроса по карточкам. Примерное содержание карточек может быть следующим:
— При каких условиях между молекулами возникают силы отталкивания?
— Какие явления указывают на то, что между молекулами существуют силы притяжения.
— Как можно «склеить» два куска стекла?
6. Заключительный этап
1. Что мы узнали о взаимодействии молекул?
2. При каких условиях возникает взаимное притяжение или отталкивание между молекулами вещества?
3. Что такое явление смачивания и несмачивания?
4. Как учитывается явление смачивания и несмачивания в быту и технике?
— Что вам понравилось на сегодняшнем уроке?
— Что не понравилось?
— А теперь давайте выставим оценки.
Домашнее задание: §10; вопросы к параграфу; Л.№ 74, 78…
Задача на смекалку:
Что произошло бы с твердыми, жидкими и газообразными веществами, если бы их молекулы престали притягиваться друг к другу? перестали отталкиваться друг от друга?
Опыты с несмачиваемыми поверхностями
Несмачивание тел может привести к любопытным явлениям. Возьмите иголку, смажьте ее жиром и аккуратно положите плашмя на воду. Иголка не утонет в воде. Внимательно всматриваясь, можно заметить, что иголка «продавливает» воду и спокойно лежит в образовавшейся ложбинке.
Это интересное свойство используется насекомыми, быстро бегающими по воде, не замочив лапок (водомерки, например, настолько приспособились «ходить по воде», что постоянно живут на ее поверхности).
Если взять аквариум и деревянный кубик с ровными, хорошо отполированными гранями, то можно наблюдать интересное явление. В сухом аквариуме аккуратно протрите дно салфеткой, слегка смазанной маслом. Также аккуратно протрите и одну из граней кубика. Убедитесь, что вода «не хочет» смачивать эту грань кубика. Затем, поставив кубик на дно аквариума смазанной гранью вниз, медленно заполните аквариум водой. Кубик «откажется» всплывать и останется лежать на дне.
Виды межмолекулярного взаимодействия твердых тел
Межмолекулярное взаимодействие в химии, суть процесса
Различные атомы и группы атомов, входящие в состав молекулы вещества могут осуществлять внутримолекулярное и межмолекулярное взаимодействие, приводящее к образованию нового типа связей — межмолекулярных связей.
Межмолекулярным называют взаимодействие частиц (атомов, молекул или ионов), проявляющееся на расстояниях, значительно превышающих размеры этих частиц.
Данное явление объясняет отличие идеальных газов от реальных, нахождение одних и тех же веществ в разных агрегатных состояниях и влияет на такие физические свойства, как плотность, электро- и теплопроводность, температура кипения и плавления, твердость и другие.
Первым понятие межмолекулярного взаимодействия ввел голландский ученый Йоханнес Дидерик ван-дер-Ваальс в 1873 году, когда изучал свойства реальных газов и жидкостей. Поэтому силы, обеспечивающие межмолекулярное взаимодействие, также называют ван-дер-ваальсовыми силами.
Отличия межмолекулярного взаимодействия от химической связи:
Основные виды межмолекулярного взаимодействия
Ван-дер-ваальсовы взаимодействия (силы) имеют электростатический характер и образуются за счет диполей (молекул, содержащих два одинаковых по величине, но разных по знаку заряда, находящимися на расстоянии друг от друга). В зависимости от вещества механизм образования диполей различен, поэтому выделяют три составляющие ван-дер-ваальсовых сил:
Влияние агрегатного состояния вещества на ван-дер-ваальсовы взаимодействия
Атомы или молекулы газообразных веществ постоянно двигаются в разных направлениях, поэтому большую часть времени находятся на значительных (по сравнению с собственными размерами) расстояниях друг от друга. Силы межмолекулярного взаимодействия между ними настолько малы, что его даже не учитывают, кроме тех случаев, когда газ находится под высоким давлением.
Частицы веществ в конденсированном состоянии (жидком или твердом) находятся ближе друг к другу, а силы взаимодействия достаточно велики для того, чтобы удержать их в таком положении. Поэтому жидкие и твердые вещества имеют, в отличие от газов, постоянный при данной температуре объем.
Для твердых тел (кристаллов) силы межмолекулярного взаимодействия обеспечивают сохранение не только объема, но и формы. Правильная геометрическая форма (кристаллическая решетка), в узлах которой находятся электрически нейтральные частицы, называется молекулярным кристаллом.
Для некоторых твердых тел свойственно наличие сразу нескольких видов связи. Примером такого вещества является графит с гексагональной решеткой:
Мягкость графита и скольжение его слоев друг относительно друга обусловлена этими факторами.
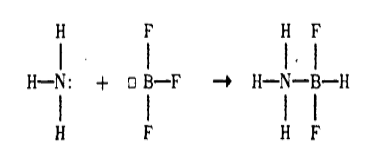
Водородная связь — частный случай ориентационных межмолекулярных сил, образующихся между положительно поляризованным атомом водорода одной группы или молекулы и отрицательно поляризованным атомом другой. Функцию отрицательного полюса выполняет атом с высокой отрицательностью (кислород, фтор, азот и др.).
Если представить соединение с формулой X-H, то водородная связь будет выглядеть так: X-H⋅⋅⋅Y (или H⋅⋅⋅Y), где Y — атом с высокой отрицательностью, входящий в состав какого либо вещества, образующего с X-H водородные связи.
В силу высокой прочности (сравнительно с другими вариантами межмолекулярного взаимодействия), широкой распространенности и важности в объяснении свойств различных соединений водородная связь рассматривается как отдельный тип межмолекулярных связей.
Значение водородной связи:
Водородные связи могут быть как внутримолекулярными (образуются между фрагментами одной молекулы), так и межмолекулярными (возникают между частями разных молекул).
Энергия межмолекулярного взаимодействия молекул
Энергия ориентационного взаимодействия Еориент растет при увеличении дипольных моментов частиц, уменьшается при повышении температуры.
Энергия индукционного взаимодействия Еинд увеличивается с ростом дипольного момента полярной молекулы и с увеличением поляризуемости неполярной. Не зависит от температуры.
Энергия дисперсионного взаимодействия Едисп пропорциональна квадрату поляризуемости частиц. Низкая поляризуемость характерна для многих соединений фтора, следовательно, они проявляют слабое дисперсионное взаимодействие. Доказательством этого является сравнительная таблица 1 температур кипения соединений фтора и хлора, похожих по строению:
| CF4 | CCl4 | OF2 | OCl2 | |
| tкип, °C | -128 | 76 | -144 | 3,8 |
Электрический момент диполя,
Общая энергия межмолекулярного взаимодействия выражается суммой энергий трех видов взаимодействия:
Еобщ = Еориент + Еинд +Едисп.
Вклад каждого из слагаемых определяется полярностью и поляризуемостью частиц. Во взаимодействие сильно полярных и легко поляризующихся молекул наибольший вклад вносят Еориент + Еинд, хотя значение Еинд обычно сравнительно невелико. У малополярных молекул дисперсионное взаимодействие выходит на первое место, а у неполярных оно является единственной составляющей.