Жавелевая вода для чего
Жавелева вода
Полезное
Смотреть что такое «Жавелева вода» в других словарях:
ЖАВЕЛЕВА ВОДА — раствор хлорноватисто калиевой или хлорноватисто натриевой соли в воде, назван. по имени одной деревни близ Парижа со множеством химических фабрик; употребляется для беления и для вывода пятен; действует очень сильно и часто проедает ткань.… … Словарь иностранных слов русского языка
Лабарракова жидкость вода — см. Жавелева вода … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Лабарракова жидкость, вода — см. Жавелева вода … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ОТРАВЛЕНИЕ — ОТРАВЛЕНИЕ. Под отравлением разумеют «расстройства функций животн. организма, вызываемые экзогенными или эндогенными, химически или физико химически действующими веществами, к рые в отношении качества, количества или концентрации чужды… … Большая медицинская энциклопедия
Тривиальные названия неорганических соединений — Тривиальные названия названия, исторически закрепившиеся за какими либо соединениями, и не соответствующие никакой номенклатуре. # А Б В Г Д Е Ё Ж З И К Л М Н … Википедия
жавелевый — ая, ое. Javel. Отн. к жавелю. ♦ Жавелевый раствор, жавелевая вода. То же, что жавель. БАС 1. Жавелевая вода. Уш. 1934. Лекс. Брокг. : жавелева вода; Уш. 1934: жаве/лева вода … Исторический словарь галлицизмов русского языка
лабаррак — Labarraque, Antoine Germain (1777 1850). В 1822 году фр. фармацевт А. К. Лабаррак получил такую белильную жидкость, которая вполне заменяла жавелевую воду и была дешевле. Эту жидкость назвали лабарраковой водой, которую, возможно, в будущем… … Исторический словарь галлицизмов русского языка
Хлорноватистые соли — и из них особенно хлорноватисто кальциевая соль, иначе хлорная, или белильная, известь (см.), вследствие присущего им сильного окислительного и белящего действия находят широкое применение в промышленности, а также применяются и в санитарии (см.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
жавель — ю, ч., хім. Рзчин хлорних сполук зеленувато жовтого кольору, що вживається для відбілювання тканин, паперу і т. ін.; жавелева вода … Український тлумачний словник
Жавелевая вода
Смотреть что такое «Жавелевая вода» в других словарях:
Жавелевая вода — (жавель, от франц. Javel местечко около Парижа, где впервые стали изготовлять эту воду в 1792 году) раствор солей калия хлорноватистой и соляной кислот (KOCl + KCl). Применяется для беления, ранее применялась также для дезинфекции.… … Википедия
ЖАВЕЛЕВАЯ ВОДА — (фр. eau de Javelle). Раствор хлорноватисто натровой или калиевой соли в воде; употребляется для беления тканей, а также при мытье белья, наз. по имени д. близ Парижа с фабриками химических продуктов. Словарь иностранных слов, вошедших в состав… … Словарь иностранных слов русского языка
ЖАВЕЛЕВАЯ ВОДА — ЖАВЕЛЕВАЯ ВОДА, Liquor Kalii hypo chlorosi, Kalium hypochlorosum solutum, Eau de Javel, KC10, получается обработкой белильной извести поташом и представляет очень нестойкий раствор хлорноватистока лиевой соли с содержанием 0,5 0,8% действующего… … Большая медицинская энциклопедия
жавелевая вода — Žavelio vanduo statusas T sritis chemija apibrėžtis Balinančių savybių turintis NaOCl tirpalas, gaunamas leidžiant Cl₂ į šaltą NaOH tirpalą. atitikmenys: angl. eau de Javelle rus. жавелевая вода … Chemijos terminų aiškinamasis žodynas
Лабарракова вода — Основная статья: Гипохлорит натрия Лабарракова вода … Википедия
Гипохлорит натрия — Общие … Википедия
жавелевый — ая, ое. Javel. Отн. к жавелю. ♦ Жавелевый раствор, жавелевая вода. То же, что жавель. БАС 1. Жавелевая вода. Уш. 1934. Лекс. Брокг. : жавелева вода; Уш. 1934: жаве/лева вода … Исторический словарь галлицизмов русского языка
ОТРАВЛЕНИЕ — ОТРАВЛЕНИЕ. Под отравлением разумеют «расстройства функций животн. организма, вызываемые экзогенными или эндогенными, химически или физико химически действующими веществами, к рые в отношении качества, количества или концентрации чужды… … Большая медицинская энциклопедия
Тривиальные названия неорганических соединений — Тривиальные названия названия, исторически закрепившиеся за какими либо соединениями, и не соответствующие никакой номенклатуре. # А Б В Г Д Е Ё Ж З И К Л М Н … Википедия
Беление тканей и пряжи — Б. тканей и пряжи заключается в изменении и удалении тех примесей, которые придают природным волокнистым веществам в их естественном виде (или в том состоянии, в каком они идут в пряжу и ткани) ту или другую окраску. Примеси эти весьма различны в … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химия и производство: Жавелевая вода

После сливания белильной жидкости остающийся осадок может быть применен как дезинфицирующее средство для отхожих мест и т. д. По Гагеру применяют следующие количества составных частей для получения белильной жидкости: 800 г хлорной извести с 25% содержанием активного хлора растирают с 16 л холодной воды: к полученной смеси приливают раствор 1 кг кристаллической соды в 8 л воды. После размешивания составу дают спокойно осесть и сцеживают прозрачную жидкость, каковая и является жавелевой водой.
Правильно приготовленная жавелевая вода имеет следующие преимущества перед другими отбеливающими средствами для тканей (белья):
При прибавлении соляной, серной или щавелевой кислот происходит выделение хлора. Если же действует на хлорноватисто-натриевую соль свободная углекислота, то освобождается хлорноватистая кислота.
При процессе беления хлорноватистая кислота разлагается на кислород (O2) и соляную кислоту (НСl). Кислород в момент выделения окисляет окрашенные соединения, превращая их в бесцветные. Таким образом, беление сводится к окислительному действию кислорода, который в момент выделения обладает большой активностью.
Образующаяся соляная кислота вступает в реакцию с содой или уксусно-натриевой солью и дает хлористый натр и свободную уксусную кислоту или углекислоту. Эти последние снова разлагают хлорноватисто-натриевую соль по вышеприведенным реакциям, так что этот процесс происходит автоматически до исчерпания всего количества хлорноватисто-натриевой соли, причем количество уксусной кислоты или углекислоты может быть самым ничтожным.
Процесс беления ткани или белья производится на практике следующим образом.
HimMax
Поиск
Каталог
Жавелевая вода
Жавелевая вода
ТУ 6-01-29-93
NaOCl
Гипохлорит натрия (натрий хлорноватистокислый) — NaOCl, неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода».
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Соединение — сильный окислитель, содержит 95,2 % активного хлора. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве.
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C).
У соединения известно три кристаллогидрата:
Плотность водного раствора гипохлорита натрия при 18 °C
| Плотность, г/л | 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % |
|---|---|---|---|---|---|---|---|
| 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 | |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций
| Температура замерзания, °C | 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % |
|---|---|---|---|---|---|---|---|---|
| −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе:
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом.
При нагревании параллельно происходит реакция диспропорционирования:
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537), гипохлорит-ион в водной среде подвергается гидролизу:
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой (pH > 11).
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом:
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования:
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме [15] :

В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH [13] :
Если для подкисления используется соляная кислота, в результате выделяется хлор:
Пропуская через охлаждённый водный раствор гипохлорита натрия углекислый газ, можно получить раствор хлорноватистой кислоты:
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель, вступающий в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды.
Рассмотрим основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде:
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита):
Распространённым методом количественного анализа гипохлорита натрия в растворе является потенциометрический анализ методом добавок анализируемого раствора к стандартному раствору (МДА) или метод уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору (МУА) с использованием бром-ионоселективного электрода (Br-ИСЭ).
Также используется титриметрический метод с использованием иодида калия (косвенная иодометрия).
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные:
| Материал | Концентрация NaOCl, масс. % | Форма воздействия | Температура, °C | Скорость и характер коррозии |
|---|---|---|---|---|
| Алюминий | — | твёрдый, влажный | 25 | > 10 мм/год |
| 10; pH>7 | водный раствор | 25 | > 10 мм/год | |
| Медь | 2 | водный раствор | 20 | |
| 20 | водный раствор | 20 | > 10 мм/год | |
| Медные сплавы: БрА5, БрА7, Л59, Л63, Л68, Л80, ЛО68-1 | 10 | водный раствор | 20 | > 10 мм/год |
| Никель | водный раствор | 20 | 0,1—3,0 мм/год | |
| Никелевый сплав НМЖМц28-2,5-1,5 | водный раствор | 20 | 0,007 мм/год | |
| Никелевый сплав Н70МФ | водный раствор | 35—100 | ||
| Платина | водный раствор | |||
| Свинец | водный раствор | 20 | 0,54 мм/год | |
| 40 | 1,4 мм/год | |||
| Серебро | водный раствор | 20 | ||
| Сталь Ст3 | — | твёрдый, безводный | 25—30 | |
| 0,1; pH > 10 | водный раствор | 20 | ||
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Сталь 12Х17, 12Х18Н10Т | 5 | водный раствор | 20 | > 10,0 мм/год |
| Сталь 10Х17Н13М2Т | водный раствор | 40 | ||
| T кип. | 1,0—3,0 мм/год | |||
| Сталь 06ХН28МДТ | водный раствор | 20—T кип. | ||
| Тантал | водный раствор | 20 | ||
| Титан | 10—20 | водный раствор | 25—105 | |
| 40 | водный раствор | 25 | ||
| Цирконий | 10 | водный раствор | 30—110 | |
| 20 | водный раствор | 30 | ||
| Чугун серый | 7 | водный раствор | 25 | |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Чугун СЧ15, СЧ17 | водный раствор | 25—105 | ||
| Асбест | 14 | водный раствор | 20—100 | стоек |
| Графит, пропитанный феноло-формальдегидным олигомером | 25 | водный раствор | Т кип. | стоек |
| Полиамиды | водный раствор | 20—60 | стоек | |
| Поливинилхлорид | водный раствор | 20 | стоек | |
| 65 | относительно стоек | |||
| Полиизобутилен | водный раствор | 20 | стоек | |
| 60 | относительно стоек | |||
| 100 | нестоек | |||
| Полиметилметакрилат | водный раствор | 20 | стоек | |
| Полиэтилен | водный раствор | 20—60 | стоек | |
| Полипропилен | водный раствор | 20—60 | стоек | |
| Резина на основе бутилкаучука | 10 | водный раствор | 20—65 | стоек |
| насыщенный | водный раствор | 65 | стоек | |
| Резина на основе натурального каучука | 10—30 | водный раствор | 65 | стоек |
| Резина на основе кремнийорганического каучука | любая | водный раствор | 20—100 | стоек |
| Резина на основе фторкаучука | водный раствор | 20—93 | стоек | |
| Резина на основе хлоропренового каучука | 20 | водный раствор | 24 | относительно стоек |
| насыщенный | водный раствор | 65 | нестоек | |
| Резина на основе хлорсульфированного полиэтилена | водный раствор | 20—60 | стоек | |
| Стекло | водный раствор | 20—60 | стоек | |
| Фторопласт | любая | водный раствор | 20—100 | стоек |
| Эмаль кислотостойкая | любая | водный раствор | стоек | |
| Т кип. | относительно стоек |
Физиологическое действие и воздействие на окружающую среду
NaOCl одно из лучших известных средств, проявляющих благодаря гипохлорит-иону сильную антибактериальную активность. Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях.
Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO − приблизительно равны (см. подраздел «Гидролиз и разложение в водных растворах»). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами в их структуре, способными к окислению. Исследованиями установлено, этот процесс аналогичен тому что происходит естественным образом во всех высших организмах. Некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов. В приведённой ниже таблице представлены результаты инактивации токсинов при 30-минутной экспозиции различных концентраций NaOCl («+» — токсин инактивирован; «−» — токсин остался активен):
| Токсин | 2,5 % NaOCl + 0,25 н NaOH | 2,5 % NaOCl | 1,0 % NaOCl | 0,1 % NaOCl |
|---|---|---|---|---|
| Т-2 токсин | + | − | − | − |
| Бреветоксин | + | + | − | − |
| Микроцистин | + | + | + | − |
| Тетродотоксин | + | + | + | − |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
На организм человека гипохлорит натрия может оказывать вредное воздействие. Растворы NaOCl могут быть опасны при ингаляционном воздействии из-за возможности выделения токсичного хлора (раздражающий и удушающий эффект). Прямое попадание гипохлорита в глаза, особенно при высоких концентрациях, может вызвать химический ожог и даже привести к частичной или полной потере зрения. Бытовые отбеливатели на основе NaOCl могут вызвать раздражение кожи, а промышленные привести к серьёзным язвам и отмиранию ткани. Приём внутрь разбавленных растворов (3—6 %) гипохлорита натрия приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации желудочно-кишечного тракта.
Пероральная токсичность соединения:
Внутривенная токсичность соединения [32] :
При обычном бытовом использовании гипохлорит натрия распадается в окружающей среде на поваренную соль, воду и кислород. Другие вещества могут образоваться в незначительном количестве. По заключению Шведского института экологических исследований, гипохлорит натрия, скорее всего, не создаёт экологических проблем при его использовании в рекомендованном порядке и количествах.
Гипохлорит натрия не представляет угрозы с точки зрения пожароопасности.
Рейтинг NFPA 704 для концентрированных растворов (10—20 %):
Лабораторные методы получения
Основным лабораторным методом получения гипохлорита натрия является пропускание газообразного хлора через охлаждённый насыщенный раствор гидроксида натрия:
Для отделения из реакционной смеси хлорида натрия (NaCl) используют охлаждение до температуры близкой к 0 °C — в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (−40 °C) и последующей кристаллизацией при −5 °C получают пентагидрат гипохлорита натрия NaOCl · 5H2O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой.
Вместо гидроксида для синтеза можно взять карбонат натрия:
Водный раствор гипохлорита натрия можно получить обменной реакцией карбоната натрия с гипохлоритом кальция [36] :
Промышленное производство
Мировое производство
Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу «in situ», то есть на месте его непосредственного потребления (речь идёт об использовании соединения для дезинфекции и подготовки воды). По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма была использована для бытовых, а другая половина — для промышленных нужд.
Обзор промышленных способов получения
Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.
В современной промышленности существует два основных метода производства гипохлорита натрия:
В свою очередь, способ химического хлорирования, предлагает две производственные схемы:
Химический метод
Сущность химического метода получения NaOCl не изменилась с момента его открытия Лабарраком
Современный химический гигант Dow Chemical Company был одной из первых компаний, поставивших производство гипохлорита натрия на масштабную промышленную основу. В 1898 году открылся первый завод компании по выпуску NaOCl химическим способом. Другой компанией, благодаря которой, это вещество достигло сегодняшней популярности, стала Clorox — крупнейший производитель бытовых отбеливателей в США. С момента основания в 1913 году, вплоть до 1957 года, когда компанию приобрёл концерн Procter & Gamble, отбеливатель на основе гипохлорита натрия Clorox Bleach® был единственным продуктом в её ассортименте.
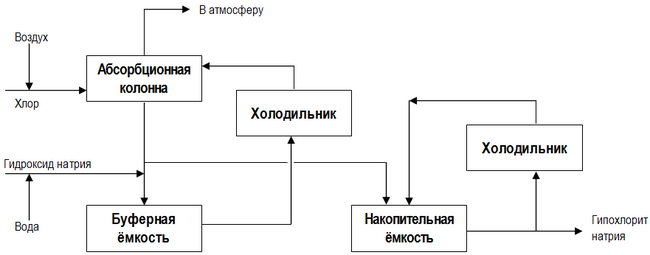
Современная технологическая схема непрерывного производства гипохлорита натрия представлена на рисунке
Низкосолевой процесс производства, в отличие от основной технологической схемы, представленной выше, включает в себя две стадии хлорирования, причём в кристаллизатор (см. на рисунке), где происходит концентрирование готового продукта, подаётся разбавленный раствор NaOCl из первого реактора
В России товарный гипохлорит натрия производят следующие предприятия:
Электрохимический метод
Электрохимический метод получения гипохлорита натрия заключается в электролизе водного раствора хлорида натрия или морской воды в электролизёре с полностью открытыми электродными зонами (бездиафрагменный способ), то есть продукты электролиза свободно смешиваются в электрохимическом процессе.
Процесс в электролизёре за счёт химического взаимодействия образующихся продуктов:
Общая схема процесса:
Электрохимический метод используется, в основном, для получения дезинфицирующего раствора для систем водоочистки. Удобство этого метода заключается в том, что производство гипохлорита не требует поставок хлора, его можно производить сразу на месте водоподготовки, избежав, тем самым, расходов на доставку; кроме того, метод позволяет производить гипохлорит в достаточно широком диапазоне объёмов выработки: от очень малых до крупнотоннажных.
В мире существуют множество различных производителей электролизёров для получения растворов гипохлорита натрия, среди которых наиболее распространены системы компании Severn Trent De Nora: Seaclor и Sanilec.
Система Seaclor ® является преобладающей технологией производства гипохлорита натрия из морской воды электрохимическим методом, занимая свыше 70 % всех мировых мощностей. Более 400 установок Seaclor ® работают в 60 странах; их суммарная производительность составляет порядка 450 тыс. тонн NaOCl в год, единичная мощность колеблется в диапазоне 227—22 680 кг/день. Установки позволяют получать концентрацию активного хлора в растворе в диапазоне 0,1—0,25 %.
Установки Sanilec ® выпускаются производительностью от 1,2 (портативные генераторы) до 21 600 кг/день, концентрация активного хлора составляет 0,05—0,25 %.
Характеристика продукции, обращение, хранение и транспортировка
В Российской Федерации гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76 «Гипохлорит натрия. Технические условия». В соответствии с этим документом, по назначению NaOCl делится на две марки, характеристики которых представлены ниже:
| Наименование показателя | Марка А | Марка Б |
|---|---|---|
| Внешний вид | Жидкость зеленовато-жёлтого цвета | |
| Коэффициент светопропускания | Не менее 20 % | |
| Массовая концентрация активного хлора, г/дм³, не менее | 190 | 170 |
| Массовая концентрация щёлочи в пересчёте на NaOH, г/дм³ | 10—20 | 40—60 |
| Массовая концентрация железа, г/дм³, не более | 0,02 | 0,06 |
| Область применения | В химической промышленности для обеззараживания воды, дезинфекции и отбелки | В витаминной промышленности (как окислитель) и для отбеливания ткани |
Гипохлорит натрия должен храниться в защищённых от света, специальных полиэтиленовых, стальных гуммированных или других, покрытых коррозионно-стойкими материалами ёмкостях, наполненных на 90 % объёма и оборудованных воздушником для сброса образующегося при распаде кислорода. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов.
Растворы товарного гипохлорита натрия со временем теряют свою активность из-за разложения NaOCl. Следующая таблица наглядно показывает, что с течением времени концентрация активного вещества в растворах уменьшается. Тем не менее, как видно из полученной диаграммы, с уменьшением концентрации гипохлорита скорость его распада также уменьшается и промышленные растворы стабилизируются:
| Концентрация NaOCl, % | Период полуразложения, дней | |
|---|---|---|
| 25 °C | 35 °C | |
| 15 | 144 | 39 |
| 12 | 180 | 48 |
| 9 | 240 | 65 |
| 6 | 360 | 97 |
| 3 | 720 | 194 |
| 1 | 2160 | 580 |
Наиболее стабильны для хранения водные растворы гипохлорита, имеющие pH в диапазоне 11,86−13.
Применение
Водный растворр гипохлорита натрия применяют при дезинфекции, так как обладает высокой антибактериальной активностью при воздействия на разные микроорганизмы.
Гипохлорит натрия используется для: