Жса микробиология для чего
Методические рекомендации. Методы бактериологического исследования условно-патогенных микроорганизмов в клинической микробиологии
Оглавление
Методические рекомендации. Методы бактериологического исследования условно-патогенных микроорганизмов в клинической микробиологии
Вид документа:
Методические рекомендации Минздрава РСФСР
Принявший орган: Минздрав РСФСР
Тип документа: Нормативно-технический документ
Дата начала действия:
Опубликован:
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
МЕТОДЫ БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ УСЛОВНО-ПАТОГЕННЫХ МИКРООРГАНИЗМОВ В КЛИНИЧЕСКОЙ МИКРОБИОЛОГИИ
УТВЕРЖДЕНЫ Министерством здравоохранения РСФСР от 19 декабря 1991 г.
Методические рекомендации составил А.Н.Калюк.
Бактериологические исследования на условно-патогенные микроорганизмы
Комплексное лабораторное изучение микрофлоры включает бактериоскопическое и бактериологическое исследования материала, проводимые в динамике при поступлении на стационарное лечение, в процессе лечения, а также по показаниям у больных, лечащихся амбулаторно. Посевы диагностического материала целесообразно производить на плотные питательные среды, что исключает подавление роста одного микроорганизма другим и позволяет дать количественную оценку числа выросших колоний. Интенсивность роста микроорганизмов может выражаться в крестах и соответствовать содержанию определенного количества микробных клеток в 1 мл диагностического материала:
++++ обильный рост сливающихся колоний (10 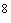
+++ массивный рост изолированных колоний (10 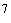
++ умеренный рост множества сосчитываемых колоний (не менее 50) (10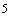
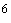
+ скудный рост единичных колоний (30-50) (10 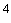
Исследование микрофлоры верхних дыхательных путей (глотка, нос, ротовая полость). Материалом для исследования служат: слизь, гнойное отделяемое, корочки, пленка, кусочки инфильтратов при биопсии. Материал для микробиологического исследования из ротовой полости забирают натощак стерильным ватным тампоном со слизистой оболочки у выхода протоков слюнных желез, поверхности языка, из язвочек (соскоб ложечкой), с наиболее пораженных мест. При наличии пленки последнюю снимают пинцетом. Материал из носовой полости забирают сухим стерильным ватным тампоном. Материал засевают на чашки Петри с кровяным, желточно-солевым агарами, среду Сабуро. При посеве тампоном материал втирают в среду со всей поверхности тампона на небольшом участке 1-2 см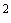
Исследование микрофлоры нижних дыхательных путей. Основным материалом для исследования является мокрота, которая собирается в день исследования, утром, после чистки зубов и полоскания полости рта свежекипяченой водой. При обильном выделении мокроты первые порции следует откашлять в плевку, а последующие собираются в стерильную посуду и доставляются в лабораторию. Для изучения микрофлоры мокроты применяют как посев неразведенной мокроты (качественный метод), так и метод разведения, который получил название количественного. При качественном методе для посева используются гнойные комочки мокроты, отмытые в физиологическом растворе от микрофлоры ротовой полости. При количественных методах гомогенизируется 1 мл мокроты. Затем производятся разведения, позволяющие уменьшить в ней количество микроорганизмов ротовой полости. При обоих методах одновременно с посевом приготавливается мазок, который окрашивается по Граму. Исследованию подлежат гнойная и слизисто-гнойная мокрота, в которой присутствуют лейкоциты и клетки альвеолярного эпителия, клетки, вкрапленные в муцин, присутствие которых характерно для экскрета нижних отделов дыхательных путей. Обращают внимание на преобладающую в мазке нативной мокроты микрофлору, особенно капсульные диплококки (пневмококки), мелкие грамотрицательные палочки (палочка Пфейффера) и др.
Качественный метод. В лаборатории мокроту выливают в чашку Петри, выбирают 2-3 гнойных комочка, которые однократно отмывают в физиологическом растворе, после чего засевают на кровяной и желточно-солевой агары, среды Эндо и Сабуро. Посев производят стерильным стеклянным шпателем, равномерно растирая материал на поверхности питательной среды. На чашку с кровяным агаром сразу же после посева накладывают диски с антибиотиками (стрептомицином, пенициллином, тетрациклином, эритромицином и левомицетином), что позволяет получить экспресс-информацию о лекарственной чувствительности преобладающей в посеве микрофлоры. На второй день учитывают количество выросших колоний (этиологически значимым считается рост более 50 колоний), однородность популяции и лекарственную чувствительность при росте их в монокультуре.
Количественный метод. Из доставленной в лабораторию мокроты берут 1 мл, добавляют 9 мл мясопептонного бульона и гомогенизируют в банке с бусами в течение 20 мин. Из полученной эмульсии готовят десятикратные последовательные разведения. Посев осуществляют в обратном порядке с меньшего разведения. Засевается по 0,1 мл из разведенной мокроты 10 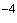
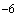
Посев промывных вод бронхов, лаважной жидкости. Из исследуемого материала отбирают комочки слизи, которые без предварительного отмывания в физиологическом растворе засевают на плотные питательные среды (см. посев мокроты) и в пробирку с сахарным бульоном. При отсутствии комочков слизи производят посев материала, набранного в пастеровскую пипетку. Инкубация в течение суток при 37°С.
Исследование микрофлоры глаз. Пробы на исследование отбирает врач стерильным ватным тампоном или стеклянной палочкой. Материал забирается с пораженных мест и засевается в 0,5% сахарный бульон. В случае отсутствия роста через 48 часов выдается отрицательный ответ.
Исследование мазков из уха. Материал забирают стерильным ватным тампоном из слухового канала и производят посев на кровяной и желточно-солевой агары, среду Сабуро, втирая материал на участке среды, после чего растирают по всей чашке.
Исследование мочи. Исследованию подлежит средняя порция утренней мочи, полученная при нормальном мочеиспускании или взятая катетером. Показателем бактериурии, имеющим клиническое значение, считается наличие 100000 и более микробов в 1 мл мочи.
Число колоний бактерий в различных секторах чашки Петри в зависимости от степени бактериурии (по В.С.Рабиновскому и В.В.Родоман)
Количество бактерий в 1 мл мочи
Число колоний в различных секторах чашки Петри
Второй день исследования. Определяют степень бактериурии по табл.1 в зависимости от того, в каком секторе обнаружен рост колоний микроорганизма. При наличии менее 100 тыс. микробов в 1 мл мочи рост колоний наблюдается только в секторе А чашки Петри. Появление роста колоний в I секторе указывает на более высокую степень бактериурии. Подсчет колоний в секторе с наименьшим ростом не представляет труда. Метод секторных посевов в большинстве случаев позволяет уже на второй день исследования выделить возбудителя заболевания в чистой культуре.
Исследование микрофлоры ран, пунктатов, экссудатов, резецированных тканей. Экссудаты и пунктаты засевают пастеровской пипеткой в пробирки с кровяным и простым мясопептонным агаром, сахарным бульоном. Тампон с диагностическим материалом засевают на чашки Петри с 5% кровяным и 10% желточно-солевым агарами. Материал втирается по краю среды, а затем рассеивается по чашке при помощи этого же тампона или бактериологической петли.
Исследование микрофлоры женских половых органов. Выделения собирают с помощью стерильного ватного тампона и засевают на чашки Петри с 5% кровяным агаром, желточно-солевым агаром и в пробирку с сахарным бульоном, а также на среду Эндо.
Исследование желчи. Желчь собирают при зондировании или во время операции в стерильные пробирки и доставляют в лабораторию не позднее 2 ч. от момента забора. 0,1 мл желчи высевают на чашку с кровяным агаром и на среду Эндо. Посевы и оставшийся исходный материал помещают в термостат при 37°С. Через 24 часа учитывают результаты первичных посевов с подсчетом количества колоний каждого вида на плотных питательных средах.
Исследование на дисбактериоз кишечника. На предварительно подготовленные и взвешенные (подпергамент или вощанку) стерильные бумажки размером 3×2 берут произвольное количество фекалий и взвешивают на торзионных весах. Бумажку вместе с материалом помещают в стерильную пробирку. Вес навески фекалий, за вычетом веса бумажки, умножают на 9. Полученная после умножения сумма равна количеству физиологического раствора, которое необходимо добавить в пробирку. Разведение 1:10 (I).
Например: вес бумажки 20 мг
вес фекалий с бумажкой 420 мг
420-20=400 мг; 400 мг
Идентификация микроорганизмов. Методы идентификации микроорганизмов основаны на изучении морфологических, культуральных и биохимических, антигенных и др. свойств культур.
Морфологические свойства изучаются путем бактериоскопии диагностического материала и мазков из колоний, выросших на плотных и жидких питательных средах культур. Мазки на предметных стеклах фиксируют на пламени горелки или в жидких фиксаторах (96°, спирт, смесь Никифорова) окрашивают по Граму. При просмотре мазков из мокроты оценивают всю имеющуюся микрофлору: наличие скоплений грамположительных кокков (стафилококки, микрококки), цепочек грамположительных кокков (стрептококки), мелких ланцетовидных диплококков, окруженных зоной неокрасившейся капсулы (пневмококк), грамотрицательных кокков (нейссерии); грамотрицательных палочек (кишечная, синегнойная, протей); грамотрицательных палочек с закругленными концами, окруженных капсулой в виде светлого ореола (клебсиелла), мелких грамотрицательных палочек в виде скопления (гемофильные бактерии) и др. Бактериоскопическое исследование является ориентировочным. Дальнейшее исследование включает посев материала на питательные среды, выделение чистых культур, их идентификацию и определение лекарственной чувствительности. Культуральные свойства изучают при просмотре выросших культур на плотных и жидких питательных средах. На плотных средах учитывают размер колоний, цвет, прозрачность, форму, наличие пигмента, гемолиз вокруг колонии и его характер и т.д. На жидких средах отмечают их прозрачность, наличие осадка (придонный рост) или пленки на поверхности среды. Исследование биохимических свойств основывается на определении ферментативной сахаролитической активности, способности утилизировать питательные вещества в аэробных и анаэробных условиях культивирования. Антигенные свойства культур изучаются при взаимодействии бактерий и их антигенов с соответствующими антисыворотками (реакции агглютинации, иммунофлюоресценции и др.). После изучения морфологических и культуральных свойств осуществляют постановку дифференциальных тестов с чистыми культурами микроорганизмов.
Грамположительные кокки. Грамположительные кокки относятся к семейству Micrococcaceae, включающему род Micrococcus и Staphylococcus и семейства Streptococcaceae.
При определении коагулазной активности пользуются лиофилизированной плазмой крови кролика, разведенной стерильным физиологическим раствором 1:5 и разлитой в стерильные пробирки по 0,5 мл в каждую. В пробирку засевают 1 петлю суточной агаровой культуры исследуемого штамма и помещают в термостат при 37°С. Учет результатов производят через 30 мин, 1 час, 2 часа и 24 часа. Положительными считаются все степени свертывания плазмы от небольшого сгустка, остающегося неподвижным при перевертывании пробирки.
Лецитиназная активность определяется на желточно-солевом агаре. Учет реакции производят через 24-48 часов макроскопически по наличию мутной зоны и радужного венчика вокруг колоний стафилококка, что свидетельствует о наличии у них фермента лецитиназы.
При изучении ферментации маннита посев суточной агаровой культуры испытуемого штамма производят уголком в столбик 1% агара с маннитом и вазелиновым маслом. При ферментации маннита столбик агар синеет. Положительной считается реакция при ферментации 2/3 столбика агара.
Для определения пигментообразования культуры стафилококка засевают на 10% молочный агар. Учет через 18-20 часов.
Определение гемолитической способности культуры стафилококка осуществляется на 5% кровяном агаре (донорская кровь без добавления антисептиков) по наличию просветления вокруг выросших колоний, которые четко выявляются в проходящем свете. Положительный гемолитический тест на агаре с кровью человека, как правило, обусловлен гемотоксинами, тогда как основную роль в патогенезе стафилококковых инфекций играет альфа-токсин, который можно выявить на агаре с кровью кролика.
Семейство Streptococcaceae. Стрептококки представляют собой большую и довольно гетерогенную группу микроорганизмов. Наиболее изученными являются аэробные представители: Streptococcus pyogenes, S. faecalis, S. pneumoniae. Микроб имеет сферическую форму, грамположителен, в мазках с плотных питательных сред располагается в виде коротких цепочек из 2-3 кокков, на жидких питательных средах дает более длинные цепочки. При выращивании стрептококков следует учитывать их повышенную потребность в питательных веществах. Поэтому для культивирования стрептококка применяют питательные среды, содержащие глюкозу (1%), кровь (5-10%), сыворотку (10-20%).
Грамотрицательные кокки. Грамотрицательные кокки и коккабациллы представлены родами: Neisseria, Branchamella, Moraxella.
Ферментация углеводов представителями рода Neisseria и Branchamella
Клиническая микробиология
Предмет и задачи клинической микробиологии. Морфология основных форм микроорганизмов. Структура и состав бактериальной клетки. Рост и размножение бактерий. Понятие о стерилизации и дезинфекции. Методы микробиологической диагностики инфекционных болезней.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 21.10.2017 |
| Размер файла | 61,7 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Предмет и задачи клинической микробиологии. Роль ученых в развитии клинической микробиологии
Морфология основных форм микроорганизмов
По форме микроорганизмы подразделяются на шаровидные, палочковидные, извитые.
— Микрококки располагаются одиночно, беспорядочно. Являются сапрофитами, обитателями воды, воздуха.
— Стрептококки ( streptos- цепочка) делятся в одной плоскости, располагаются цепочками разной длины.
— Стафилококки (staphyle-виноградная гроздь) делятся в разных плоскостях, располагаются неправильными скоплениями. Некоторые виды вызывают заболевания.
Концы палочек могут быть как бы:
· закругленными (кишечная палочка),
· заостренными (фузобактерии) или в виде утолщения (коринебактерии дифтерии),
· раздвоенные концы имеются в свежеизолированных культурах всех видов рода бифидобактерий, за что род и получил название.
3) Извитые формы бактерий. К этой группе бактерий относятся вибрионы, спириллы, спирохеты.
— Вибрионы (vibrio-извиваюсь) слегка изогнутые палочки, имеют вид запятой с полярным жгутиком (холерный вибрион).
4) Другие формы бактерий. Это большая группа бактерий, которые, как сказано выше, не вписываются по своей морфологии в три названных варианта. К ним относятся риккетсии, хламидии, микоплазмы, актиномицеты.Методы окраски бактерий
Окраску мазка производят простыми или сложными методами. Простые заключаются в окраске препарата одним красителем; сложные методы (по Граму, Цилю-Нильсену и др.) включают последовательное использование нескольких красителей и имеют дифференциально-диагностическое значение. Отношение микроорганизмов к красителям расценивают как тинкториальные свойства. Существуют специальные методы окраски, которые используют для выявления жгутиков, клеточной стенки, нуклеоида и разных цитоплазматических включений.
Сложные методы окраски применяют для изучения структуры клетки и дифференциации микроорганизмов. Окрашенные мазки микроскопируют в иммерсионной системе. Последовательно нанести на препарат определенные красители, различающиеся по химическому составу и цвету, протравы, спирты, кислоту и др.
При сложных методах окраски используются ряд красок в определенной последовательности. Такие методы используются для выявления в патологическом материале конкретных микроорганизмов, а также определения особенностей их ультраструктуры.
Структура и химический состав бактериальной клетки
микроорганизм бактерия инфекционный
Основными структурами бактериальной клетки являются: клеточная стенка, ЦПМ, цитоплазма с включениями и ядро, называемое нуклеоидом. Бактерии могут иметь и дополнительные структуры: капсулу, микрокапсулу, слизь, жгутики, фимбрии, пили; некоторые бактерии способны образовывать споры.
Размеры бактерий измеряются в мкм. Один мкм равен 1000 нм. В нм измеряются отдельные компоненты бактерий.
Клеточная стенка (КС) представляет биогетерополимер сложного химического состава.
Клеточная стенка у бактерий выполняет многочисленные функции:
— придает клетке определенную форму;
— защищает ее от воздействия окружающей среды;
— несет на своей поверхности разнообразные рецепторы;
— через КС в клетку поступают питательные вещества и выделяются продукты обмена.
— пептидогликан придает эластичность и ригидность КС.
Бактерии, полностью или частично утратившие КС, но сохранившие способность к размножению, получили название L-форм в честь института им.Листера (Англия). Независимо от формы исходной клетки (кокки, палочки) L- формы этих бактерий морфологически неразличимы и представляют сферические образования. L-формы могут возникать в естественных условиях в организме человека в результате длительного лечения антибиотиками, чаще всего пенициллином.
— первые способны к реверсии в исходный вид при устранении причины, вызвавшей их образование. Они восстанавливают способность синтезировать пептидогликан КС.
— Вторые, как правило, не способны к реверсии.
L-формы бактерий играют существенную роль в патогенезе многих инфекционных заболеваний.
Цитоплазматическая мембрана (ЦПМ) является жизненно необходимым структурным компонентом бактерий. Располагается под КС. Является трехслойной структурой. Состоит из двойного слоя липидов, главным образом фосфолипидов со встроенными поверхностными и интегральными белками, как бы насквозь пронизывающими структуру мембраны. Некоторые из них являются пермеазами, участвующими в транспорте веществ. ЦПМ является динамической структурой с подвижными компонентами, поэтому ее представляют как мобильную, текучую структуру. ЦПМ выполняет жизненно важные функции:
— участвует в регуляции осмотического давления,
— энергетическом метаболизме клетки,
— у ряда бактерий в спорообразовании.
Цитоплазма у прокариот, так же как и у эукариот, представляет сожную коллоидую систему, состоящую из воды (около 75%), минеральных соединений, белков, нуклеоида, рибосом, мезосом, включений.
Мезосомы являются производными ЦПМ. Имеют разную форму: пузырьков, трубочек. Мезосомы связаны с нуклеоидом, Участвуют в делении клетки и спорообразовании. Характерны в основном для Гр- бактерий.
Рибосомы представляют собой рибонуклеопротеиновые частицы размером 20 нм, состоящие из 2-х субединиц. Участвуют в синтезе белков.
Включения являются продуктами метаболизма и используются в качестве запасных питательных веществ. К ним относятся включения гликогена, крахмала, серы, полифосфата (волютина и др). Например у дифтерийной палочки, включения волютина имеют дифференциально-диагностическое значение.
Дополнительные структуры: капсула, микрокапсула, слизь, жгутики, фимбрии, пили; некоторые бактерии способны образовывать споры.
— адгезивная, способствующая прилипанию к поверхности (рецепторам) клетки хозяина,
— связаны патогенные и антигенные свойства.
Споры и спорообразование. Споры бактерий можно рассматривать как форму сохранения наследственной информации бактериальной клетки в неблагоприятных условиях внешней среды. Внутри одной бактерии образуется одна спора. Спорообразование характерно для Гр+ бактерий. Споры обладают высокой термоустойчивостью, низким содержанием воды, повышенной концентрацией кальция.
Строение клеточной стенки. Особенности строения грамположительных и грамотрицательных бактерий
Клеточная стенка (КС) представляет биогетерополимер сложного химического состава. Состав у разных бактерий не одинаков.
В конце Х1Х в. датским ученым Грамом была предложена дифференциальная окраска, благодаря которой бактерии были разделены на 2 группы, названные грамположительные (Гр+) и грамотрицательными (Гр-). Гр+ бактерии прочно удерживаю анилиновые красители и не обесцвечиваются спиртом, вследствие чего они окрашиваются генцианвиолетом в фиолетовый цвет. Это связано с образованием нерастворимого в спирте комплекса генциан-виолета с йодом. Гр- бактерии после обесцвечивания спиртом докрашиваются водным раствором фуксина в розовый цвет.
Основу клеточной стенки всех бактерий составляет мукопептид (синонимы: муреин, пептидогликан,), обеспечивающий ригидность и эластичность КС. Структура пептидогликана представлена паралллельными полисахаридными (гликановыми) цепями.
У грамположительных бактерий пептидогликан связан с тейхоевыми и липотейхоевыми кислотами за счет чего они имеют многослойную структуру. Тейхоевые кислоты являются производными риботола или глицерина и пронизывают пептидогликан насквозь.
Особое значение имеет ЛПС, содержащийся в значительном количестве в составе КС грамотрицательных бактерий. ЛПС обладает антигенными и токсическими свойствами, поэтому его часто называют эндотоксином.
У грамотрицательных бактерий между КС и ЦПМ расположено периплазматическое пространство, заполненное гидролитическими ферментами, где происходит расщепление большинства питательных веществ, поступающих в бактериальную клетку.
У граположительных бактерий упомянутые ферменты выделяются в окружающую среду.
Морфологические особенности актиномицет и микоплазм
Многие актиномицеты, средой обитания которых является почва. Образуют антибиотики.
Морфологические особенности риккетсий и хламидий
Микробы нуждаются в самых разнообразных веществах, одни из них используются для построения структурных элементов клетки, другие служат источником энергии. Поступление питательных веществ в бактериальную клетку происходит через оболочку. Она играет роль сита. Основным регулятором поступления веществ в клетку, является ЦПМ. Условно можно выделить 4 механизма проникновения питательных веществ в клетку:
— Простая диффузия, при которой перемещение питательных веществ происходит вследствие разницы их концентрации по обе стороны ЦПМ и происходит без затраты энергии.
— Облегченная диффузия происходит также в результате разницы концентрации веществ по обе стороны ЦПМ. Однако этот процесс осуществляется с помощью белков-переносчиков (пермиаз), протекает также без затраты энергии. Вещества перемещаются от более высокой концентрации к более низкой.
— Активный транспорт происходит с помощью пермиаз и направлен на перенос веществ то меньшей концентрации в сторону большей, т.е. как бы против течения, поэтому этот процесс сопровождается с затратой энергии (АТФ).
Выход веществ из клетки осуществляется за счет диффузии и при участии транспортных систем.
Типы питания. Широкому распространению бактерий способствует разнообразие типов питания. Микроорганизмы нуждаются в углероде, азоте, сере, фосфоре, калии и других элементах.
Гетеротрофы, питающиеся отмершими органическими веществами, называются сапрофитами. Гетеротрофы, вызывающие заболевания у человека или животных относят к патогенным и условно-патогенным. Среди патогенных микроорганизмов встречаются облигатные и факультативные паразиты. Облигатные паразиты способны существовать только внутри клетки (например, риккетсии, хламидии, некоторые простейшие).
По источнику азота микроорганизмы делятся на прототрофы, которые сами способны синтезировать необходимые для роста азотсодержащие органические соединения (аминокислоты, пурины, пиримидины, некоторые витамины) и ауксотрофы не способны синтезировать указанные соединения. Ауксотрофами чаще являются патогенные и условно-патогенные микроорганизмы, которые ассимилируют эти соединения и другие факторы роста в готовом виде из организма человека (животных).
По источнику энергии различают фототрофы, т.е. фотосинтезирующие (сине-зеленые водоросли), хемотрофы, нуждающиеся в химических источниках энергии.
Рост и размножение бактерий. Фазы размножения
Бактерии размножаются путем бинарного деления пополам, реже почкованием, спорами.
Размножение бактерий в жидкой питательной среде. Бактерии, засеянные в определенный объем питательной среды. Размножаясь, потребляют питательные вещества, что приводит в дальнейшем к истощению питательной среды и прекращение роста бактерий. При выращивании бактерий в жидкой питательной среде можно наблюдать последовательную смену фаз (периодов):
— первая фаза начинается с высева культуры и продолжается до 2-х часов и называется стационарная или лаг-фаза. В это время клетки не растут и количество не увеличивается.
— Вторая фаза логарифмического роста характеризуется началом интенсивного роста, но скорость их деления невысокая. Эти 2 фазы называют периодом адаптации, продолжительность определяется возрастом культуры, количеством и качеством питательной среды.
Искусственные питательные среды, их классификация, требования к ним
Питательные среды по консистенции делятся на плотные, полужидкие, жидкие. По составу могут быть простыми и сложными.
Простые (основные) среды (МПА,МПБ) используют для выращивания многих микробов. В состав сложных сред входят дополнительные компоненты: сыворотка крови, сахара и др. По целевому назначению: обогащенные, элективные, специальные, дифференциально-диагностические.
Обогащенные среды многие виды бактерий не растут на простых средах, поэтому в основные среды добавляют кровь, сыворотку крови, углеводы и т.д.
— Время культивирования находится в прямой зависимости от времени генерации вида бактерий и находится в пределах от 18-20 часов для энтеробатерий, до 3-4 недель для микобактерий.
— Значение рН среды культивирования находится в пределах от 6,7. Добавки в питательную среду католита нейтрального с рН 7,5 единиц ускоряет рост всех бактерий.
— Питательная среда должна отвечать следующим требованиям: содержать все необходимые вещества в легкоусвояемой форме, иметь оптимальную влажность, вязкость. РН, быть изотоничной и по возможности прозрачной.
Для культивирования анаэробов используют специальные питательные среды и газовые смеси. Последними наполняют анаэростаты. Для создания условий анаэробиоза питательные среды максимально освобождают от кислорода путем кипячения, а также пропуская через жидкие среды инертные газы или наслаивая на поверхность питательной среды вазелиновое масло.
Среда Вильсона-Блера (железосульфитный агар) для культивирования анаэробов состоит из МПА, к которому добавляют глюкозу, Na 2SO3, FeCl2 (хлорид железа).
Среда Китта-Тароции состоит из МПБ, 0,5% глюкозы, кусочков печени или мясного фарша для адсорбции воздуха, викасола и гимина. Перед посевом среду прогревают на водяной бане 10-15 мин для удаления воздуха и заливают слоем вазелиного масла.
Дисбактериозы. Использование пробиотиков в животноводстве
Пробиотики это натуральные, естественные представители нормальной микрофлоры кишечника и окружающей среды, которые не только профилактируют и излечивают заболевания, но еще и влияют на рентабельность разведения животных. Это и увеличение продуктивности (яйценоскость, молокоотдача, привесы живой массы), недопущение крупных затрат на препараты для лечение возникающих заболеваний, увеличение конверсии корма, увеличение сохранности молодняка, избежание негативного воздействия при незначительных погрешностях рациона.
В ЖКТ животного проходят одни из самых важных в жизни животного процессов: 80% иммунитета располагаются в кишечнике, синтез витаминов и аминокислот, переваривание пищи и усвоение всех необходимых витаминов и минералов из корма, утилизация продуктов обмена.
Использование пробиотика в разведении животных, на данный момент является уже неотъемлемой частью процесса. Особое внимание уделяется выпойке молодняка непосредственно с первых дней жизни. Что способствует формированию здорового и устойчивого к заболеваниям поголовья.
Действие химических и физических факторов на микроорганизмы. Понятие о стерилизации, дезинфекции
Влияние температуры. Для каждого вида бактерий имеется определенная оптимальная температура развития, поэтому бактерии делят на 3 физиологические группы: психрофильные, мезофильные, термофильные.
Высокие и низкие температуры по-разному влияют на микробы. При низких температурах микробная клетка переходит в состояние анабиоза, в котором она может существовать длительное время. Низкие температуры приостанавливают гнилостные и бродильные процессы. На этом принципе построено сохранение продуктов в ледниках, холодильниках. В микробиологической практике широко применяется длительное хранение культур микробов, иммуноглобулинов, живых вакцин в высушенном виде из замороженного состояния.
Стерилизация сухим жаром проводится в сушильном шкафу (сухожаровом шкафу или печи Пастера). Метод основан на бактерицидном действии нагретого до 165-170 0С воздуха. Сухим жаром стерилизуют стеклянную посуду: чашки Петри, пробирки, и др. Используют следующие температурные режимы и время выдержки стерилизуемого материала:
— 180 0С в течение 60 мин.
В микробиологической практике используют следующие режимы и экспозицию:
Пастеризация основана на антибактериальном действии температуры в отношении вегетативных клеток, но не бактериальных спор. Применяется для пастеризации пищевых продуктов (пиво, вино, соки, молоко и др.).
Влияние высушивания. Высушивание сопровождается обезвоживанием цитоплазмы и денатурацией белков.
Влияние ультразвука. Вызывает деполяризацию органоидов микробных клеток и денатурацию составляющих их молекул (в результате местного нагревания).
Действие химических факторов.
По механизму действия химические вещества можно разделить на несколько групп.
Окислители. Механизм антимикробной активности связан с окислением метаболитов и ферментов микроорганизмов либо денатурацией последних. К окислителям относятся перекиси водорода, гидроперит, перманганат калия.
Кислоты и щелочи. В основе бактерицидного действия кислот и щелочей лежат дегидратация (обезвоживание) микроорганизмов, изменение рН питательной среды, гидролиз коллоидных систем и образование кислотных или щелочных альбуминатов.
Поверхностно-активные вещества или детергенты. К ним относятся жирные кислоты, обычные мыла, многие полимерные соединения ( септодор, гермосепт, дюльбаль и др). Используют в качестве дезинфектантов и антисептиков. Эти вещества изменяют заряд клеточной мембраны, нарушают проницаемость и осмотическое равновесие микробной клетки, что приводит к ее гибели.
Спирты (70-80% этанол, 60-70% пропанол) Практический интерес представляет этиловый спирт (С Н ОН). Спирты способны отнимать воду и свертывать белок. Бактерицидное действие спирта проявляется с 3-5% концентрации, наиболее сильное противомикробное действие оказывает 70% спирт. Как антисептики наиболее эффективны при использовании в виде 60-70%. С 70% и выше эффект исчезает, происходит дубление, т.е. отнятие воды из микробной клетки, которая фиксируется на объекте, и добавление воды, клетка восстанавливает жизнеспособность.
Альдегиды (формальдегид, уросал и др.) вызывают денатурацию белков. Формальдегид убивает как вегетативные формы, так и споры. Применяется в виде 40% р-ра (формалина) для дезинфицирующих целей.
В качестве антисептиков давно и эффективно применяют различные красители (например, метиленовый синий, бриллиантовый зеленый, риванол или основной фуксин) которые обладают свойством задерживать рост бактерий.
По механизму действия на белок микробной клетки и вирусной частицы химические вещества делятся на 4 группы: окислители, коогулянты, гидролизанты, денатуранты.
— окислители галогены и галогеносодержащие (препараты хлора, йода, брома), перекись водорода, перманганат калия, кислоты.
Понятие о стерилизации, дезинфекции.
Физические, химические, биологические факторы внешней среды обладают широким спектром действия на микроорганизмы. Использование этих факторов в лечебной и профилактической практике строго регламентируется государственным стандартом (ГОСТ), фармакопеей России, отраслевыми стандартами, государственным реестром лекарственных средств Росси, а также санитарными правилами и нормами Сан Пин). В лечебно-профилактических учреждениях использование этих 3-х факторов определяется системой мер, объединенных в понятие асептика.
Микрофлора воздуха. Санитарно-микробиологическое исследование воздуха
Воздух не является благоприятной средой для жизнедеятельности микроорганизмов. Однако, попадая в воздух, многие микроорганизмы способны какое-то время находиться в жизнеспособном состоянии. Среди них большая группа патогенных и условно-патогенных микроорганизмов.
Все методы отбора проб воздуха можно разделить на седиментационные и аспирационные.
По окончании экспозиции все чашки закрывают, помещают в термостат на сутки для культивирования при температуре, оптимальной для развития выделяемого микроорганизма, затем (если этого требуют исследования) на 48 ч оставляют при комнатной температуре для образования пигмента пигментообразующими микроорганизмами.
Более совершенными методами являются аспирационные, основанные на принудительном осаждении микроорганизмов из воздуха на поверхность плотной питательной среды или в улавливающую жидкость (мясо-пептонный бульон, буферный раствор, изотонический раствор хлорида натрия и др.). В практике санитарной службы при аспирационном взятии проб используются аппарат Кротова, бактериоуловитель Речменского, прибор для отбора проб воздуха (ПОВ-1), пробоотборник аэрозольный бактериологический (ПАБ-1), бактериально-вирусный электропреципитатор (БВЭП-1), прибор Киктенко, приборы Андерсена, Дьяконова, МБ и др.
Прибор Кротова. Принцип работы аппарата Кротова основан на том, что воздух, просасываемый через клиновидную щель в крышке аппарата, ударяется о поверхность питательной среды, при этом частицы пыли и аэрозоля прилипают к среде, а вместе с ними и микроорганизмы, находящиеся в воздухе. Чашку Петри с тонким слоем среды укрепляют на вращающемся столике аппарата, что обеспечивает равномерное распределение бактерий на ее поверхности. Работает аппарат от электросети. После отбора пробы с определенной экспозицией чашку вынимают, закрывают крышкой и помещают на 48 ч в термостат. Обычно отбор проб проводят со скоростью 20-25 л/мин в течение 5 мин.
Таким образом, определяется флора в 100-125 л воздуха. При обнаружении санитарно-показательных микроорганизмов объем исследуемого воздуха увеличивают до 250 л.
Микрофлора воды. Методы санитарно-бактериологического исследования воды, показатели ее качества
Вода является естественной средой обитания микробов, основная масса которых поступает из почвы, воздуха, с отбросами, стоками, выделениями человека и животных (мочой, калом) и т.д. Особенно много микроорганизмов в открытых водоемах и реках. К постоянно живущим в воде микроорганизмам относятся: азотбактер, нитробактер, псевдомонады, протеи, спириллы и др. Кроме сапрофитов в воде может быть возбудители инфекционных заболеваний животных и человека: возбудители дизентерии, сальмонеллезов, лептоспироза, и др.
Санитарно-микробиологическое состояние воды оценивают по ОМЧ, коли-титру и коли-индексу.
Общее микробное число (ОМЧ) в воде определяют путем посева воды в стерильные чашки Петри, в которые затем добавляют расплавленный и остуженный до 42—45°С агар. При исследовании чистой воды засевают 1 мл, а при исследовании загрязненных вод делают посевы по 1 мл определенных разведений воды (1 : 10— 1 : 100 и более). Чашки помещают в термостат при 37°С на 24 ч (или при 20—22°С на 48 ч) и по истечении срока инкубации подсчитывают все колонии, выросшие как на поверхности агара, так и в глубине его, выбирая чашки, в которых наиболее удобно произвести подсчет колоний.
Определение санитарно-показательных микроорганизмов.
Интенсивность фекального загрязнения воды характеризуют два показателя:
1) коли-индекс—количество кишечной палочки, обнаруженное в 1 л воды;
Метод мембранных фильтров. Сущность метода заключается в концентрации БГКП из определенного объема воды на мембранном фильтре, выращивании их при 37°С на среде Эндо, дифференциации выросших колоний и определении коли-индекса. Перед употреблением фильтры стерилизуют 10 мин кипячением в дистиллированной воде, меняя ее 3—5 раз. Мембранные фильтры помещают в фильтровальный аппарат Зейтца. После фильтрации пробы воды мембранный фильтр переносят на среду Эндо, разлитую в чашки Петри. Поверхность фильтра с осевшими на нее микробами должна быть обращена вверх. Посевы выдерживают в термостате при 37°С в течение 18—24 ч. Если на фильтрах вырастают колонии, характерные для БГКП: красные, темно-красные с металлическим блеском или без него (лактозоположительные), из них готовят мазки, окрашивают по Граму, микроскопируют.
Понятие о санитарно-показательных микроорганизмах
Для оценки санитарно-гигиенического состояния объектов окружающей среды проводят санитарно-микробиологические исследования, которые позволят оценить опасность воды, воздуха, почвы и других объектов. Показателем неблагополучия является выявление патогенных микроорганизмов.
К санитарно-показательным микроорганизмам относятся представители облигатной микрофлоры организма человека и животных, для которых средой обитания является кишечник или дыхательные пути. Они характеризуются следующими свойствами:
— постоянно выделяются с фекалиями или капельками слизи из дыхательных путей;
— не имеют других мест обитания;
— способны сохраняться в окружающей среде то же время, что и патогенные бактерии, паразитирующие в кишечнике или воздушно-дыхательных путях;
— не способны размножаться вне организма хозяина и изменять свои свойства.
Методы микробиологической диагностики инфекционных болезней
Микробиологические (бактериологические, микологические, вирусологические) методы основаны на выделении чистой культуры возбудителя и ее последующей идентификации на основании морфологических, культуральных, биохимических, антигенных (серологических) и других признаков. Располагая чистой культурой бактерий, можно определить их родовую и видовую принадлежность, факторы патогенности, а также чувствительность к антибиотикам и химиотерапевтическим препаратам. Микологические исследования осуществляются реже, чем бактериологические, поскольку микроскопическая диагностика микозов достаточно надежна. Микологические исследования проводят при диагностике кандидозов путем определения нарастания количества клеток дрожжеподобных грибов рода Candida, а также глубоких микозов.
Вирусологический метод является наиболее достоверным в диагностике вирусных инфекций. Однако его трудоемкость, связанная с приготовлением культуры клеток, обработкой исследуемого материала, а также со сравнительно частым получением отрицательных результатов, ограничивают применение данного метода. Кроме того, он требует затраты сравнительно большого времени, особенно при проведении «слепых» пассажей. Во многих случаях вирусологический метод используют для ретроспективной диагностики вирусных инфекций.
Все микробиологические методы имеют определяющее значение в лабораторной диагностике, являются наиболее информативными и достоверными, особенно если они подтверждены дополнительными серологическими данными.
Реакция агглютинации (РА): компоненты, механизм, способы постановки
Реакция агглютинации проявляется образованием хлопьев или осадка (клетки, «склеенные» антителами, имеющими два или более антигенсвязывающих центра). Реакция агглютинации используют для определения антител в сыворотке крови больных животных.
Разные родственные бактерии могут агглютинироваться одной и той же диагностической агглютинирующей сывороткой, что затрудняет их идентификацию. Поэтому пользуются адсорбированными агглютинирующими сыворотками, из которых удалены перекрестно реагирующие антитела путем адсорбции их родственными бактериями. В таких сыворотках сохраняются антитела, специфичные только к данной бактерии.
Реакция преципитации (РП): компоненты, механизм, постановка, применение
