Декальцинация в гистологии что это
ДЕКАЛЬЦИНАЦИЯ
ДЕКАЛЬЦИНАЦИЯ в гистологических методах исследования
(лат. приставка de- извлечение, уничтожение + calx, calcis известь) — процесс удаления солей извести из минерализованных тканей (костей, зубов, петрификатов) для последующего гистологического и гистохимического их изучения. Как правило, Д. производят после фиксации. Для Д. чаще всего применяют 5— 10—15% водный р-р азотной к-ты, реже спиртовой ее р-р (жидкость Тома); из органических к-т используют 5% муравьиную и 5% трихлоруксусную. Применяют также смеси Эбнера (15 мл HCl уд. веса 1,19; 175 г NaCl и 1000 мл дист, воды), Рихмана — Гельфанда—Хилла (100 мл 90% муравьиной к-ты, 80 мл HCl уд. веса 1,19 и 820 мл дист, воды) и некоторые др. При изучении костей мелких животных хорошие результаты дает фиксирующая и одновременно декальцинирующая смесь «суза» (см. Фиксация). После завершения Д. объекты должны быть тщательно отмыты от к-т. В целях выявления ферментов для Д. рекомендуются р-р этилендиаминтетраацетата натрия или буферные смеси. Для сохранения полисахаридов, в частности гликогена, приходится не только подбирать фиксаторы и декальцинирующие р-ры, но и вводить дополнительные этапы обработки тканей. Процесс извлечения извести происходит и при электролитической Д.: в стеклянный сосуд с декальцинирующей жидкостью опускают электроды из платиновой или вольфрамовой проволоки или из угля. Ткань приводится в контакт с положительным электродом.
Библиография: Лилли Р. Д. Патогистологическая техника и практическая гистохимия, пер. с англ., М., 1969, библиогр.; Меркулов Г. А. Курс патологогистологической техники, Л., 1969, библиогр.; Ромейс Б. Микроскопическая техника, пер. с нем., М., 1954, библиогр.
ДЕКАЛЬЦИНАЦИЯ в патологии
(лат. приставка de- извлечение, уничтожение + calx, calcis известь)— потеря кальция костной тканью в процессе образования ее и при некоторых патол, состояниях — см. Галистерез, Кость.
ДЕКАЛЬЦИНАЦИЯ
Полезное
Смотреть что такое «ДЕКАЛЬЦИНАЦИЯ» в других словарях:
декальцинация — декальцинация … Орфографический словарь-справочник
декальцинация — сущ., кол во синонимов: 1 • удаление (130) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
декальцинация — dekalcinavimas statusas T sritis chemija apibrėžtis Kalcio druskų šalinimas. atitikmenys: angl. decalcifying rus. декальцинация … Chemijos terminų aiškinamasis žodynas
декальцинация — (decalcinatio; де + кальций) 1) в патологии потеря кальция костной тканью при некоторых. физиологических и патологических процессах в ней; 2) в гистологической технике метод подготовки минерализованных тканей (костей, зубов, петрификатов) для… … Большой медицинский словарь
декальцинация — декальцинация, декальцинации, декальцинации, декальцинаций, декальцинации, декальцинациям, декальцинацию, декальцинации, декальцинацией, декальцинациею, декальцинациями, декальцинации, декальцинациях (Источник: «Полная акцентуированная парадигма… … Формы слов
ДЕКАЛЬЦИНАЦИЯ — потеря кальция организмом при невесомости в результате усиленного выведения его из костной ткани с мочой и калом. Д. может привести к ломкости костей при мышечных усилиях, к возникновению функцией, расстройств, отложению кальция в разл. органах,… … Большой энциклопедический политехнический словарь
декальцинация — декальцин ация, и … Русский орфографический словарь
декальцинация — (1 ж), Р., Д., Пр. декальцина/ции … Орфографический словарь русского языка
декальцинация — де/кальц/ин/аци/я [й/а] … Морфемно-орфографический словарь
Декальцинация в гистологии что это
МБУЗ «Патологоанатомическое бюро», Таганрог
Декальцинация в гистологической лабораторной технике
Журнал: Архив патологии. 2012;74(6): 43-45
Пешков М. В. Декальцинация в гистологической лабораторной технике. Архив патологии. 2012;74(6):43-45.
Peshkov M V. Decalcification in histology laboratory techniques. Arkhiv Patologii. 2012;74(6):43-45.
МБУЗ «Патологоанатомическое бюро», Таганрог
Описана процедура декальцинации, которая может быть применена в любой гистологической лаборатории, работающей с костными образцами для общих и специальных целей. Рассмотрены преимущества и недостатки основных типов декальцинирующих агентов и принципы их выбора для разных типов объектов, а также методы определения окончания декальцинации.
МБУЗ «Патологоанатомическое бюро», Таганрог
Костные образцы считаются одними из трудных объектов для гистологического исследования, так как межклеточное вещество содержит избыток различных солей кальция. Минерализация обусловливает опорно-механическую функцию костной ткани, но именно это обстоятельство представляет известную трудность в практической гистологии.
Для рутинного гистологического исследования наиболее употребимыми являются фиксация в 10% нейтральном забуференном формалине, заливка в парафин и окраска гематоксилином и эозином. Образцы костной ткани требуют удаления кальция и изменения технологии получения парафиновых срезов. Чрезвычайно важным этапом в технологии изготовления гистологических препаратов является фиксация. Предпочтительное использование формалина для фиксации определяется следующими соображениями:
1) это самый часто используемый фиксатор; подавляющее большинство гистологических лабораторий используют один и тот же фиксатор практически для всех гистологических объектов;
2) любой из рутинных образцов может быть подвергнут иммуногистохимическому исследованию, а использование подавляющего большинства первичных антител требует фиксации материала в 10% нейтральном забуференном формалине.
Наличие солей кальция не позволяет приготовить срезы тканей на обычных микротомах, поэтому кальций необходимо удалить перед проводкой ткани (декальцинация). Этой процедуре подвергают не только костные образцы, но любые ткани, содержащие патологические участки обызвествления.
Ниже описаны детали процедуры декальцинации и способы контроля окончания декальцинации, пригодные для современной гистологической лаборатории.
Выбор декальцинирующего агента
Все декальцинирующие агенты можно условно разделить на кислотные и бескислотные.
P. Gray [6] приводит 65 рецептов декальцинирующих жидкостей, каждый из которых включает, как минимум, одну из кислот.
К бескислотным декальцинаторам относятся ионообменные смолы, но они не столь широко используются в гистологии.
Считалось, что для удаления кальция из компактных костей лучше всего подходят декальцинирующие жидкости на основе сильных минеральных кислот (соляная, азотная). Они действительно быстро извлекают кальций (2—3 сут), но такие объекты совершенно не пригодны для иммуногистохимического (ИГХ) исследования.
Считается, что губчатые кости лучше декальцинировать растворами на основе слабых органических кислот (муравьиная, уксусная), но и в этом случае могут возникнуть трудности при проведении ИГХ-окрасок. Процедура декальцинации слабыми кислотами занимает 7—10 дней и более.
В любом случае, когда в лаборатории исследуются опухоли костей и трепанобиоптаты костного мозга, нужно использовать растворы на основе этилендиаминтетраацетата (ЭДТА) с рН 7,0. Если данная технология недоступна в лаборатории и используется метод декальцинации сильными кислотами, необходимо один репрезентативный кусочек опухоли вместе с костной тканью зафиксировать до процедуры декальцинации и сохранить его либо в 70% этаноле, либо в 70% изопропаноле, но не в формалине.
Выпиленные образцы толщиной 3 мм помещают в 10% нейтральный забуференный формалин на 24—48 ч при комнатной температуре в объеме фиксатора в 10—20 раз больше образца.
I. Dimmenstein [5] приводит описание некоторых приспособлений и вспомогательных приемов для вырезки костного материала. Перед проводкой избыток формалина отмывается в течение 20—30 мин в проточной воде.
Материал для декальцинации помещают в гистологические кассеты. Декальцинация каждого случая проводится в отдельной пластиковой емкости объемом не менее 200 мл, для контроля выбирают наиболее крупный образец. Процедура проводится без использования каких-либо приспособлений. Подогрев, мешалки, вакуум, микроволны, ультразвук и воздействие электрического поля могут изменить структуру белковых молекул и повредить антигены.
Объем декальцинатора по отношению к объему ткани должен быть, как минимум, в 50 раз больше, поскольку процесс извлечения происходит путем диффузии кальция в раствор. В свежем растворе декальцинация проходит сильнее. Необходимо заменять раствор на свежий ежедневно.
Определение окончания декальцинации
Это очень важный момент, так как он позволяет предотвратить необратимое разрушение тканей. Имеется несколько способов определения окончания процесса декальцинации.
1. Сгибание кусочка. Образец ткани пробуют согнуть пальцами. Пока в нем остается кальций, его очень трудно или невозможно согнуть, а при отсутствии кальция он легко гнется. Это быстрый и простой, но субъективный тест. При сгибании не полностью декальцинированной кости мягкие ткани могут отделяться от твердых, а также происходит повреждение структуры костной ткани. При слишком сильном сгибании ткани ломаются, даже если кальция в них уже нет [2, 11].
2. Проба образца тонкой иглой. Если игла проходит через образец без хруста, декальцинация считается законченной. При этом от иглы остаются следы, и это заметно под микроскопом. Нередко картина нарушается в самых ценных для диагностики местах. Тем не менее игла может проходить без затруднений и в тех случаях, когда в образце кальций еще остается в небольшом количестве [9].
3. Углекислотный тест. При помещении кусочка в декальцинирующую жидкость на поверхности раствора начинают появляться пузырьки углекислого газа. Отсутствие пузырьков газа свидетельствует об окончании процесса декальцинации. Это неточный тест, поскольку при наличии мелких кальцинатов пузырьки газа не визуализируются. Особенно трудно этот тест выполним на мелких костных фрагментах [10].
4. Всплывание образца на поверхность. Образец всплывает на поверхность, когда кальция в нем не остается. Это утверждение неверно, поскольку образец может всплывать независимо от наличия кальция или когда плотность образцов меньше плотности декальцинирующего раствора.
5. Оксалатный тест. Достаточно информативный и чувствительный метод [2, 4], который подходит для сильных и органических кислот, если их концентрация не превышает 10%. Он не подходит для растворов с ЭДТА. Продолжительность теста — 35 мин.
6. Рентгенографический метод. Впервые был описан в 1930 г. [7]. С помощью рентгеновского аппарата (обычного или специального, например, Faxitron) определяются даже минимальные количества кальция в исследуемом объекте. Можно определять отложения кальция и в парафиновых блоках [3]. Недостатки метода — дорогостоящая специальная аппаратура, а также влияние рентгеновского излучения на персонал. Преимущество — возможность тестирования большого количества объектов за короткое время.
7. Гравиметрический тест. Надежный тест, не требующий затрат реактивов, дорогостоящей аппаратуры и времени. Подходит для любого декальцинатора и любого объекта. Если масса объектов мала и они многочисленны, можно взвешивать их вместе. Исследуемый фрагмент промокают фильтровальной бумагой для удаления избытка воды и взвешивают его с точностью до миллиграмма. Массу фиксируют. В дальнейшем образец ткани после просушивания кусочками фильтровальной бумаги ежедневно взвешивают и сравнивают массу с предшествующим результатом. Пока удаляется кальций, масса образца будет убывать [1]. Имеется промежуток времени, когда масса остается постоянной. Как только кальций полностью будет удален, вода начинает замещать кальций, и масса образца начинает увеличиваться. Важно зафиксировать тот момент, когда кальций полностью удален из образца — декальцинация может считаться законченной [8]. После окончания декальцинации исследуемые образцы промывают в воде в течение 30—60 мин и начинают проводку по обычной схеме. Особенно важно выполнить промывку после использования жидкостей на основе ЭДТА, поскольку он при взаимодействии со спиртами образует осадки, значительно затрудняющие микротомию.
Определение момента окончания декальцинации является обязательным, но требует определенного навыка. Эти тесты рационально проводить на каком-либо одном (большем) образце от одного пациента, а не тестировать каждый объект.
Гравиметрический тест является наиболее быстрым, простым, удобным и дешевым. Для крупной лаборатории, постоянно работающей с костным материалом, целесообразно рассмотреть возможность приобретения портативной рентгеновской установки для тестирования момента окончания декальцинации. Оба метода оправдывают себя по затрате времени и простоте исполнения тестов, воспроизводимости и надежности результатов.
Возможность прерывания процесса декальцинации является неоспоримым преимуществом в случае, когда процесс близок к окончанию, а возможность завершить его отсутствует (выходные и праздничные дни, ночь и др.). В этом случае кусочки костей извлекают из декальцинирующего раствора, промывают в проточной воде в течение 20—30 мин и помещают в 10% нейтральный забуференный формалин на нужный срок. Возобновляют декальцинацию после извлечения образцов из фиксатора и промывки в проточной воде в течение 20—30 мин.
Обсуждение
Необходимо помнить, что декальцинации не подлежат хрящевые образцы, ткани с резко выраженным фиброзом, ногти, ороговевшая кожа и любые другие образцы, не содержащие солей кальция.
Декальцинирующие жидкости не обладают размягчающим действием и приводят к повреждению белковых структур. Декальцинаторы на основе минеральных кислот не могут применяться в тех случаях, когда может возникнуть необходимость в проведении ИГХ-исследований. Особенно это касается трепанобиоптатов костного мозга.
Поэтому группа декальцинаторов на основе сильных минеральных и органических кислот может использоваться только в тех случаях, например, когда нет подозрения на наличие опухолевого процесса, когда исследуют компактную кость.
Органические кислоты (муравьиная и ее соли, уксусная, трихлоруксусная, пикриновая, лимонная и ее соли) обладают более мягким действием, но требуют для полной декальцинации от нескольких дней до нескольких недель. В современных условиях, когда клиницисты требуют сократить сроки исследования, это вряд ли удобно.
Хелатирующие агенты (ЭДТА и ее соли) — отдельная группа декальцинирующих агентов. Механизм связывания кальция в зависимости от рН раствора можно представить следующим образом. ЭДТА связывает кальций в зависимости от рН за счет четырех карбоксильных кислотных групп (СООН) и двух аминогрупп (NH). При рН ниже 3,0 декальцинация не происходит вообще. При увеличении рН раствора протоны диссоциируют из этих групп. Этот процесс известен как депротонирование, и декальцинация становится возможной. При рН выше 10,0 группы СООН полностью депротонированы, эта форма ЭДТА быстро связывает кальций, и декальцинация происходит очень быстро. Однако при рН более 7,4 происходит необратимый щелочной гидролиз некоторых белков. При рН 7,0 декальцинация будет происходить достаточно эффективно. Детали эксперимента описываются в обзоре G. Callis, D. Sterchi [4].
К сожалению, в большинстве российских лабораторий чаще других используются декальцинаторы на основе сильных минеральных кислот (азотной, соляной), в которых концентрация кислот не превышает 10%. Более высокая концентрация не сокращает время извлечения кальция, а лишь ускоряет гидролиз белков ткани. Поэтому эта группа декальцинаторов подходит для извлечения больших масс кальция за короткое время, например для образцов компактной кости. Обычно время эффективного воздействия таких кислот ограничивается несколькими часами.
В формулах ЭДТА и ЭДТА с солями натрия более растворимы те, в которых больше натрия. Динатриевая соль ЭДТА менее растворима, чем тетранатриевая ЭДТА, но важно заметить, что их рН также отличаются.
Порошки ЭДТА, используемые для декальцинации, бывают нескольких видов.
А. ЭДТА (эдетовая кислота) имеет молекулярную массу 292 моль, она растворима в воде на 10%, концентрация ее полезна для декальцинации. Чтобы достичь высокой концентрации ЭДТА в растворе, ее нагревают и добавляют гидроксид натрия, который помогает «депротонировать» молекулу. Эта ЭДТА, растворенная в воде, имеет кислую рН (около 4,0) до добавки гидроксида натрия.
Б. Динатриевая соль ЭДТА имеет молекулярную массу 372 моль. 5% раствор имеет рН 4,0—5,0 при комнатной температуре. Соль растворяется в воде в концентрации до 10%, но при приготовлении раствора могут возникнуть трудности, пока рН раствора доводится до 7,0 с помощью гидроксида натрия. Наиболее часто применяется динатриевая соль ЭДТА, имеющая молекулярную массу 372,5 моль, раствор при комнатной температуре имеет рН 4,0—5,0:
вода дистиллированная, мл 850,0
ЭДТА динатриевая соль, г 125,0
натрия гидроксид, г 23,0.
Следует растворить динатриевую соль ЭДТА в воде, затем прибавить гидроксид натрия. Все процессы проводить, непрерывно помешивая. рН конечного раствора должен соответствовать 7,0, что достигается прибавлением по каплям 40% водного раствора гидроксида натрия, при помешивании и контроле рН с помощью предварительно откалиброванного рН-метра. Должен получиться совершенно прозрачный раствор, без каких-либо осадков и взвесей.
В. Тетранатриевая соль ЭДТА имеет молекулярную массу 380 моль и хорошо растворима в воде (14% или более), рН раствора 9,5—12,0. Эта молекула ЭДТА полностью «депротонирована», но высокий рН повреждает чувствительные к щелочам белки. При этом декальцинация будет очень быстрой, однако необходимо снизить рН уксусной кислотой до 7,4 (или до уровня, рекомендуемого для работы с ферментами) для гарантии качественных результатов при ИГХ-окрасках. Также рН можно снизить добавкой трис-гидроксиметиламинометана.
Приготовление растворов ЭДТА требует достаточного опыта, времени и четкого контроля рН с помощью рН-метра, что затруднительно в большинстве гистологических лабораторий. Поэтому целесообразно приобретать декальцинаторы, готовые к употреблению. Примерами могут служить Osteodec («Bio-Optica», Италия), бескислотный декальцинатор БМП («БМП», Россия) и др.
В итоге, находясь перед выбором декальцинирующего агента, лаборатория оказывается под влиянием следующих обстоятельств:
— неизвестно заранее, какой объект впоследствии будет подвергнут гистохимическому, иммуногистохимическому или молекулярному исследованию;
— клиницисты требуют выдачи результата в максимально короткие сроки;
— декальцинирующий раствор должен быть прост и эффективен, дешев и доступен и не повреждать элементы тканей.
По этим соображениям компромиссным представляется выбор декальцинатора на основе ЭДТА с нейтральной рН.
Заключение
Костные образцы, фиксированные в 10% нейтральном забуференном формалине, могут быть декальцинированы с использованием разных декальцинирующих жидкостей, но с обязательным контролем окончания декальцинации. Такой подход позволяет контролировать качество декальцинации ткани, которая впоследствии будет подвергнута как рутинным, так и ИГХ-исследованиям. Декальцинацию для таких случаев важно проводить растворами на основе солей ЭДТА с нейтральной рН. Если в данной лаборатории ИГХ-методы не выполняются, то макроскопически репрезентативный образец, зафиксированный в 10% нейтральном забуференном формалине, должен сохраняться в 70% этиловом или изопропиловом спирте до тех пор, пока не потребуется ИГХ-исследование. Это чрезвычайно важно для выбора лечебной тактики при гематологических заболеваниях и опухолях костной ткани.
Как проводится гистологическое исследование: виды, методы, особенности
Злокачественные новообразования — это группа заболеваний, насчитывающая несколько тысяч видов опухолей разных типов и разной степени злокачественности. Они подразделяются на большие группы в зависимости от того из каких тканей они развиваются: если из эпителиальных (барьерных) — то это раки, если из соединительных тканей (мягких тканей и костей) – саркомы, если из лимфоидных (иммунных) – лимфомы/лейкозы. От того насколько правильно верифицирована опухоль (определен ее тип, степень злокачественности и другие характеристики) зависит правильность и эффективность лечения. Важную роль в этом играют гистологические исследования.
О том, как проходят гистологические исследования, какие задачи кроме диагностических они позволяют решать, что влияет на сроки их выполнения рассказывает заведующая патологоанатомическим отделением с прозектурой НМИЦ онкологии им. Н.Н. Петрова, к.м.н. Анна Сергеевна Артемьева.
Что служит материалом для патоморфологических (гистологических) исследований?
Процесс получения фрагмента ткани (биоптата) — биопсия – это несколько разных способов забора материала для гистологического исследования.
Биопсию внутренних органов делают под УЗИ-навигацией, либо с помощью хирургического вмешательства.
Как обрабатывают эти материалы для проведения гистологического исследования?
1 Этап. Фиксация — «консервирование» биоптата в формалине — специальном химическом растворе, который предотвращает гниение, позволяет сохранить структуры ткани.
Фиксация биоптата может занимать от 6 до 24 часов – в зависимости от его вида и размера.
Операционный материал фиксируется дольше, в несколько этапов. Сначала предварительная фиксация, которая занимает примерно 12 часов. Затем вырезка нужных фрагментов и повторная фиксация еще 24 часа.
Соотношение объема материала к объему формалина должно быть 1:20.
2 Этап. Процессинг — процесс обезвоживания, обезжиривания и пропитки материала парафином. Автомат перемещает кусочек материала из раствора в раствор.
В качестве растворов применяются: абсолютированный изопропиловый спирт (6-8 смен), ксилол (2 смены), расплавленный парафин (2 смены).
Программа разнится для «жирного» материала (к которым относятся, например, ткани молочной железы) и «нежирного» – 36 и 24 часа соответственно.
Процесс получения парафиновых блоков.
3 Этап. Изготовление парафинового блока. Кусок материала помещается в форму с расплавленным парафином (уже другим нежели во время процессинга – с более высокой температурой плавления) и охлаждается. Выполняется вручную, сложно ускорить.
4 Этап. Изготовление срезов. Толщина образца — кусочка ткани, залитого в парафин – 1-3 мм. Толщина каждого среза 4-5 мкм (0,004-0,005 мм). Выполняет лаборант с использованием специального инструмента – микротома.
Срезы монтируются на стекла и должны высохнуть.
Несмотря на то, что часть материала теряется при выравнивании в микротоме, при должном профессионализме, из одного образца — материала от одной биопсии, операционного материала от одной опухоли, возможно изготовить около 100 стекол (микропрепаратов).
Для чего делаются срезы?
Срезы делаются для рутинной окраски гематоксилинном и эозином, иммуногистохимического исследования и других видов исследований.
Срезы для всех исследований используются одинаковые, различается окраска, могут отличаться стекла, на которые они монтируются, так для ИГХ и FISH нужны специальные адгезивные стекла или заряженные стекла.
Блоки и стекла способны храниться долгие годы и использоваться для проведения дополнительных гистологических исследований, пересмотров, а также в научных целях.
Архив гистологических материалов собирается в НМИЦ онкологии им. Н.Н. Петрова с 1927 года и содержит более 10 млн единиц хранения (микропрепараты — стекла, парафиновые блоки, архивные карточки, влажный архив).
Какие виды гистологических исследований наиболее информативны?
Что позволяют определить разные виды гистологических исследований
Гистологическое исследование – что это такое?
Позволяет верифицировать опухоль – то есть определить из каких клеток она состоит (из какой ткани она развивается), степень ее дифференцировки (зрелости).
Рутинная окраска, выполняющаяся при гистологическом исследовании, позволяет выявить патологический процесс в анализируемом материале (биоптате, операционном материале):
Также, в большинстве случаев, благодаря рутинной окраске, можно определить степень злокачественности опухоли и, если она достаточно зрелая, то какова ее природа.
Окрашенные срезы под микроскопом
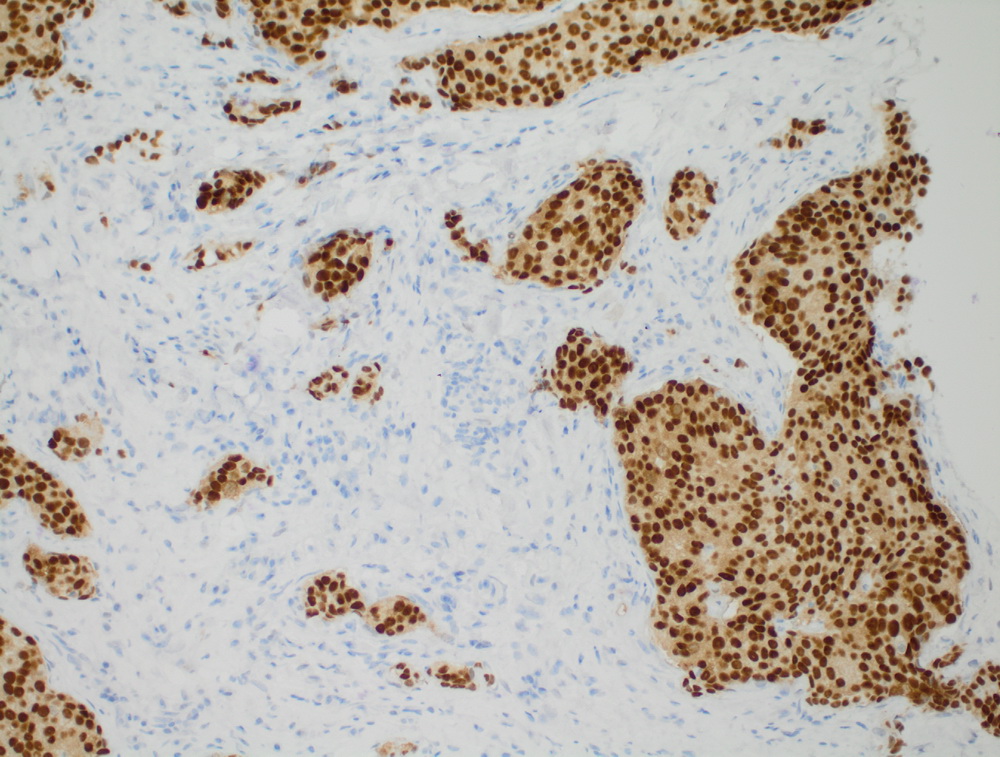 |
Инвазивный протоковый рак er 100%.
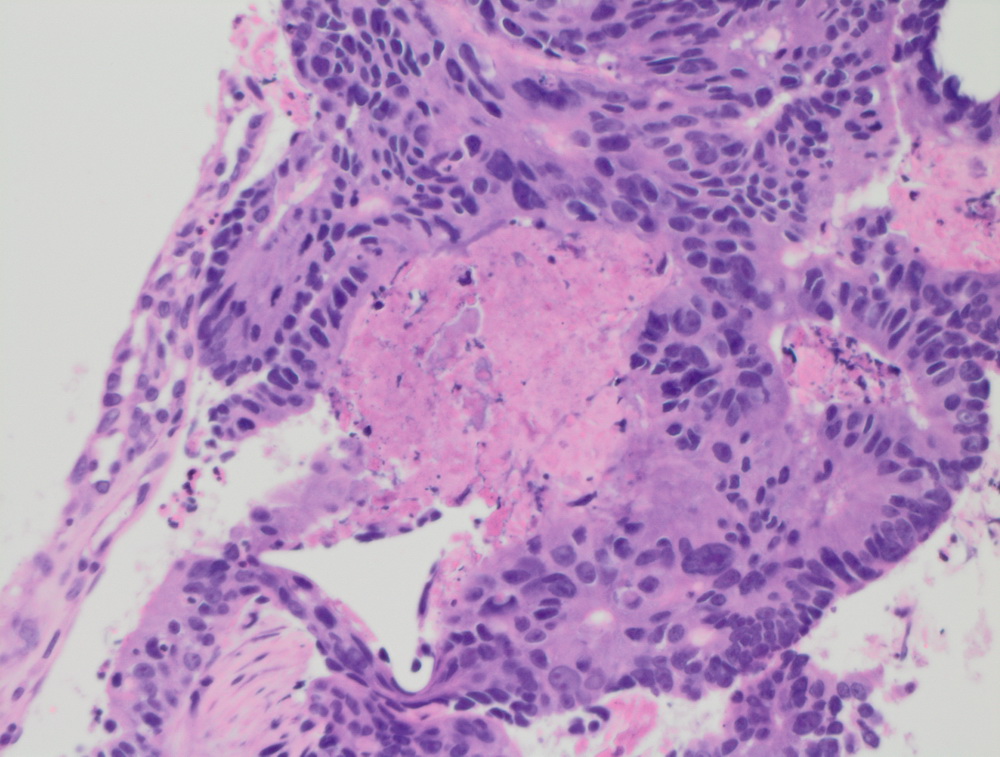
Карцинома сигмовидной кишки.
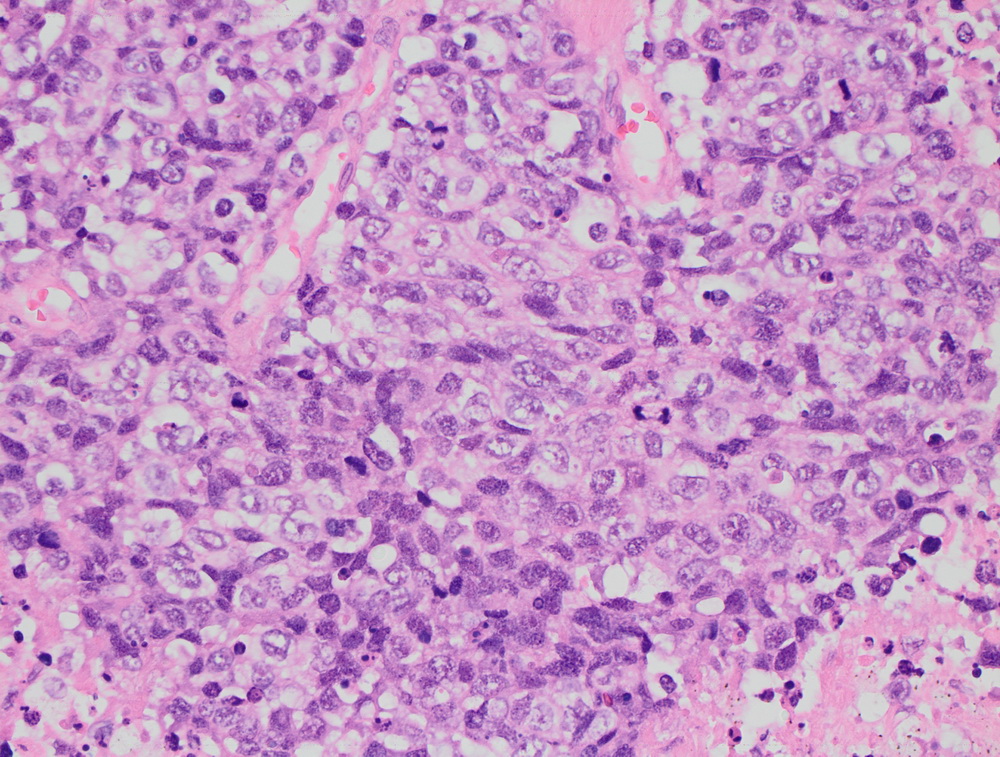
Крупноклеточная нейроэндокринная опухоль.
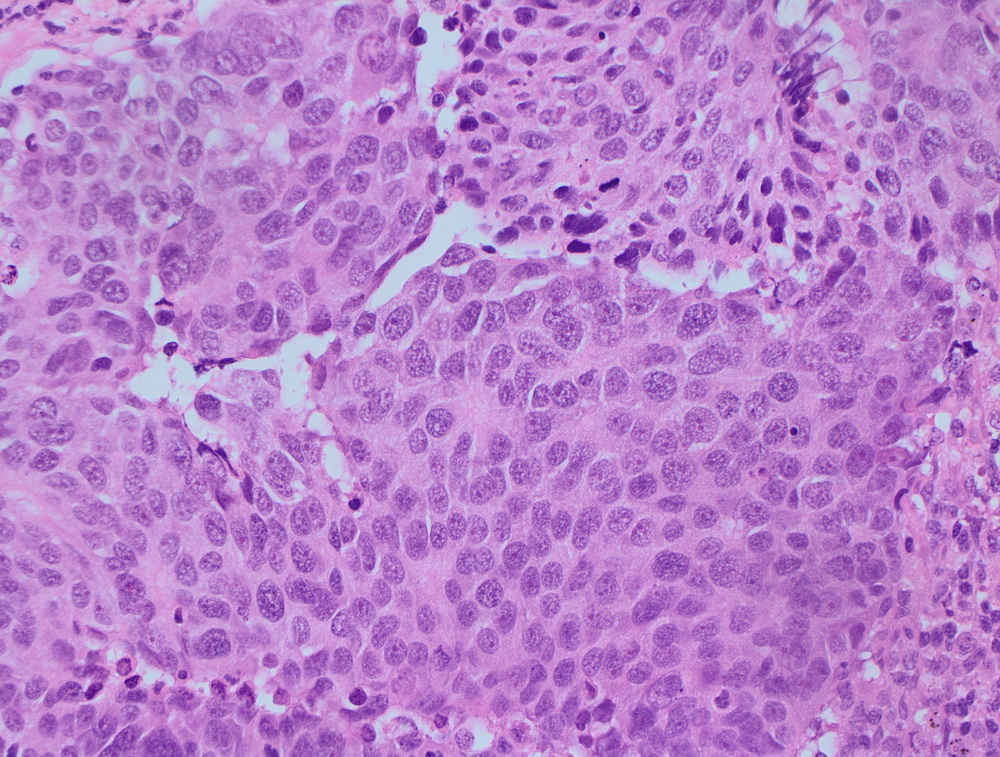
МТС крупноклеточной нейроэндокринной опухоли.
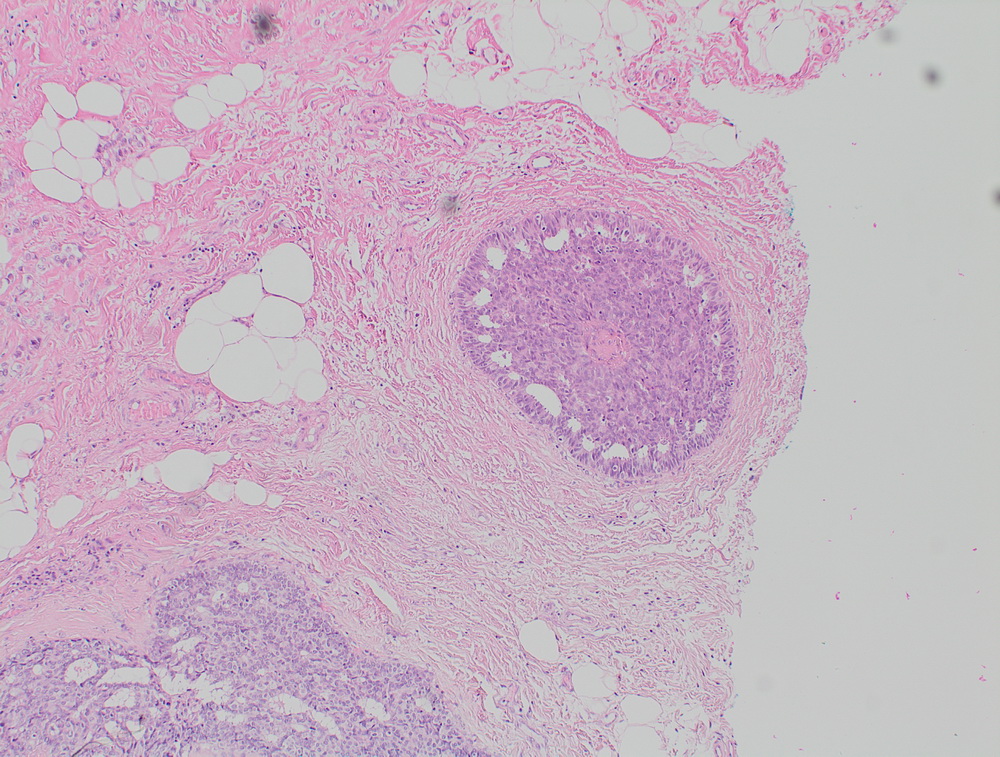
Неспецифический рак молочной железы. Участок in situ карциномы внутри протока, криброзного типа.
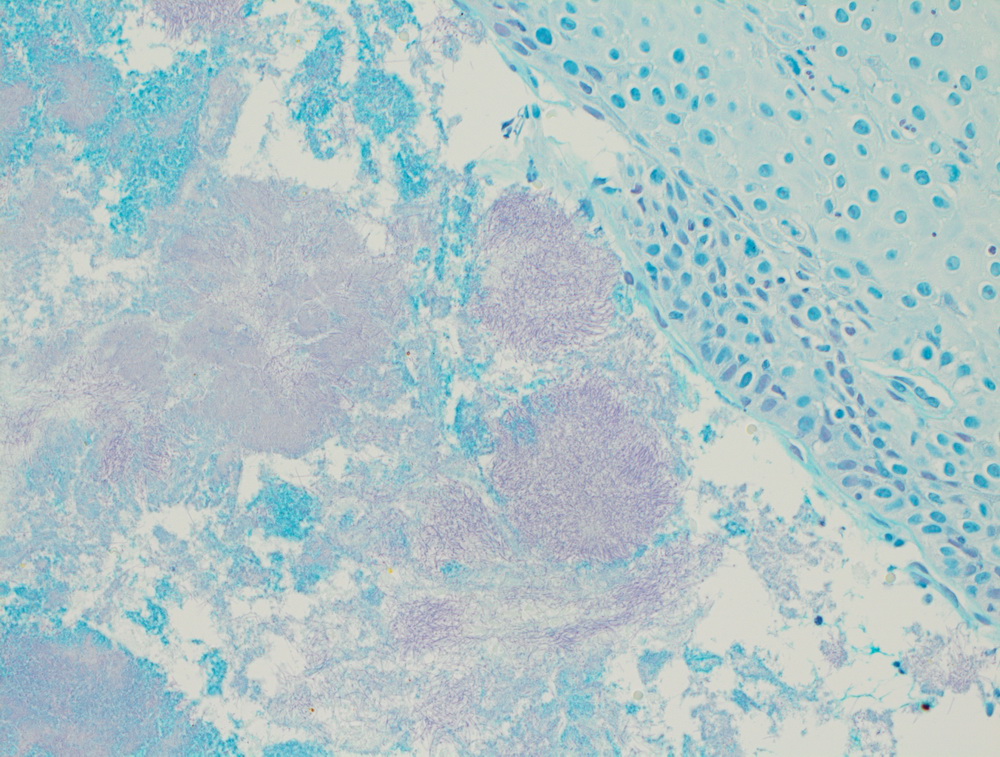
Низкодифферинцированный рак пищевода.
При гистологическом исследовании биоптата и операционного материала можно оценить распространенность: размер опухоли и прорастание в окружающие ткани, насколько затронуты лимфоузлы и есть ли метастазы в отдаленные органы (если эти все структуры присланы для гистологического исследования). При консультации готовых микропрепаратов – стекол, это, как правило, невозможно, если опухоль больше размеров гистологической кассеты или рассечена предыдущим исследователем и не предоставлены данные макроскопического исследования.
Во время гистологического исследования изучаются все стекла от одного образца – материала, полученного от одного вмешательства — одной операции или одной биопсии, вне зависимости от их количества, это считается одной консультацией.
Сроки выполнения гистологического исследования зависят от количества микропрепаратов и от категории сложности того процесса, который в них обнаруживается, сроки могут удлиняться, особенно при необходимости использования дополнительных методов исследования и анализа дополнительных сведений. На сроки выполнения гистологического исследования влияет полнота предоставленной пациентом клинической информации, в том числе данных уже проведенных исследований.
Иммуногистохимия (ИГХ)
Сложное многоэтапное исследование, выполняется после гистологического исследования на том же материале. Опухолевые срезы окрашиваются антителами, которые способны связываться антигенами (белками), которые несут опухолевые клетки. Разные опухолевые клетки несут разные антигены, к каждому из которых подобно ключа к замку подходит антитело.
Один из этапов ИГХ
ИГХ исследование — это комбинаторика. 100% специфичных и чувствительных к какой-то опухоли маркеров не существует, но есть набор антигенов, которые в определенном типе опухоль должны быть и набор тех, которых там быть не должно, таким образом ИГХ-панель строится так чтобы включать несколько антител, которые должны быть позитивны и несколько, которые должны быть негативны. Для разных опухолей различаются эти наборы позитивных/негативных маркеров.
При проведении прогностической ИГХ – выявлении маркеров чувствительности к терапии определяется набор таких маркеров для конкретных опухолей, например, рака молочной железы: рецепторы стероидных гормонов (эстроген, прогестерон), рецептор эпидермального фактора роста (HER2) и индекс пролиферативной активности Ki67 (скорости деления клеток).
Стекла окрашиваются последовательно — различными антителами красятся наборы маркеров в несколько этапов, процесс окраски стекол одним антителом занимает 48 часов.
Таким образом, каждое антитело наносится на отдельный срез ткани, монтированный на отдельное стекло, как правило с соответствующим внешним контролем, количество реакций (используемых антител) и этапов окраски может существенно варьировать в зависимости от конкретной диагностической ситуации, все зависит от индивидуальных особенностей опухоли. Проводится такое количество окрасок, которое необходимо для того, чтобы выявить наиболее характерный для определенной опухоли набор позитивных и негативных маркеров.
Кому-то для этого будет достаточно 5 антител, а кому-то необходимо сделать 20 окрасок и более. Максимальное количество окрасок, которое нам приходилось делать – 212.
Поэтому точные сроки и стоимость этого исследования невозможно определить заранее. Разные по течению и прогнозу опухоли могут быть очень похожи друг на друга, только минимальные различия в окрашивании, с учетом клинических данных и данных других методов обследования, могут позволить установить верный диагноз.
Есть целый ряд доброкачественных опухолей, симулирующих злокачественные, в том числе высокоагрессивные, а некоторые злокачественные высоко дифференцированные опухоли трудно отличить от воспалительных и реактивных процессов. В таких ситуациях только опыт и квалификация патоморфолога, анализ всего комплекса доступной информации (снимки КТ, МРТ, рентген, протокол операции, и др.) позволяют поставить диагноз.
В грамотной интерпретации результатов ИГХ очень важна роль эксперта, ведь те случаи, с которыми приходится работать, в большинстве своем, сложные. Практически не существует антител, которые могут выступать в качестве 100%-х маркеров той или иной опухоли, врачу всегда приходится взвешивать различные вероятности.
Что определяется с помощью ИГХ?
Иммуногистохимия позволяет оценить потенциальный темп роста опухоли, ответ на химио-, таргетную, гормональную терапию.
Флуоресцентная гибридизация in situ (FISH-тест)
Это метод молекулярно-генетической диагностики в ткани.
FISH проводится в срезе ткани и позволяет привязать генетическую перестройку к конкретной опухолевой клетке.
В этом тесте также используются специальные красители, которые связываются только с определенными участками хромосом. Их называют зондами, которые могут быть помечены флуоресцентным или хромогенным красителем, визуализирующимися при помощи флуоресцентного или светового микроскопа.
Технические операции по подготовке гистологических стекол к этому исследованию занимает 2 рабочих дня.
Анализ препарата с помощью многоголового микроскопа.
Полученные микропрепараты очень чувствительны к внешней среде – они могут выцвести со временем, чтобы избежать потерь информации все FISH-препараты сканируются, создается их цифровая копия, которая доступна для внешнего пересмотра. Специалисты просматривают флуоресцирующий материал в темном поле, в анализе препарата принимают участие как минимум 2 специалиста. При необходимости используется и цифровой анализ.
Что определяется с помощью FISH-теста?
FISH-тест позволят диагностировать некоторые виды опухолей, определяет целесообразность использования некоторых химиотерапевтических препаратов.
Проведение гистологического исследования, и в первую очередь FISH-теста — это экспертная работа, которая зависит от квалификации специалиста. Очень многие мутации, которые выявляются в опухолях, не всегда являются метками опухолей, они могут находиться и в доброкачественных образованиях или нормальных тканях.
За год патологоанатомическое отделение НМИЦ онкологии имени Н.Н. Петрова выполняет около 20000 гистологических исследований (пациентов), из них около 5000 консультативных случаев (пересмотров), более 30000 ИГХ исследований, а также участвует в программе внешнего контроля качества ИГХ исследований NordIQ.
Специалисты отделения обладают огромным опытом проведения гистологических исследований и экспертными компетенциями.
Скорость выполнения гистологических исследований и адекватность гистологического заключения зависят от ряда факторов:
После выполнения гистологического исследования пациент получает гистологическое заключение/протокол исследования гистологического материала.
Расшифровка гистологического исследования: на что обратить внимание?
Гистологическое заключение включает в себя несколько рубрик (полей):
Макроскопическое описание
Заполняется как для биоптатов — не обязательно, так и для операционного материала, для которого имеет крайне важное значение в ряде случаев.
Микроскопическое описание
Описание изменений на микроскопическом уровне, не обязательно к заполнению, так как вся необходимая информация может быть отражена в поле «заключение».
Результаты иммуногистохимического исследования
В этом поле описано какие антитела использовались в данном случае и каков результат окрашивания: наличие окрашивание или его отсутствие, локализация в клетке при необходимости, а также процент позитивных клеток и интенсивность реакции, когда это имеет значение.
Патологоанатомическое заключение
Содержит нозологическую/классификационную единицу, если ее возможно установить по исследованному материалу, то есть дает ответы на вопросы:
Также приводятся все необходимые прогностические данные: степень дифференцировки, параметры, влияющие на стадию, состояние краев резекции, если возможно их оценить и т.п.
Дополнительные замечания и рекомендации
Поле может содержать комментарии, относительно возможного направления дальнейшего обследования, вероятности того или иного диагноза, необходимости ознакомиться с теми или иными клиническими данными и др.
Мы не рекомендуем пациентам самостоятельно заниматься расшифровкой показателей гистологического исследования, используя информацию, полученную на различных Интернет-сайтах и форумах пациентов, так как на интерпретацию данных влияет большое количество факторов, в том числе, возраст пациента, данные других исследований и др.
Расшифровкой исследования может заниматься только специалист – врач онколог по профилю заболевания!
Авторская публикация:
АРТЕМЬЕВА АННА СЕРГЕЕВНА
заведующий патологоанатомического отделения с прозектурой ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, кандидат медицинских наук







