Деструктивный распад легкого что это
Публикации в СМИ
Деструкция лёгких бактериальная
Бактериальная деструкция лёгких (БДЛ) — гнойно-воспалительное заболевание лёгких и плевры, осложняющее бактериальную пневмонию и характеризующееся образованием полостей в лёгких и склонностью к развитию сепсиса.
Классификация • Преддеструкция • Лёгочная деструкция •• Мелкоочаговая множественная •• Внутридолевая •• Гигантский кортикальный абсцесс •• Стафилококковые буллы • Лёгочно-плевральная деструкция •• Пиоторакс (острая эмпиема плевры, гнойный плеврит) •• Пиопневмоторакс •• Пневмоторакс • Хронические формы и исходы •• Бронхоэктазы •• Вторичные лёгочные кисты •• Хроническая эмпиема плевры.
Этиология • Staphylococcus aureus • Klebsiella pneumoniae • Pseudomonas aeruginosa • Proteus • Histoplasma • Aspergillus.
Факторы риска • Аспирация носо- и ротоглоточного содержимого (неврогенные нарушения акта глотания, длительный постельный режим, эпилепсия) • Механическая или функциональная обструкция бронхов: опухоль, инородное тело, стеноз бронха • Ослабление иммунитета: алкоголизм, СД, длительный приём стероидных гормонов • Наличие источников тромботических или септических эмболов.
Клиническая картина и диагностика
• Преддеструкция — процесс, предшествующий развитию БДЛ: стафилококковая пневмония, острый гнойный лобит (чаще верхней доли правого лёгкого) •• Лихорадка •• Одышка •• Влажные хрипы •• Перкуторный звук тупой •• Лейкоцитоз, повышение СОЭ •• Для идентификации возбудителя проводят окрашивание мазка мокроты по Граму, а также её бактериологическое исследование •• Рентгенография органов грудной клетки — гомогенное затенение.
• Мелкоочаговая множественная БДЛ характеризуется поверхностной инфильтрацией паренхимы лёгких. Особенности: •• Субплевральные мелкие очаги деструкции склонны к прорывам в плевральную полость •• На обзорной рентгенограмме органов грудной клетки — просветления (ячеистость) на фоне неинтенсивного затенения.
• Внутридолевая БДЛ развивается как исход острого лобита при отсутствии лечения, характеризуется возникновением стремительно прогрессирующего очага деструкции. Особенности: •• Обильная гнойная мокрота. Зловонность мокроты часто указывает на анаэробную этиологию •• Перкуссия: локальное укорочение перкуторного звука •• Аускультация: ослабленное дыхание, влажные средне- или мелкопузырчатые хрипы; при наличии крупной полости — амфорическое дыхание •• ОАК: резкий лейкоцитоз со сдвигом влево, анемия •• Бактериоскопия и бактериологическое исследование мокроты позволяют выявить возбудителя. При подозрении на анаэробную этиологию используют образцы мокроты, полученные при фибробронхоскопии, т.к. откашливаемая мокрота содержит в основном анаэробы ротовой полости •• Обзорная рентгенограмма органов грудной клетки — просветления неправильной формы на фоне тотального затенения поражённой доли. Абсцессы аспирационного происхождения обнаруживают преимущественно в верхнем сегменте нижней доли и в заднем сегменте верхней доли.
• Гигантский кортикальный абсцесс — субкортикальное скопление гнойно-некротических масс. Особенность — на обзорной рентгенограмме органов грудной клетки толстостенная полость больших размеров. При наличии сообщения с бронхом — горизонтальный уровень жидкости.
• Стафилококковые буллы — воздушные полости, склонные к самопроизвольному регрессу, течение доброкачественное.
• Пиопневмоторакс — результат прорыва гноя из очага деструкции лёгочной ткани в плевральную полость. Особенности: •• Острая дыхательная недостаточность (возникает в момент прорыва в плевральную полость): внезапное апноэ, приступ кашля, нарастающий цианоз, одышка •• Плевропульмональный шок (сопутствует острой дыхательной недостаточности): снижение АД, тахикардия, нитевидный пульс •• Выбухание и отставание в акте дыхания поражённой половины грудной клетки •• При перкуссии тимпанический звук в верхних и притупление звука в нижних отделах лёгких, смещение средостения в здоровую сторону •• На рентгенограмме органов грудной клетки: коллапс лёгкого, горизонтальный уровень жидкости, смещение тени средостения в здоровую сторону.
• Пневмоторакс — наличие воздуха в плевральной полости. Редкое осложнение БДЛ в результате разрыва стафилококковой буллы. Клиническая картина аналогична таковой при пиопневмотораксе. На рентгенограмме органов грудной клетки: коллапс лёгкого, просветление на стороне поражения; смещение тени средостения в здоровую сторону.
• Бронхоэктазы — результат грубых деструктивных изменений стенок бронхов и перибронхиальной ткани с последующей деформацией.
• Вторичные кисты лёгких — полости санированных абсцессов.
• Хроническая эмпиема плевры.
Дифференциальная диагностика • Бронхогенный рак лёгкого в фазе распада • Туберкулёз • Инфицированная киста лёгкого • Силикотический узел с центральным некрозом • Гранулематоз Вегенера.
ЛЕЧЕНИЕ
• Тактика ведения •• Постуральный дренаж •• Антибактериальная терапия (в течение нескольких недель или месяцев до полной санации полости абсцесса и ликвидации перифокальной инфильтрации). До получения результатов бактериологического исследования мокроты рационально назначить: ••• Клиндамицин по 600 мг в/в 3 р/сут, далее по 300 мг внутрь 4 р/сут, или его сочетание с амикацином в дозе 15–30 мг/кг/сут или гентамицином по 3–7,5 мг/кг/сут в/м или в/в в 3 приёма, или ••• Цефалоспорины II или III поколения (например, цефуроксим по 0,75–1,5 г в/в каждые 8 ч или цефамандол по 0,5–1 г каждые 4–6 ч в/в), или ••• Бензилпенициллин (натриевая соль) по 2–10 млн ЕД/сут в/в в сочетании с метронидазолом в дозе 500–700 мг внутрь 4 р/сут •• Инфузионная дезинтоксикационная терапия.
• Лечение отдельных форм БДЛ имеет особенности •• Лёгочная деструкция ••• Бронхоскопическая санация с катетеризацией дренирующего бронха и дренированием полости по Сельдингеру или Мональди ••• Временная окклюзия дренирующего бронха с одновременным введением дренажной трубки, активная аспирация через введённый в полость дренаж, введение в полость склерозирующих или клеевых композиций ••• Резекция лёгкого — при выраженном кровохарканье или подозрении на бронхогенный рак •• Пиопневмоторакс ••• Торакоцентез и дренирование по Бюлау ••• Разгрузочная плевральная пункция толстой иглой (при нарастающем клапанном пиопневмотораксе) для перевода закрытого напряжённого пиопневмоторакса в открытый. После стабилизации состояния — дренирование плевральной полости ••• Временная окклюзия бронха — при наличии функционирующего бронхоплеврального свища через 12–24 ч с момента проведения плевральной пункции •• Пневмоторакс ••• Плевральные пункции ••• Дренирование показано при неэффективности пункционной терапии или при синдроме бронхиального сброса (проникновении воздуха в плевральную полость через бронх) •• Хроническая эмпиема — показание к плеврэктомии.
Осложнения • Кровотечение из эрозированного сосуда • Бронхогенная диссеминация с развитием тотальной пневмонии • Бронхоэктазы • Вторичный абсцесс мозга.
Сокращение. БДЛ — бактериальная деструкция лёгких
МКБ-10 • J85 Абсцесс лёгкого и средостения • J86 Пиоторакс
Абсцесс легкого
В клинической практике под термином «абсцесс легкого» понимают патологический процесс, характеризующийся формированием более или менее ограниченной полости в легочной ткани в результате ее некроза и последующего гнойного расплав
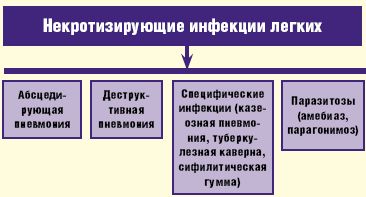
В клинической практике под термином «абсцесс легкого» понимают патологический процесс, характеризующийся формированием более или менее ограниченной полости в легочной ткани в результате ее некроза и последующего гнойного расплавления. Зачастую в описании некротизирующих инфекций в легких используют термин «некротизирующая пневмония» или «гангрена легкого», тем самым выделяя две различные клинические ситуации— легочный некроз с небольшими многофокусными формирующимися полостями и большое кавитарное поражение. Однако фактически мы нередко наблюдаем образование мелкофокусной инфильтрации с тенденцией к слиянию и образованию нескольких небольших по размеру очагов абсцедирования легочной ткани, которые в последующем могут сливаться с формированием единой полости. В группу некротизирующих инфекций легких входит не только абсцедирующая пневмония или собственно абсцесс легкого, но и деструктивная пневмония, которая характеризуется образованием полостей, нечетко отграниченных от воспаленной или малоизмененной легочной ткани; а также ряд специфических инфекций (казеозная пневмония, туберкулезная каверна, сифилитическая гумма), сопровождающихся развитием деструкции легочной ткани и паразитозы (амебиаз, парагонимоз), которые, хотя и рассматриваются вне рамок пневмонии, тем не менее, при локализации поражения в легких могут вызывать деструктивные повреждения соответствующей локализации (рис. 1).
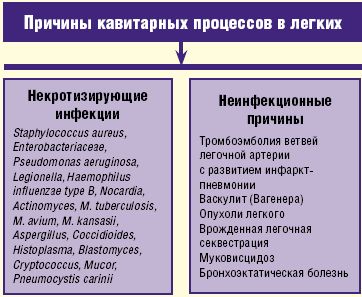
Кроме некротизирующих инфекций кавитарный процесс в легких может быть обусловлен неинфекционными причинами, а именно тромбоэмболией ветвей легочной артерии, васкулитом Вагенера, опухолевым процессом, врожденной легочной секвестрацией, муковисцидозом и бронхоэктатической болезнью (рис. 2).
Выделяют острые или хронические абсцессы легкого, основываясь на продолжительности симптомов, начиная с догоспитального этапа и вплоть до момента оказания специализированной медицинской помощи. Под острым абсцессом понимают патологическую ситуацию длительностью до одного месяца, клинические случаи с более длительным развитием клинической картины рассматриваются как хронические.
Также абсцессы легких подразделяются на первичные и вторичные, исходя из наличия/отсутствия взаимосвязанных патологических процессов. Абсцессы у пациентов, склонных к аспирации содержимого ротоглотки, а также у ранее здоровых пациентов обычно рассматриваются как первичные; вторичные абсцессы легкого обычно связывают с предшествующим возникновением бронхогенной карциномы легкого или развитием системного заболевания с выраженной дисфункцией иммунной системы, либо c ВИЧ-инфицированием, а также они возможны у пациентов, перенесших операцию по пересадке/трансплантации органов.
В основе абсцесса легкого/абсцедирующей пневмонии чаще всего лежит аспирация из верхних отделов дыхательных путей, на долю которой приходится до 70% и более всех случаев заболевания, а среди выявляемых патогенов преобладают разновидности анаэробов, которые колонизируют в десневых карманах ротовой полости. Напротив, распространение инфекции из поддиафрагмального пространства— менее частая причина, обусловливающая развитие абсцесса легкого; еще реже встречается гематогенное распространение инфекционного процесса.
Первым шагом в развитии абсцесса легкого является поступление инфицированного содержимого ротоглотки в нижние отделы дыхательных путей, что обычно происходит при нахождении пациента в лежачем положении. Аспирация содержимого ротоглотки чаще всего наблюдается у пациентов с нарушением сознания, страдающих алкоголизмом и наркоманией, а также в случае развития дисфагии. Сначала возникает пневмонит, в последующем (обычно 7–14 дней) поступивший инфицированный материал приводит к развитию некроза легочной ткани. Некроз в дальнейшем эволюционирует в абсцесс легкого и/или эмпиему; на более позднем этапе возможно открытие бронхоплеврального свища, а также прорыв абсцесса в плевральную полость.
Кроме всего прочего, существует еще ряд механизмов развития легочного абсцедирования инфекционного генеза. Во-первых, необходимо помнить об эндокардите трикуспидального клапана, основным этиологическим агентом которого является Staphylococcus aureus. Заболевание чаще всего наблюдается у молодых пациентов, страдающих внутривенной формой наркомании. Развитие патологического процесса в сердце манифестирует с развитием септической эмболии в легочной ткани.
В другом случае речь идет о так называемом синдроме Лемиера (thrombophlebitis Lemierre)— гнойном тромбофлебите шейных вен. Вначале наблюдается тонзиллит с развитием паратонзиллярного абсцесса с последующим распространением инфекционного процесса на нижележащие отделы шеи, когда затрагивается шейное сосудистое сплетение. Эволюцией процесса является бактериемия, вызываемая Fusobacterium necrophorum, которая приводит к образованию септических эмболов в легких.
Этиология абсцесса легкого известна: в 50% случаев выявляются анаэробы— Peptostreptococcus, Prevotella, Bacteroides sp. и Fusobacterium sp. (табл. 1). В другой половине случаев абсцесс легкого вызывают ассоциации анаэробных и аэробных микроорганизмов— в первую очередь представители семейства Enterobacteriaceae и, прежде всего, Klebsiella pneumoniae и K.oxytoca, реже Staphylococcus aureus, Streptococcus spp. и Haemophilus influenzae. Аэробы сравнительно редко способны вызывать мономикробный абсцесс легкого, однако стоит отметить, что K.рneumoniae и S.aureus обладают наиболее высокой гистолитической активностью.
В отношении последнего необходимо отметить, что в подавляющем большинстве доказанных случаев легочной инфекции, вызванной S.aureus, наблюдается лишь неосложненная бронхопневмония. Исключением является развитие инфекционного эндокардита правых отделов сердца. Заболевание, как уже было отмечено, манифестирует с образованием септических эмболов в легочной ткани.
К сожалению, в практической деятельности микробиологическая диагностика редко приводит к положительному результату вследствие объективных трудностей в выделении культуры анаэробов. Стандартом получения образцов для последующего микробиологического исследования является проведение трансторакальной тонкоигольной биопсии абсцесса, выполнение которой большинству пациентов не представляется возможным. Кроме того, российские лаборатории обладают невысоким опытом работы с анаэробными возбудителями.
В абсолютном большинстве случаев у истоков развития абсцесса легких лежит развитие очагового паренхиматозного воспаления, т.е. пневмонии, что сопровождается такими неспецифическими признаками инфекции нижних дыхательных путей, как лихорадка, кашель, плевральные боли и собственно очаговая инфильтрация, которая подтверждается данными клинического обследования и рентгенографией органов грудной клетки. Появление вышеобозначенных симптомов заставляет пациента обратиться за медицинской помощью, а проведение правильного диагностического алгоритма позволяет врачу диагностировать инфильтрацию легочной ткани.
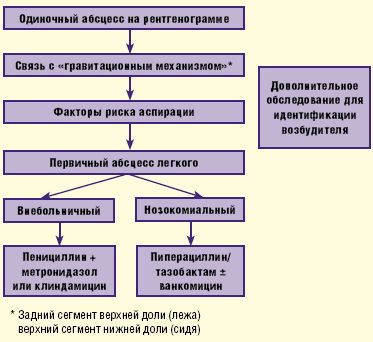
Безусловно, важным моментом является выявление причинно-следственных факторов— дисфагии, эпизодов нарушения сознания и пр., на фоне которых появилась клиническая симптоматика. Необходимо также учитывать результаты рентгенографии органов грудной клетки, проводимой в обязательном порядке в прямой и боковой проекциях. Чаще всего инфильтративные изменения с очагом некроза паренхимы легкого наблюдаются в тех сегментах легких, которые связаны с так называемым «гравитационным механизмом» (локализация абсцесса в заднем сегменте верхней доли, если аспирация произошла в положении лежа, или верхнем сегменте нижней доли, если аспирация произошла в положении сидя). Определенную роль играет интерпретация результатов общего исследования полученной мокроты— цвет, запах, присутствие крови и пр.
Однако на практике врач чаще всего диагностирует развитие пневмонической инфильтрации, не обращая внимание на анализ факторов риска аспирации и назначает антибактериальную терапию с учетом возбудителей, характерных для внебольничной пневмонии, — Streptococcus pneumoniae, Chlamydophila, Mycoplasma pneumoniae и пр. Следующим этапом естественной эволюции заболевания является некротизирующая пневмония, которая, наряду с лихорадкой и плевральными болями, характеризуется появлением «гнилостной» мокроты и формированием микроабсцессов (менее 1,0 см в диаметре). Последние обычно выявляются при компьютерной томографии органов грудной клетки, поскольку рентгенография зачастую не дает возможность надежно визуализировать полостные образования небольших размеров на фоне пневмонической инфильтрации.
Вслед за некротизирующей пневмонией формируется собственно абсцесс легкого, что сопровождается такими симптомами, как лихорадка, анорексия, похудание, возможная анемизация, плевральные боли, экспекторация «гнилостной» мокроты. Завершает диагностику формирующегося или сформировавшегося абсцесса легкого визуализация толстостенных полостных образований диаметром более 1,0 см с характерным уровнем жидкости и газа. У ряда больных, особенно в случае прилежания полости абсцесса к плевре, нередко происходит спонтанное дренирование полости абсцесса с закономерным формированием эмпиемы плевры.
Проведение дифференциальной диагностики у пациентов с выявленным абсцессом легкого необходимо с единственной целью— определить инфекционный и неинфекционный характер поражения. В обязательном порядке собирается анамнез с настороженностью в вопросах туберкулеза и, как минимум, трехкратно проводится посев мокроты либо образцов бронхиолоальвеолярного лаважа на Mycobacterium tuberculosis. Желательным является проведение бронхоскопии, так как в ряде случаев удается установить причины абсцедирования (инородные тела, опухолевое поражение и пр.).
Лечение абсцесса легкого
В большинстве клинических ситуаций антимикробные препараты при абсцессе легкого назначаются эмпирически, что связано с рядом объективных обстоятельств:
Общепринятым стандартом в лечении абсцесса легкого до настоящего времени остается применение бензилпенициллина по 2 млн ЕД внутривенно с интервалом 4 часа в комбинации с метронидазолом (0,5–1,0 г в/в с интервалом 8–12 ч); в последующем, при достижении отчетливого клинико-рентгенологического улучшения, осуществляется переход на пероральную терапию амоксициллином по 0,5–1,0 г с интервалом 8 часов и метронидазолом (0,5 г с интервалом 8–12 ч) внутрь.
Однако слабой стороной такой терапии является то, что 15–20% штаммов потенциальных возбудителей абсцесса легкого оказываются резистентными к бензилпенициллину (прежде всего, это фузобактерии и бактероиды). Кроме того, на сегодняшний день доказанным является преимущество линкосамидов (клиндамицин по 600 мг в/в с интервалом 6–8 ч с последующим переходом на прием антибиотика внутрь по 300 мг с интервалом 6 ч) по сравнению с традиционной терапией бензилпенициллином. Возможна также высокодозная терапия ингибиторозащищенными аминопенициллинами (амоксициллин/клавуланат по 2,4 г в/в с интервалом 6 часов с последующим переходом на прием антибиотика внутрь по 625 мг с интервалом 6–8 ч), предпочтительно в режиме ступенчатого лечения.
В случае нозокомиального, или внутрибольничного, происхождения абсцесса легкого назначаются ингибиторозащищенные пенициллины с антисинегнойной активностью— пиперациллин/тазобактам, в комбинации с ванкомицином (риск метициллинорезистентных S.aureus) или без него (рис. 3).
Российские эксперты в качестве препаратов выбора рекомендуют ингибиторозащищенные аминопенициллины (амоксициллин/клавуланат, ампициллин/сульбактам) либо цефоперазон/сульбактам. При отсутствии этих антибиотиков либо их неэффективности могут использоваться карбапенемы, ингибиторозащищенные пенициллины (тикарциллин/клавуланат, пиперациллин/тазобактам) либо комбинации клиндамицина с аминогликозидами (АГ) (табл. 2).
Длительность терапии при абсцессе легкого определяется индивидуально, но, как правило, составляет не менее 3–4 недель.
В ряде случаев невозможно добиться излечения пациента без хирургического вмешательства, чаще всего требуется торакотомическое дренирование, реже применяется торакоскопия и декортикация.
Клинический пример
Пациент И., 1946 года рождения, переведен в ГВКГ им Н. Н. Бурденко 23.08.2007 г. из терапевтического отделения базового госпиталя.
Из анамнеза: пенсионер МО РФ, занимается преподавательской деятельностью. Страдает сахарным диабетом 2-го типа, среднетяжелого течения с марта 2007 г., гипертонической болезнью второй стадии, ишемической болезнью сердца, дисциркуляторной энцефалопатией. Рекомендованные лекарственные препараты регулярно не принимает. Курил на протяжении 15 лет до 10 сигарет в сутки, злоупотребляет алкоголем.
Из анамнеза заболевания известно, что заболел остро в начале августа 2007 г., когда после переохлаждения температура тела повысилась до фебрильных цифр, появились озноб, боль в левой половине грудной клетки, усиливающаяся при движениях, перемене положения тела, выраженная слабость, непродуктивный кашель. Обратился в поликлинику по месту жительства, где с 8.08.07 по 13.08.07 г. проходил лечение у невролога по поводу межреберной невралгии. Получал диклофенак, с кратковременным купированием болевого синдрома. Ввиду усиления кашля, сохранения фебрильной лихорадки, болевого синдрома в грудной клетке слева врачом-неврологом заподозрена левосторонняя пневмония. Пациент госпитализирован в терапевтическое отделение базового госпиталя на шестые сутки после начала заболевания, где диагностирована левосторонняя полисегментарная пневмония. На фоне проводимой антибактериальной терапии цефтриаксоном и азитромицином получен незначительный клинический эффект. Сохранялись лихорадка до 38–39°C, озноб, выраженная слабость, боли в грудной клетке, малопродуктивный кашель. При контрольной рентгенографии органов грудной клетки на седьмые сутки от начала антибактериальной терапии отмечено прогрессирование очагово-инфильтративных изменений в легких с двух сторон, выявлен абсцесс нижней доли левого легкого. Для дальнейшего обследования и определения лечебной тактики переведен в торакальное отделение госпиталя имени Н. Н. Бурденко. При поступлении: состояние средней степени тяжести. Правильного телосложения, повышенного питания. Рост 172 см, масса тела 76 кг. Кожные покровы и видимые слизистые физиологической окраски; кожа лица— гиперемирована, умеренный акроцианоз, сосудистые звездочки на лице и груди. Периферические лимфатические узлы не увеличены. Костно-мышечная система без особенностей. Грудная клетка правильной формы, эластична. Левая половина грудной клетки отстает в акте дыхания. Перкуторно над легкими коробочный звук с резким притуплением над задненижними участками левого легкого. Аускультативно дыхание жесткое, справа над базальными отделами выслушиваются звучные мелкопузырчатые хрипы, слева над зоной притупления резкое ослабление дыхания. Частота дыхательных движений 24–26 в минуту. Пульс 100 ударов в минуту, ритмичный, удовлетворительных качеств. Сердечная область не изменена, границы относительной тупости не расширены. Тоны сердца приглушены, артериальное давление– 140/80 мм рт. ст. Учащенное мочеиспускание— до 3–4 раз ночью. В клиническом анализе крови наблюдается палочкоядерный сдвиг в сторону юных форм до 24%, лимфоцитопения, ускоренное СОЭ 55 мм/ч. При компьютерной томографии органов грудной клетки (КТ ОГК) определяются: полисегментарная инфильтрация паренхимы обоих легких, в проекции 6, 9 и 10 сегментов левого легкого жидкостное ограниченное образование 107×94 мм в поперечнике с уровнем жидкости и газа; сдавление нижнедолевого бронха слева; увеличение внутригрудных лимфатических узлов.
Установлен клинический диагноз: двусторонняя внебольничная полисегментарная пневмония (тяжелое течение), осложненная абсцессом нижней доли левого легкого, дыхательной недостаточностью второй степени. В отделении под контролем УЗИ произведено дренирование полости абсцесса с эвакуацией зловонного жидкого гноя до 500 мл и налажено проточно-аспирационное дренирование полости абсцесса. Проводилась комбинированная антибактериальная терапия Тиенамом (2 г/сут), Амикацином (1 г/сут), Метрогилом (300 мг/сут).
В результате проводимой терапии отмечена положительная клинико-рентгенологическая и лабораторная динамика. Улучшилось самочувствие больного, исчезли боли в грудной клетке, уменьшились кашель и общая слабость, на 8 сутки отмечено снижение температуры тела до субфебрильных цифр. При контрольной КТ ОГК на 5 сутки от момента начала активной терапии отмечено уменьшение полости абсцесса до 13×11 мм и интенсивности инфильтрации легочной ткани, выявлены инфильтраты с распадом в 10 сегменте левого легкого. К концу второй недели от начала лечения в госпитале температура тела нормализовалась, лабораторные показатели в пределах нормальных величин, при контрольной рентгенографии ОГК инфильтративных и очаговых изменений легочной ткани, остаточных полостей не выявлено. Пациент выписан из стационара в удовлетворительном состоянии на 51 сутки от начала заболевания и на 36 сутки нахождения в ГВКГ им. Н. Н. Бурденко.
В заключение необходимо отметить, что в диагностике и лечении заболевания у данного пациента присутствуют два важных момента. Во-первых, это поздняя диагностика внебольничной пневмонии на поликлиническом этапе, осложнившаяся формированием абсцесса легкого. Во-вторых, пациенту проводилась комбинированная антибактериальная терапия абсцесса— Тиенам + Амикацин + Метрогил, которая с точки зрения современных рекомендаций представляется избыточной.
А. А. Зайцев, кандидат медицинских наук
М. Б. Миронов, кандидат медицинских наук
А. И. Синопальников, доктор медицинских наук, профессор