Детрузорная гиперактивность что это
Патогенез гиперактивного мочевого пузыря
Теории развития ГМП
Факторы риска ГМП
Из факторов риска возникновения гиперактивного мочевого пузыря выделяют курение, ожирение, потребление газированных и содержащих кофеин напитков, снижение потребления овощей, фруктов и хлеба, повышение потребления мяса крупного рогатого скота и, как следствие, снижение потребления куриного мяса, возраст, сахарный диабет, инфекции мочевых путей. [Dallosso 2003; Brown 2000]
Увеличение риска возникновения ГМП у курильщиков связывают с индуцированными никотином фазными сокращениями детрузора, антиэстрогенным эффектом никотина на мочевой пузырь и уретру (у женщин), а также с нарушением синтеза коллагена.
При ожирении повышается интраабдоминальное и интравезикальное давление, что приводит к хроническому воздействию на нервы органов малого таза и, следовательно, к нарушению функции мочевого пузыря (Teleman 2004; Parazzini 2003).
В газированных и других искусственных напитках содержатся различные красители, консерванты и кофеин, которые оказывают раздражающее действие на мочевой пузырь, увеличивают диурез.
Сниженное содержание растительных волокон в пище, основным источником которых являются овощи и фрукты, ведет к хроническим запорам и растяжению толстого кишечника, что может влиять на функцию нервной системы органов таза. Кроме этого, овощи, фрукты и хлеб – важный источник минералов и витаминов, особенно групп В (кофакторы реакций энергетического обмена) и С (участвует в синтезе коллагена), фитоэстрогенов [Dallosso 2003].
В мясе крупного рогатого скота (по сравнению с куриным) содержится значительное количество животных жиров, которые ведут к развитию гиперлипидемии, и, как следствие, атеросклерозу сосудов и ишемии различных органов и систем, в частности, мочевого пузыря. Аналогичный патогенез может иметь место при сахарном диабете (Teleman 2004).
Возраст также можно считать фактором риска. Так, Kessler и соавт. показали, что с возрастом снижается максимальная емкость мочевого пузыря и скорость мочеиспускания, увеличивается объем остаточной мочи и ургентная симптоматика [Kessler 2004]. Имеют значение сами по себе возрстные изменения в нижних мочевых путях, изменения сосудистой и нервно систем (Brown 1999).
У женщин одним из важных факторов риска считают гипоэстрогенное состояние в перименопаузе [Балан В.Е. 2003 и 2004; Cardoso 2002].
Повышенное потребление витамина D, калия и протеина ведет к достоверному снижению риска возникновения ГМП. Имеются доказательства снижения риска возникновения при увеличении приема витаминов ВЗ (никотинамид) и В6 (пиридоксин) [Dallosso 2004].
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
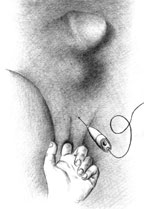 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
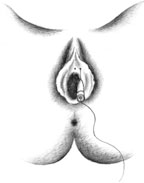 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
Гиперактивный ребенок
Гиперактивный ребенок – это ребенок с синдромом дефицита внимания и гиперактивности (СДВГ), неврологическими и поведенческими нарушениями, развивающимися в детском возрасте. Поведению гиперактивного ребенка свойственны неусидчивость, отвлекаемость, трудности концентрации внимания, импульсивность, повышенная двигательная активность и т. д. Гиперактивному ребенку требуется нейропсихологическое и неврологическое (ЭЭГ, МРТ) обследование. Помощь гиперактивному ребенку предполагает индивидуальное психолого-педагогическое сопровождение, проведение психотерапии, немедикаментозной и лекарственной терапии.
Общие сведения
По официальным статистическим данным, в России диагноз СДВГ имеют от 4 до 18% детей. Более того, данный синдром присутствует у 3-5% взрослого населения, поскольку в половине случаев гиперактивный ребенок вырастает в «гиперактивного взрослого». У мальчиков СДВГ диагностируется в 3 раза чаще, чем у девочек. СДВГ является предметом пристального изучения педиатрии, детской психиатрии, детской неврологии, детской психологии.
Причины СДВГ
Генетический механизм СДВГ объясняется наследованием генов, регулирующих обмен нейромедиаторов (дофамина и норадреналина) в головном мозге. Вследствие дисфункции нейромедиаторных систем нарушается процесс синаптической передачи, что влечет за собой разобщение связей между корой лобных долей и подкорковыми структурами. В пользу данной теории указывает тот факт, что в лечении гиперактивности у детей эффективными оказываются лекарственные средства, способствующие высвобождению и торможению обратного захвата нейромедиаторов в пресинаптических нервных окончаниях.
В числе пре- и перинатальных факторов, детерминирующих развитие СДВГ, следует отметить различного рода неблагоприятные воздействия, способствующие развитию минимальной мозговой дисфункции у гиперактивного ребенка. Это может быть:
В формировании гиперактивности у детей не исключается влияние неблагоприятных экологических факторов, прежде всего загрязнения природной среды нейротоксикантами (свинцом, мышьяком, ртутью, кадмием, никелем и др.). В частности, доказана корреляция между повышенным содержанием свинца в волосах по данным спектрального анализа и уровнем гиперактивности, когнитивными и поведенческими нарушениями у детей.
Возникновение либо усиление проявлений СДВГ может быть связано с несбалансированным питанием, недостаточностью поступления в организм микронутриентов (витаминов, омега-3 жирных кислот, микроэлементов – магния, цинка, железа, йода). Усилению трудностей адаптации, поведения и внимания у гиперактивного ребенка способствуют неблагоприятные внутрисемейные отношения.
Классификация СДВГ
Международная психиатрическая классификация (DSM) выделяет следующие варианты СДВГ:
Симптомы СДВГ
В раннем детстве гиперактивный ребенок часто имеет повышенный мышечный тонус, страдает неоднократными и немотивированными приступами рвоты, плохо засыпает и беспокойно спит, легко возбуждается, имеет повышенную чувствительность к любым внешним раздражителям.
Первые признаки синдрома гиперактивности у детей, как правило, обнаруживаются в возрасте 5-7 лет. Родители обычно начинают «бить тревогу», когда ребенок идет в школу, что требует от него определенной организованности, самостоятельности, соблюдения правил, сосредоточенности и пр. Второй пик проявлений приходится на пубертатный период (13-14 лет) и связан с подростковым гормональным всплеском.
Основными клинико-диагностическими критериями СДВГ служат невнимательность, гиперактивность и импульсивность.
Расторможенность и безрассудство сопровождается снижением инстинкта самосохранения, поэтому гиперактивный ребенок легко получает различного рода травмы.
Диагностика СДВГ
Гиперактивный ребенок является пациентом детского невролога, детского психиатра и детского психолога. Согласно критериям, выработанным DSM в 1994 г., СДВГ может быть признан при сохранении у ребенка, по крайней мере, 6-ти признаков невнимательности, гиперактивности и импульсивности в течение полугода. Поэтому при первичном обращении к специалистам диагноз СДВГ не ставится, а проводится наблюдение и обследование ребенка.
В процессе клинико-психологического обследования гиперактивного ребенка используются методы интервью, беседы, непосредственного наблюдения; получение информации от педагогов и родителей с помощью диагностических опросников, нейропсихологическое тестирование.
Необходимость проведения базового педиатрического и неврологического обследования обусловлена тем, что за СДВГ-подобным синдромом могут скрываться различные соматические и неврологические расстройства (гипертиреоз, анемия, эпилепсия, хорея, нарушения слуха и зрения и мн. др.).
С целью уточняющей диагностики гиперактивному ребенку могут назначаться консультации узких детских специалистов (детского эндокринолога, детского отоларинголога, детского офтальмолога, эпилептолога), ЭЭГ, МРТ головного мозга, общий и биохимический анализ крови и т. д. Консультация логопеда позволяет провести диагностику нарушений письменной речи и наметить план коррекционной работы с гиперактивным ребенком.
Гиперактивность у детей следует дифференцировать от фетального алкогольного синдрома, посттравматического поражения ЦНС, хронического отравления свинцом, проявлений индивидуальных характеристик темперамента, педагогической запущенности, олигофрении и др.
Коррекция СДВГ
Гиперактивный ребенок нуждается в комплексном индивидуализированном сопровождении, включающем психолого-педагогическую коррекцию, психотерапию, немедикаментозную и медикаментозную коррекцию.
Гиперактивному ребенку рекомендуется щадящий режим обучения (класс малой наполняемости, сокращенные уроки, дозированные задания), достаточный сон, полноценное питание, длительные прогулки, достаточная физическая активность. Ввиду повышенной возбудимости следует ограничивать участие гиперактивных детей в массовых мероприятиях. Под руководством детского психолога и психотерапевта проводятся аутогенные тренировки, индивидуальная, групповая, семейная и поведенческая психотерапия, телесно-ориентированная терапия, БОС-технологии. В коррекции СДВГ должно быть активно задействовано все окружение гиперактивного ребенка: родители, воспитатели, школьные педагоги.
Фармакотерапия является вспомогательным методом коррекции СДВГ. Она предполагает назначение атомоксетина гидрохлорида, блокирующего обратный захват норадреналина и улучшающего синаптическую передачу в различных структурах мозга; препаратов ноотропного ряда (пиритинола, кортексина, холина альфосцерата, фенибута, гопантеновой кислоты); микронутриентов (магния, пиридоксина) и др. В ряде случаев хороший эффект достигается использованием кинезиотерапии, массажа шейного отдела позвоночника, мануальной терапии.
Устранение нарушений письменной речи осуществляется в рамках целенаправленных логопедических занятий по коррекции дисграфии и дислексии.
Прогноз и профилактика
Своевременная и комплексная коррекционная работа позволяет гиперактивному ребенку научиться выстраивать взаимоотношения со сверстниками и взрослыми, контролировать собственное поведение, предупреждает трудности социальной адаптации. Психолого-педагогическое сопровождение гиперактивного ребенка способствует формированию социально-приемлемого поведения. При отсутствии внимания к проблемам СДВГ в подростковом и зрелом возрасте возрастает риск социальной дезадаптации, алкоголизма и наркомании.
Профилактика синдрома гиперактивности и дефицита внимания должна начинаться задолго до появления ребенка на свет и предусматривать обеспечение условий для нормального течения беременности и родов, заботу о здоровье детей, создание благоприятного микроклимата в семье и детском коллективе.