Диартрин или диафлекс что лучше
Применение симптоматических препаратов медленного действия при остеоартрозе суставов кистей
Диацереин и хондроитина сульфат, по сравнению с глюкозамина сульфатом, оказывают более стойкий и выраженный эффект при терапии остеоартроза суставов кистей. Терапия хондроитина сульфатом и глюкозамина сульфатом, в сравнении с диацереином, характеризуется
Diacerein and chondroitin sulfate, compared with glucosamine sulphate, are more persistent and pronounced effect in the treatment of OA of joints of hands. Therapy chondroitin sulfate and glucosamine sulfate in comparison with diacerein, differs the best bearableness.
С современных позиций остеоартроз (ОА) является одним из наиболее распространенных заболеваний опорно-двигательного аппарата и рассматривается как гетерогенная группа заболеваний, имеющих различную этиологию, но сходные биологические и морфологические черты [1]. Число пациентов с ОА постоянно растет, что связано с увеличением продолжительности жизни населения и накоплением факторов риска заболевания [2]. Это заболевание характеризуется неуклонно прогрессирующим течением, приводит к ухудшению качества жизни пациентов, ограничивает их физические возможности и социальные функции, становясь причиной инвалидности, что определяет актуальность поиска эффективной терапии [3]. Хроническая боль приводит к уменьшению продолжительности жизни в среднем на 10–12 лет [4]. Проблема боли при ОА носит не только медицинский, но и социальный характер и отражается на функциональной, социальной активности и продолжительности жизни [5]. Использование нестероидных противовоспалительных препаратов (НПВП) при ОА сопряжено с развитием НПВП-индуцированных гастропатий, особенно у пожилых людей. По данным рандомизированных клинических исследований, язвенные поражения желудочно-кишечного тракта выявляются у 15–40% и более пациентов, регулярно принимающих неселективные НПВП в течение 6 месяцев [6]. Прием НПВП усугубляет течение артериальной гипертензии, уменьшает эффективность антигипертензивной терапии, может усугубить застойную сердечную недостаточность [7, 8]. Считается, что большинство НПВП усиливает дегенерацию хряща при длительном применении [9–11]. Проблема уменьшения боли при ОА очевидна. Назначение симптоматических препаратов медленного действия способно уменьшить выраженность основных симптомов заболевания и потребность в анальгетической терапии [12].
В настоящее время малоизученным с точки зрения эффективности применяемых препаратов остается ОА суставов кистей. Распространенность этой разновидности ОА в европейских странах увеличивается от 10% в возрасте 40–49 лет, до 92% — в возрасте старше 70 лет [3]. У большинства людей в возрасте 55 лет и старше обнаруживаются рентгенологические признаки ОА, по меньшей мере одного из суставов кисти, а 20% из них имеют клинические признаки этого заболевания. EULAR разработаны рекомендации по ведению больных с ОА суставов кистей, согласно имеющимся исследованиям. Ряд рекомендаций связан с применением местных медикаментозных и немедикаментозных локальных методов лечения, применением НПВП. Немногочисленные исследования проведены с применением медленнодействующих препаратов, а, в частности, только хондроитина сульфат (ХС) исследован в аспекте структурно-модифицирующего эффекта при ОА суставов кистей [13]. Влияние глюкозамина и диацереина на симптомы и функцию суставов кистей не изучалось.
Целью исследования было провести сравнительный анализ клинической эффективности диацереина, глюкозамина и хондроитина сульфата у больных ОА суставов кистей.
Материалы и методы исследования
В открытое сравнительное контролируемое рандомизированное 18-месячное исследование было включено 120 женщин, соответствующих клиническим критериям диагностики остеоартроза суставов кистей [14]. Исследование проводили в соответствии с основными принципами Good Clinical Practice и Хельсинкской декларацией. Все больные подписали добровольное информированное согласие, было принято положительное решение локального этического комитета. Методом адаптивной рандомизации все пациенты были распределены на группы: 30 больных (1-я группа) принимали диацереин в дозе 50 мг 2 раза в сутки в течение 4 месяцев, 30 больных (2-я группа) — ХС 500 мг 2 раза в сутки в течение 6 месяцев, 30 больных (3-я группа) принимали глюкозамина сульфат (ГС) 1500 мг в сутки в течение 3 месяцев. Все пациенты получили 2 курса терапии с периодичностью в 6 месяцев. Сравнительная группа (4-я группа) 30 больных принимали ацеклофенак (Ац) в требуемой дозе. Больным 1–3 групп разрешалось принимать ацеклофенак по потребности. Группы больных до начала исследования были сопоставимы по основным клиническим и демографическим показателям (р > 0,05) (табл. 1).
Все пациенты были женщины. Средний возраст, стаж болезни не отличались значительной вариабельностью. Большинство больных в группах имели узелковую форму ОА с явлениями синовита. Во всех группах преобладала изолированная форма ОА мелких суставов кистей, преимущественно II рентгенологическая стадия. У всех пациентов была выявлена клиническая активность заболевания и снижение функциональных возможностей суставов. Критериями включения являлись: достоверный диагноз ОА суставов кистей, интенсивность боли в суставах > 40 мм по визуальной аналоговой шкале (ВАШ), необходимость приема НПВП, отсутствие клинически значимых нарушений функции печени и почек, подписанное информированное согласие. В исследование не включали пациентов с сердечной, почечной и печеночной недостаточностью, сахарным диабетом 1-го типа, обострением язвенной болезни желудка и 12-перстной кишки, а также больных, получавших на момент включения в исследование или за 6 месяцев до этого симптоматические лекарственные средства медленного действия.
Для оценки эффективности терапии проводили исследование выраженности боли, скованности, нарушение функции в суставах по ВАШ, оценивали функциональные индексы Дрейзера и AUSCAN. Потребность в НПВП определяли для оценки влияния терапии на течение заболевания. Динамику показателей оценивали через 1 месяц, затем каждые 3 месяца, рентгенографию суставов проводили исходно и через 18 месяцев.
Е. А. Леушина 1
О. В. Симонова, доктор медицинских наук, профессор
ГБОУ ВПО Кировская ГМА МЗ РФ, Киров
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство
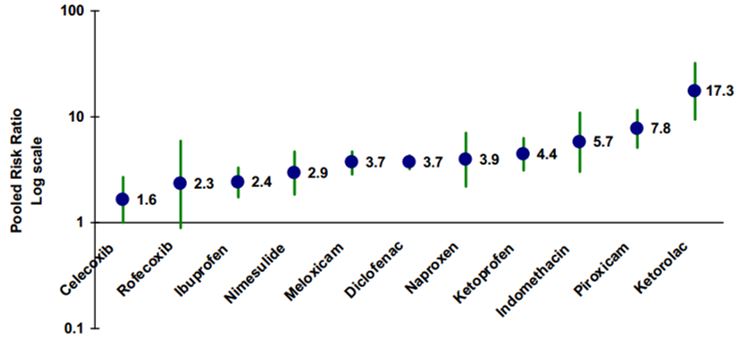
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
Диацереин в терапии остеоартрита коленных суставов: результаты сравнительного исследования
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Остеоартрит (ОА) отличается как значительной гетерогенностью в плане клинических проявлений, так и различной скоростью прогрессирования структурных нарушений, поэтому основными задачами, стоящими в настоящее время перед клиницистами и исследователями, являются выделение контингента пациентов с быстропрогрессирующими вариантами течения заболевания и разработка оптимального эффективного алгоритма терапевтического воздействия.
Диацереин является одним из симптоматических препаратов медленного действия для лечения ОА (SYSADOA), механизм действия которого заключается в ингибировании продукции и патофизиологических эффектов ИЛ-1.
Целью данного исследования являлось изучение клинической эффективности, переносимости и безопасности препарата Диафлекс (диацереин) в сравнении с хондроитина сульфатом натрия у больных с ОА коленных суставов при непрерывном приеме в течение 12 мес., а также оценка эффекта последействия препаратов.
Материалы и методы. В исследование было включено 30 больных (28 женщин и 2 мужчины) с ОА коленных суставов II–III стадии. Общая продолжительность исследования составила 15 мес. (12 мес. – прием препаратов и 3 мес. – наблюдение). Все пациенты были рандомизированы в 2 группы по 15 больных в каждой: 1-я принимала Диафлекс, 2-я – хондроитина сульфат натрия.
Результаты. Анализ результатов 12-месячного применения препаратов Диафлекс и хондроитина сульфата натрия у больных с ОА коленных суставов показал их эффективность в отношении купирования клинических симптомов заболевания (боль, скованность, ограничение движений) на фоне отмены НПВП и снижения дозы (или полной отмены) парацетамола. Диафлекс продемонстрировал более быстрый (через 2–4 нед.) клинический эффект в отношении симптомов ОА, в т. ч. при поражении мелких суставов кистей, что, вероятно, связано с особенностями механизма действия препарата. Более выраженный эффект последействия наблюдался при применении Диафлекса, что подтверждает нарастание положительной динамики индекса WOMAC и после окончания 12-месячного курса терапии.
Выводы. Назначение диацереина позволяет эффективно купировать симптомы остеоартрита, а также минимизировать развитие побочных эффектов терапии у коморбидных больных за счет уменьшения дозы (длительности назначения) НПВП и друих лекарственных средств.
Ключевые слова: диацереин, SYSADOA, остеоартрит, коморбидность.
Для цитирования: Лила А.М., Мартынова Л.В., Лила В.А. Диацереин в терапии остеоартрита коленных суставов: результаты сравнительного исследования // РМЖ. Ревматология. 2016. № 2. С. 70–77.
Для цитирования: Лила А.М., Мартынова Л.В., Лила В.А. Диацереин в терапии остеоартрита коленных суставов: результаты сравнительного исследования. РМЖ. 2016;2:70-77.
Osteoarthritis (OA) is characterized by clinical heterogeneity and different rate of structural changes. Hence, the most important goals for clinicians and scientists are to identify patients with rapidly progressive disease and to develop optimal effective therapeutic algorithm.
Diacerein is a symptomatic slow-acting drug for OA (SYSADOA) which inhibits production and effects of interleukin-1.
Aim. To compare clinical efficacy, tolerability, and safety of Diaflex/diacerein and sodium chondroitin sulfate taking continuously for 12 months as well as to evaluate the aftereffect of these drugs in knee OA.
Patients and methods. 30 patients (28 women and 2 men) with OA stages II-III were enrolled in the study. The overall duration of the study was 15 months (12 months of taking the drugs and 3 months of the follow-up). The patients were randomized into two groups (15 patients each) to receive either Diaflex (group 1) or sodium chondroitin sulfate (group 2).
Results and discussion. 12-month use of Diaflex and sodium chondroitin sulfate improves clinical signs of knee OA (pain, rigidity, movement limitation) even after NSAID or paracetamol withdrawal or decrease in dosage. Diaflex reduces OA symptoms more rapidly (in 2-4 weeks) including small hand joints. This phenomenon can be related to the mechanism of action of the drug. The aftereffect of Diaflex was superior to that of chondroitin thus indicating the improvement in WOMAC scale even after discontinuation of 12-month therapy.
Conclusions. In patients with comorbidities, diacerein effectively stops symptoms of osteoarthritis and minimizes side effects of the treatment due to the reduced dosage (duration of use) of NSAIDs and other drugs.
Keywords: diacerein, SYSADOA, osteoarthritis, comorbidity.
For citation: Lila A.M., Martynova L.V., Lila V.A. Diacerein in the treatment of knee osteoarthritis: comparative study // RMJ. Rheumatology. 2016. № 2. P. 70–77.
Статья посвящена вопросам применения диацереина в терапии остеоартрита коленных суставов. Представлены результаты сравнительного исследования
Остеоартроз – одно из наиболее распространенных заболеваний суставов, встречающееся преимущественно в средней и старшей возрастных группах. Поскольку в мире наблюдается постоянное увеличение числа людей пожилого возраста, остеоартроз становится все более значимой проблемой здравоохранения.
В последние годы активно изучается патогенез остеоартроза, при этом значительная роль отводится провоспалительным механизмам развития заболевания и, в частности, цитокиновой регуляции. В связи с этим обсуждается и сама дефиниция данной нозологической формы – большинство авторов предлагают пользоваться термином «остеоартрит», который мы и будем использовать в дальнейшем.
Основным клиническим проявлением остеоартрита (ОА) является боль в пораженном суставе, интенсивность которой зависит как от выраженности воспалительных изменений, так и от стадии ОА (структурных нарушений хрящевой ткани, субхондральной кости и окружающих сустав мягких тканей). Заболевание отличается как значительной гетерогенностью в плане клинических проявлений, так и различной скоростью прогрессирования структурных нарушений, поэтому основными задачами, стоящими в настоящее время перед клиницистами и исследователями, являются выделение контингента пациентов с быстропрогрессирующими вариантами течения ОА и разработка оптимального эффективного алгоритма терапевтического воздействия.
Диацереин в терапии ОА коленных суставов
Целью данного исследования явилось изучение клинической эффективности, переносимости и безопасности препарата диацереин (Диафлекс) в сравнении с хондроитина сульфатом натрия у больных с ОА коленных суставов при непрерывном приеме в течение 12 мес., а также оценка эффекта «последействия» препаратов.
Материал и методы
В исследование было включено 30 больных (28 женщин и 2 мужчины) с ОА коленных суставов II-III стадии (по Kellgren – Lawrence), соответствующих критериям Американской коллегии ревматологов (АКР, 1986 г.). Средний возраст больных составил 60,4±6,2 года, длительность заболевания – 5,9±4,5 года.
Исследование проводилось в соответствии с основными принципами надлежащей клинической практики. Участие в исследовании допускалось только после добровольного подписания пациентом информированного согласия и получения разрешения локального этического комитета.
При включении пациентов в исследование учитывались следующие критерии:
• мужчины и женщины в возрасте 45–75 лет;
• первичный тибиофеморальный ОА коленного сустава (согласно критериям АКР, 1986 г.);
• боль при ходьбе > 40 мм по визуальной аналоговой шкале (ВАШ);
• рентгенологическая стадия II–III (по Kellgren – Lawrence).
Критерии исключения:
• вторичный гонартроз (в т. ч. при ревматоидном артрите, подагре, после внутрисуставного перелома и др.);
• внутрисуставные инъекции глюкокортикоидов, препаратов гиалуроновой кислоты в течение 3-х мес. до начала исследования;
• асептический некроз мыщелков бедренной и/или большеберцовой кости;
• предшествующие оперативные вмешательства на коленном суставе;
• сопутствующие тяжелые заболевания: артериальная гипертензия III стадии, нестабильная стенокардия, сердечно-сосудистая недостаточность, сахарный диабет 1-го типа, тяжелые поражения печени и почек;
• острая язва желудка (12-перстной кишки) в течение последнего месяца перед исследованием.
Критериями исключения больного в ходе исследования являлись неэффективность терапии (сохранение или усиление болевого синдрома, требующее изменения тактики лечения), развитие серьезных нежелательных явлений, отказ пациента от исследования или нарушение протокола исследования.
Общая продолжительность исследования составила 15 мес. (12 мес. – прием препаратов и 3 мес. – наблюдение). Всего было запланировано 8 визитов: В.0 – скрининг, период «отмывки» (3–7 дней) в случае предшествующего приема нестероидных противовоспалительных препаратов (НПВП); В.1 – рандомизация, начало терапии; В.2 – В.7 – плановые визиты через 2 нед., 1,5, 3, 6, 9 и 12 мес. после начала терапии соответственно и В.8 – заключительный осмотр через 3 мес. после окончания терапии (оценка последействия препаратов).
Для оценки эффективности и безопасности терапии использовались следующие критерии: интенсивность боли по ВАШ (мм), тест «Встань и иди» (в секундах), индекс WOMAC (боль, скованность, функциональная недостаточность), опросник состояния здоровья EQ-5D, потребность в анальгетиках, оценка эффективности терапии врачом и пациентом, оценка переносимости проводимой терапии.
Все пациенты были рандомизированы в 2 группы по 15 больных в каждой: 1-я принимала диацереин (Диафлекс) в дозе 50 мг 2 р./сут в течение 12 мес., 2-я – хондроитина сульфат натрия (Хондроксид) в дозе 500 мг 2 р./сут. При наличии у пациента болевого синдрома в первые 7 дней терапии допускалось назначение парацетамола до 2 г/сут, а затем – по требованию. Характеристика групп обследованных пациентов представлена в таблице 1.
Практически у всех обследованных пациентов были диагностированы коморбидные состояния (табл. 2).
Из 30 больных, включенных в исследование, полный курс лечения завершили 26 (86,7%); на протяжении исследования из каждой группы выбыло по 2 пациента: из 1-й – из-за развития побочных явлений (диарея, кожная сыпь), из 2-й – в результате низкой эффективности терапии.
Статистическая обработка материала проводилась с использованием стандартных методов, в т. ч. сравнение в группах по методу Вилкоксона для количественных показателей и χ2 – для качественных.
Результаты
Основными жалобами больных, страдающих ОА, являются боли в пораженном суставе и последующее нарушение его функциональной активности, а само заболевание при этом нелетально, поэтому очень важными критериями оценки комбинированной терапии являются степень купирования болевого синдрома и улучшение функциональной активности пациентов, что в конечном итоге оказывает влияние на качество жизни больных. Также важным было изучить не только время наступления анальгетического эффекта, но и его продолжительность.
Результаты исследования свидетельствуют о том, что у больных на фоне приема исследуемых препаратов наблюдалось значимое уменьшение болевого синдрома, что выражалось в снижении индекса ВАШ (табл. 3). Следует обратить внимание на то, что, несмотря на отсутствие достоверных различий в группах в зависимости от длительности терапии, показатель ВАШ (боли) сохранялся Литература
II Евразийский конгресс ревматологов. Современные возможности выбора терапии при остеоартрозе
Остеоартроз или остеоартрит? Современное представление о болезни и ее лечении
Доктор медицинских наук, профессор Людмила Ивановна АЛЕКСЕЕВА (Научно-исследовательский институт ревматологии им. В.А. Насоновой РАМН) посвятила свое выступление современным представлениям о патогенезе и фармакотерапии остеоартроза.
Остеоартроз – распространенное хроническое заболевание суставов, которое влечет за собой утрату работоспособности, частое обращение за медицинской помощью и значительные экономические затраты на лечение.
Патогенез заболевания сложен и до конца не изучен. Сегодня российские ученые рассматривают вопрос о принятии терминологии заболевания в соответствии с международной классификацией и переименовании остеоартроза в остеоартрит. Дело в том, что согласно результатам последних исследований в патогенезе заболевания существенная роль принадлежит персистирующему воспалению с прогрессированием морфологических дегенеративных изменений в тканях.
Остеоартроз характеризуется фокальным разрушением суставного хряща, изменениями в субхондральной кости, синовиальной оболочке, образованием остеофитов.
Повреждение сустава начинается с воспаления синовиальной оболочки (синовита). Продукты деградации хряща фагоцитируются синовиальными клетками, провоцируя синовиальное воспаление. В свою очередь активированные синовиальные клетки продуцируют катаболические и провоспалительные медиаторы, инициирующие избыточную продукцию протеолитических ферментов. Воспаление усиливается активированными синовиальными Т- и В-клетками, инфильтрованными макрофагами.
Синовит рассматривается как один из признаков остеоартроза, который встречается почти у половины больных. Наличие синовита определяется по ряду диагностических признаков: припухлости суставов, локальным признакам воспаления, внезапному усилению боли, ночной и утренней скованности. При инструментальных методах диагностики (магнитно-резонансной томографии, ультразвуковом исследовании, артроскопии) у больных определяется увеличение объема синовиальной жидкости. При гистологическом исследовании наблюдаются гипертрофия и гиперплазия синовиальной оболочки, инфильтрация мононуклеарными клетками (моноцитами, макрофагами, активированными Т- и В-лимфоцитами), усиление ангиогенеза, адаптивный иммунный ответ Т- и В-лимфоцитов в отношении фрагментов внеклеточного матрикса. Исследования на молекулярном уровне отражают синтез провоспалительных цитокинов, образование простагландина Е2 и оксида азота, увеличение экспрессии молекул адгезии синовиальной ткани, усиление активности матриксных металлопротеиназ (ММП) 1, 3, 9, 13, синтез адипокинов.
В возникновении воспаления при остеоартрозе особую роль играют процессы в субхондральной кости. Докладчик подчеркнула, что согласно результатам исследований патологические изменения в субхондральной кости опережают изменения в хряще. Изменения в субхондральной кости свидетельствуют о ее воспалении, которое предшествует манифестации заболевания.
В настоящее время в мире активно изучают связь ожирения с остеоартрозом. Увеличение массы тела не только способствует возрастанию механической нагрузки на сустав, но и сопровождается воспалением с увеличенной продукцией адипокинов и провоспалительных цитокинов, вызывающих поражение хряща, кости и синовиальной оболочки.
Как правило, остеоартроз сопровождается взаимосвязанными компонентами метаболического синдрома – гипертонией, дислипидемией, гипергликемией, ожирением. Гипертония вызывает ишемию субхондральной кости, то есть активацию ремоделирования всех процессов. Дислипидемия приводит к нарушению метаболизма липидов, что в свою очередь провоцирует патологические изменения в суставе. Ожирение инициирует выброс адипокинов, участвующих в процессе воспаления. С увеличением числа компонентов метаболического синдрома остеоартроз приобретает более стремительное и тяжелое течение.
Лечение остеоартроза направлено прежде всего на уменьшение боли, улучшение функции суставов, ограничение прогрессирования заболевания. Применяются нефармакологические, фармакологические и хирургические методы лечения. Чтобы назначить адекватную терапию, необходимо не только провести тщательную диагностику, но и оценить распространенность и тяжесть суставного процесса, общий статус больного и наличие сопутствующих заболеваний.
Известен ряд фармакологических средств для лечения больных остеоартрозом, воздействующих на разные звенья хронической боли. Это препараты быстрого (анальгетики, миорелаксанты, нестероидные противовоспалительные препараты (НПВП)) и замедленного (антиостеопоретические препараты, глюкозамин, хондроитина сульфат, диацереин) действия.
Гетерогенность остеоартроза способна влиять на эффективность фармакотерапии. При выборе терапии следует учитывать фенотип заболевания – локализацию поражения, происхождение боли, структурное или симптоматическое состояние. Кроме того, определяют наличие отека костного мозга, синовита, интенсивность боли, ограничение подвижности. Коморбидность при различных нозологиях (ожирение, сердечно-сосудистые заболевания, остеопороз, депрессия) увеличивает степень тяжести остеоартроза. Необходимо также учитывать индивидуальные факторы риска развития остеоартроза – пол, возраст, психосоциальные факторы.
Докладчик подчеркнула, что рекомендовать препараты больным необходимо в соответствии с их индивидуальными особенностями.
Диацереин не только влияет на анаболизм или катаболизм хряща. Препарат ингибирует деструкцию кости, уменьшает экспрессию RANKL (tumor necrosis factor ligand superfamily member – лиганд рецептора активатора ядерного фактора каппа B), снижает уровень глюкозы натощак при сахарном диабете 2-го типа, массу тела у пациентов с ожирением.
Таким образом, препарат диацереин можно рекомендовать пациентам, страдающим остеоартрозом при наличии коморбидных состояний.
В заключение профессор Л.И. Алексеева еще раз акцентировала внимание собравшихся на том, что определение «остеоартроз» устарело. Новый взгляд на патогенез заболевания позволяет называть его остеоартритом, при котором происходит системное высвобождение провоспалительных медиаторов, обусловливающих дегенеративные изменения тканей.
Периартикулярная терапия: новая жизнь препаратов гиалуроновой кислоты
Профессор кафедры ревматологии Российской медицинской академии последипломного образования, заведующий Московским городским ревматологическим центром ГБУЗ «ГКБ № 1 им. Н.И. Пирогова», главный ревматолог Департамента здравоохранения г. Москвы Евгений Валерьевич ЖИЛЯЕВ рассказал о применении препаратов гиалуроновой кислоты при повреждениях сухожильно-мышечного аппарата.
Гиалуроновая кислота (ГК) содержится в соединительной ткани млекопитающих и представляет собой длинноцепочечный полисахарид, состоящий из чередующихся единиц N-ацетилглюкозамина и глюкуроната. Молекулярная масса ГК – 4–5 млн Дальтон (Да). ГК в высоких концентрациях содержится в синовиальных полостях и отличается высокой скоростью обмена –
3–5 г/сут.
В последнее десятилетие представления о роли ГК в лечении заболеваний суставов изменились. ГК, будучи высокоактивным биологическим соединением, участвует в регуляции ряда процессов. Она выступает как воспалительный или противовоспалительный агент в зависимости от состояния, регулирует процессы репарации, то есть является первичным заполнителем дефектов тканей и проводником мигрирующих клеток. Воздействуя на окружающие и мигрирующие клетки, ГК способствует восстановлению соединительно-тканного матрикса, стимуляции роста и размножению клеток. ГК управляет поведением стволовых клеток различных тканей, обеспечивая морфогенез в период эмбрионального развития.
ГК имеет собственные специфические рецепторы для проведения сигнала. Классический рецептор, который связывается только с ГК, – CD44. Он имеет характерный тирозинкиназный привод, может выступать как ко-рецептор и молекула адгезии. Рецептор CD44 представлен на иммунных клетках, лейкоцитах, фибробластах, гладкомышечных, эпителиальных, стволовых клетках. Еще один специфический рецептор ГК – CD168, молекула которого задействована в ряде репаративных реакций. Этот рецептор взаимодействует с другими цитокинами и рецепторами фактора роста, функционально экспрессируется на многих клетках (эндотелиальных, гладкомышечных, макрофагах). Рецептору CD168 принадлежит особая роль в процессе заживления повреждений. Еще один специфический рецептор ГК – ФНО-индуцированный белок 6, появляющийся на поверхности иммунных клеток при воспалении. Он подавляет миграцию нейтрофилов совместно с CD44. Известны и другие молекулы, взаимодействующие с высокомолекулярной ГК и запускающие различные внутриклеточные процессы.
Еще один путь взаимодействия ГК с клетками – Toll-подобные рецепторы (Toll-like receptors – TLR). В связи с тем что ГК входит в состав клеточной стенки ряда бактерий, в первую очередь стрептококков, она может распознаваться как признак инфекции через TLR2 и TLR4 макрофагами и дендритными клетками.
При взаимодействии с клеткой высокомолекулярная ГК демонстрирует три важных свойства. Во-первых, взаимодействует с Т-регуляторами – особой группой Т-лимфоцитов (CD4 и CD25), функция которых заключается в подавлении и торможении воспалительных реакций. Во-вторых, ГК способна блокировать острый воспалительный ответ и предотвращать миграцию лейкоцитов. В-третьих, ГК взаимодействует с мезенхимальными стволовыми клетками. Это свойство ГК открывает широкие перспективы для ее использования.
В ходе последних исследований продемонстрированы противовоспалительные эффекты ГК в суставах. Она подавляет продукцию ядерного фактора каппа В и ИЛ-6 макрофагами в условиях стимуляции их микробными липополисахаридами, снижает активность и продукцию ММП в клетках субхондральной кости, хондроцитах и фибробластоподобных синовиоцитах. ГК подавляет продукцию наиболее важных провоспалительных цитокинов (ИЛ-1-бета, ИЛ-8, ФНО-альфа), снижает концентрацию ИЛ-6 в синовиальной жидкости у пациентов с остеоартрозом.
Синовиоциты человека под действием препаратов ГК значительно наращивают экспрессию факторов роста – соединительно-тканного, трансформирующего, васкулярно-эндотелиального.
Высокомолекулярная ГК через CD44-рецептор обеспечивает хемотаксис мезенхимальных стволовых клеток в зону повреждения/репарации.
Сегодня благодаря уникальным свойствам ГК появились новые направления в ее применении. Это разработка средств для заживления язв и ран, блокирования образования рубцов, спаек после хирургических вмешательств на брюшной полости и в малом тазу, а также использование ГК в качестве каркаса для конструирования тканей, который впоследствии заполняется клетками-прекурсорами. ГК можно использовать в качестве носителя различных веществ (факторов роста, антибиотиков, ингибиторов металлопротеиназ) для активации репаративных процессов.
Докладчик остановился на одном из методов лечения остеоартроза – периартикулярной терапии, направленной на устранение боли.
Мишенями периартикулярной терапии являются энтезы, сухожилия, скандинозы, связки, мышцы.
Энтезы – места прикрепления к кости сухожилий, связок, суставных капсул. Энтезы являются источником боли при остеоартрозе и спондилоартрите, посттравматических и идиопатических энтезопатиях, миофасциальных синдромах. Поскольку энтезопатии сопровождаются спазмами, цель периартикулярной терапии – миорелаксация (расслабление мышц). Кроме того, такая терапия направлена на восстановление структуры поврежденного энтеза, что особенно важно при посттравматических осложнениях.
Технология периартикулярной терапии заключается в проведении иглы до кости или вдоль костной поверхности. При введении препаратов ГК желательно использовать путевой шприц или вводить иглу под ультразвуковым контролем (рис. 1).
В целом введение ГК больным остеоартрозом сопровождается выраженным уменьшением тяжести патологического процесса.
Другими перспективными локализациями для проведения периартикулярной терапии могут быть сухожилия длинной головки бицепса, собственная связка надколенника, сухожилие разгибателя большого пальца при болезни де Кервена (de Quervain), пяточные шпоры, энтезы большого вертела и др.
В настоящее время для периартикулярной терапии в основном используются глюкокортикостероиды, характеризующиеся быстрым началом действия. Однако гиалуроновую кислоту отличают свойства, которых нет у глюкокортикостероидов. ГК обладает длительным эффектом, не является допингом, при ее введении отсутствует риск разрыва сухожилия. В ближайшей перспективе препараты ГК будут активно использоваться для периартикулярной терапии.
На фармацевтическом рынке появился новый швейцарский препарат, показанный при боли и ограничении подвижности при поражениях сухожилий, – Ост Тендон (OST® TENDON) (натрия гиалуронат 2% + маннитол) в дозировке 40 мг/2 мл в шприце, в состав которого входит нативная химически немодифицированная гиалуроновая кислота, полученная методом бактериальной ферментации и последующей очистки. Предполагается двукратное введение препарата с интервалом одна неделя.
Постоянное длительное перенапряжение может привести к микротравматизации сухожилий, что сопровождается повреждением волокон и клеток. Это приводит к повреждению сухожилия, его перестройке, замещению упорядоченных коллагеновых волокон грубой рубцовой тканью. Поверхность сухожилия становится шероховатой, что повышает трение при движениях и еще больше способствует травматизации и развитию воспаления. Как следствие – боль и ограничение подвижности сухожилий.
В открытом неконтролируемом исследовании участвовало 35 пациентов. Пациенты с тендинопатией средней части ахиллова сухожилия (n = 19), латеральным эпикондилитом (n = 14) и тендинопатией малоберцовых мышц (n = 2) в течение шести недель получали по две инъекции OST® TENDON с интервалом одна неделя между инъекциями (рис. 2 и 3).
Терапевтический эффект наблюдался уже через неделю, достигалось быстрое купирование боли, которое сохранялось до конца исследования, а также спустя три месяца после окончания лечения.
Клиническая эффективность диацереина при лечении остеоартроза коленных и тазобедренных суставов
В своем докладе д.м.н., профессор Римма Михайловна БАЛАБАНОВА (Научно-исследовательский институт ревматологии им. В.А. Насоновой РАМН) подробно рассказала о результатах лечения остеоартроза препаратом диацереин.
При остеоартрозе поражаются практически все части сустава – от синовиальной оболочки до связочного аппарата и околосуставных мышц. В патогенезе заболевания важную роль играют ИЛ-1 и ФНО-альфа. Катаболическое действие ИЛ-1 проявляется в его способности стимулировать выработку хондроцитами и синовиоцитами оксида азота, который повреждает внеклеточный матрикс. Кроме того, оксид азота, снижая концентрацию антагониста рецептора ИЛ-1, активирует последний. Действие оксида азота также проявляется в процессах апоптоза хондроцитов. ИЛ-1-бета наиболее агрессивный, конституционально не экспрессируется, вырабатывается только при воспалении. Выявлена определенная корреляция между ИЛ-1-бета и активностью течения остеоартроза.
Препарат диацереин известен ревматологам с начала 2000-х гг. Диацереин является ацетилированной формой реина. Сырьем для препарата служит эмодин, получаемый из алоэ.
При остеоартрозе диацереин влияет на ИЛ-1, трансформирующий фактор роста (ТФР), активные формы кислорода (АФК). Диацереин подавляет индуцированную ИЛ-1 экспрессию ферментов, вызывающих деградацию хряща, таких как аггреканаза, ММП, глюкозидаза.
Профессор Р.М. Балабанова отметила, что купирование боли у пациентов с артрозом, принимающих диацереин, достигается при дозе 100 мг/сут. Побочный эффект препарата в виде послабления стула в большинстве случаев носит временный характер (в первые две недели) и впоследствии нивелируется. Под действием препарата изменяется цвет мочи. Об этом надо обязательно предупреждать пациентов.
Результаты клинического исследования структурно-модифицирующего эффекта диацереина при коксартрозе показали (кривая Каплана – Мейера) более высокую долю пациентов без выявленного рентгенологического прогрессирования остеоартроза в группе диацереина по сравнению с группой плацебо.
В кохрановском обзоре (2006) обобщены данные семи рандомизированных контролируемых исследований с участием свыше 2000 пациентов. Метаанализ продемонстрировал невысокую, но постоянную эффективность диацереина при остеоартрозе (остеоартрите). Диацереин достоверно значимо уменьшал боль по сравнению с плацебо при остеоартрозе (остеоартрите) коленных и тазобедренных суставов. Структурно-модифицирующий эффект доказан при остеоартрозе тазобедренных суставов.
Таким образом, согласно результатам клинических исследований диацереин является перспективным препаратом для лечения различных форм остеоартроза. Препарат улучшает функции опорно-двигательного аппарата как в период активного приема, так и в период последующего наблюдения за больными. В отношении уменьшения боли диацереин так же эффективен, как НПВП, но не вызывает побочных эффектов, характерных для НПВП. Большинство больных остеоартрозом относятся к старшей возрастной группе с высоким процентом коморбидных заболеваний, в том числе сердечно-сосудистых. Поэтому при лечении таких пациентов необходимо учитывать возможные осложнения. Обезболивающий и структурно-модифицирующий эффект препарата диацереин, его эффективность и безопасность способствуют повышению качества жизни пациентов с остеоартрозом.
Препарат диацереин, представляющий собой ацетилированную форму реина, характеризуется симптом-модифицирующими и структурно-модифицирующими свойствами. Механизм его действия связан с ингибицией синтеза и блокированием активности ИЛ-1. После приема внутрь диацереин быстро абсорбируется из желудочно-кишечного тракта и полностью деацетилируется до реина. Прием препарата одновременно с пищей увеличивает биодоступность на 25%.
В клинических исследованиях продемонстрирована эффективность диацереина в отношении влияния на боль и функциональное состояние суставов. Клинический эффект препарата, проявляющийся уменьшением боли и улучшением функции суставов, развивается со второй – четвертой недели лечения и сохраняется после прекращения приема препарата в течение одного – трех месяцев.
.gif)