Дихромат натрия что это такое
Дихромат натрия
| Дихромат натрия | |
|---|---|
 | |
| Традиционные названия | динатриевая соль дихромовой кислоты, динатрий дихромат (VI) |
| Хим. формула | Na2Cr2O7 |
| Состояние | красные до оранжевых гигроскопичные кристаллы |
| Молярная масса | |
| Т. разл. | 400 °C |
| Энтальпия образования | −1962 кДж/моль |
| Растворимость в воде | (при 20 °C) 236 г/100 мл |
| Растворимость в остальных веществах | растворим в спирте |
| ГОСТ | ГОСТ 2651-78 |
| Рег. номер CAS | |
| Рег. номер EC | 234-190-3 |
| RTECS | HX7750000 (ангидрид, дигидрат) |
| ChEBI | 39483 |
| Номер ООН | 3288 |
| ChemSpider | 23723 |
| ЛД50 | 50 мг/кг |
| Токсичность |    |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
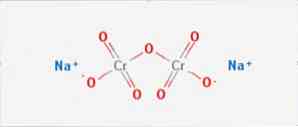
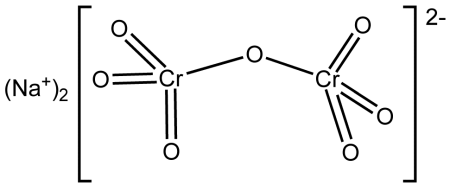
Дихромат натрия (бихромат натрия, натриевый хромпик) — неорганическое химическое соединение, натриевая соль дихромовой кислоты. Существует дигидрат дихромата натрия (Na2Cr2O7·2H2O) и безводная соль.
Полупродукт в производстве хрома, практически вся хромовая руда перерабатывается в дихромат натрия.
Следует учитывать, что дихромат натрия очень токсичен.
Содержание
Свойства
Химические
С точки зрения реакционной способности и внешнего вида дихромат натрия и дихромат калия очень похожи. Соль натрия, однако, в двадцать раз лучше растворяется в воде, чем соль калия (49 г/л при 0 °C) и её эквивалентная масса также меньше — поэтому она является наиболее часто используемым веществом.
Схожестью хромовой кислоты и дихромата натрия является их общее свойство — они являются сильными окислителями. По отношению к калийной соли, основным преимуществом дихромата натрия является его большая растворимость в воде и в полярных растворителях, например таких как уксусная кислота.
В области органического синтеза это соединение окисляет бензилы и аллильную группу C—H соединений до карбонильных производных. Так, например, 2,4,6-тринитротолуол окисляется до соответствующих карбоновых солей. Кроме того, 2,3-диметилнафталин (англ. 2,3-dimethylnaphthalene ) окисляется в присутствии Na2Cr2O7 до 2,3-нафтилдикарбоновой кислоты (англ. 2,3-naphthalenedicarboxylic acid ).
Получение
Дихромат натрия образуется в больших масштабах из руд, содержащих оксид хрома III.
Сначала руду сплавляют, как правило, с карбонатом натрия при температуре около 1000 °C в присутствии воздуха (источник кислорода):
Использование
Используют при дублении кож и в электрических элементах, как компонент биозащитных составов для древесины.
Опасность применения
Как и все соединения шестивалентного хрома, дихромат натрия очень токсичен. Кроме того, он известный канцероген. Вещество очень токсично для водных организмов, может вызвать долговременные изменения в водной экосистеме.
Дихромат натрия
| Дихромат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | динатриевая соль дихромовой кислоты, динатрий дихромат(VI) |
| Химическая формула | Na2Cr2O7 |
| Физические свойства | |
| Состояние (ст. усл.) | красные до оранжевых гигроскопичные кристаллы |
| Молярная масса | (ангидрид) 261.968 г/моль |
(дигидрат) около 100 °C
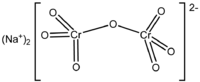
Дихрома́т на́трия (бихромат натрия, натриевый хромпик) — неорганическое химическое соединение, натриевая соль дихромовой кислоты. Существует дигидрат дихромата натрия( Na2Cr2O7·2H2O) и безводная соль.
Полупродукт в производстве хрома, практически вся хромовая руда перерабатывается в дихромат натрия.
Содержание
Свойства
Химические
С точки зрения реакционной способности и внешнего вида дихромат натрия и дихромат калия очень похожи. Соль натрия, однако, в двадцать раз лучше растворяется в воде, чем соль калия (49 г/л при 0 °C) и ее эквивалентная масса также меньше — поэтому она является наиболее часто используемым веществом.
Схожестью хромовой кислоты и дихромата натрия является их общее свойство — они являются окислителями. По отношению к калийной соли, основным преимуществом бихромата натрия является его большая растворимость в воде и в полярных растворителях, например таких как уксусная кислота.
В области органического синтеза это соединение окисляет бензилы и аллильную группу C—H соединений до карбонильных производных. Так, например, 2,4,6-тринитротолуол окисляется до соответствующих карбоновых солей. Кроме того, 2,3-диметинаптален (англ. 2,3-dimethylnaphthalene ) окисляется в присутствии Na2Cr2O7 до 2,3-напталендикарбоксилиновой кислоты (англ. 2,3-naphthalenedicarboxylic acid ).
Получение
Дихромат натрия образуется в больших масштабах из руд содержащих оксид хрома(III).
Сначала руду сплавляют, как правило, с карбонатом натрия при температуре около 1000 °C в присутствии воздуха (источник кислорода):
Использование
Используют при дублении кож и в электрических элементах.
Опасность применения
Как и все соединения шестивалентного хрома, дихромат натрия считается опасным. Кроме того, он известный канцероген. Вещество очень токсично для водных организмов, может вызвать долговременные изменения в водной экосистеме.
См. также
Ссылки
Полезное
Смотреть что такое «Дихромат натрия» в других словарях:
Дихромат аммония — Дихромат аммония … Википедия
Дихромат лития — Общие Систематическое наименование Дихромат лития Традиционные названия Бихромат лития; хромовокислый литий Химическая формула Li2Cr2O7 Физические свойства … Википедия
Дихромат рубидия — Общие Систематическое наименование Дихромат рубидия Традиционные названия Бихромат рубидия; двухромовокислый рубидий Химическая формула Rb2Cr2O7 Физические свойства … Википедия
Дихромат калия — У этого термина существуют и другие значения, см. хромпик. Дихромат калия … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия NaH2PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
натрия дихромат — natrio dichromatas statusas T sritis chemija formulė Na₂Cr₂O₇ atitikmenys: angl. sodium dichromate rus. натрий двухромовокислый; натрия бихромат; натрия дихромат ryšiai: sinonimas – dinatrio μ okso( )heksaoksodichromatas … Chemijos terminų aiškinamasis žodynas
натрия бихромат — natrio dichromatas statusas T sritis chemija formulė Na₂Cr₂O₇ atitikmenys: angl. sodium dichromate rus. натрий двухромовокислый; натрия бихромат; натрия дихромат ryšiai: sinonimas – dinatrio μ okso( )heksaoksodichromatas … Chemijos terminų aiškinamasis žodynas
НАТРИЯ ХРОМАТ — Na2CrO4, желтые кристаллы; до 423 °С устойчива орторомбич. модификация ( а =0,717 нм, b= =0,924 нм, с= 0,588 нм, z =4, пространств. группа Pnmb), выше 423°С гексагональная; DH перехода 9,62 кДж/моль; т. пл. 794°С; плотн. 2,72 г/см 3;… … Химическая энциклопедия
Гексагидроксохромат (III) натрия — Общие Систематическое наименование Гексагидроксохромат (III) натрия Традиционные названия Гексагидроксохромит (III) натрия Химическая формула Na3[Сr(OH)6] Физические свойства … Википедия
Хромат натрия — Хромат натрия … Википедия
Натрий двухромовокислый — основное сырье для производства хрома
Натрий двухромовокислый — неорганическое соединение, 
Получают бихромат натрия обработкой природного сырья — руды, содержащей окись хрома (III). В процессе производства руду сплавляют с карбонатом натрия, а потом полученное соединение хрома очищают от примесей, содержавшихся в руде. Следующий этап — окисление до соединения хрома (VI) с помощью водного раствора серной кислоты или двуокиси углерода.
Свойства
С точки зрения химии — сильный окислитель. Химические свойства сходны со свойствами калиевого хромпика, но натриевый хромпик гораздо лучше растворяется в воде. Взаимодействует с толуолом и его производными, со многими углеводородами.
 |  |  |
| Костюм «Л-1» с хранением | Натрий двухромовокислый (бихромат натрия) | Перчатки «Неотоп» химостойкие (Ansell) (9,5-10) |
Меры предосторожности
Как и все производные хрома (VI), натрий двухромовокислый очень ядовит как для людей, так и для окружающей среды. Обладает канцерогенным действием, мутаген, влияет на функцию воспроизводства. Особенно опасен для беременных, так как может нанести вред будущему ребенку. Пожаро- и взрывоопасен. Относится к 1-му классу опасности для человека. Вдыхание или проглатывание пыли или аэрозолей вещества вызывают тяжелые отравления, поражение органов дыхания и пищеварения, кожи. Воздействие на кожу или слизистые глаз может привести к химическим ожогам и плохо заживающим язвам.
Пострадавшего от контакта с бихроматом натрия следует вынести на свежий воздух, промыть место поражения, переодеть и тепло укрыть. Дать пить много воды или молока. Вызвать скорую помощь. Вызвать рвоту. Потом дать смесь из молока и яиц, жженую магнезию или активированный уголь.
На производствах, имеющих дело с натриевым хромпиком, следует предоставить работникам средства защиты от токсичной пыли или капель раствора (спецодежда, маслобензостойкие перчатки, защитные очки, противопылевые и противоаэрозольные респираторы/маски). К работе с веществом разрешается допускать только после прохождения инструктажа. Само рабочее помещение должно быть оборудовано принудительной вентиляцией, места пыления — местной вентиляцией; оборудование следует загерметизировать, пыль необходимо регулярно убирать.
Остатки реактива и тару из-под него утилизируют по правилам для опасных отходов. Требуется исключить его попадание в окружающую среду. Очистке должны подвергаться сточные воды и воздух, содержащий пыль и аэрозоли.
Хранят дихромат натрия в прохладных, сухих помещениях, отдельно от горючих материалов и сильных окислителей, вдали от источников тепла, открытого огня, потенциальных источников искр. Емкости для хранения (стальные барабаны, многослойные мешки) должны закрываться герметично.
Применение
• Сырье в химпроме для производства хрома и его производных. Большая часть добываемой хромовой руды перерабатывается в бихромат натрия, так как он является промежуточным продуктом между стадией хромовой руды и чистым хромом.
• Для изготовления минеральных пигментов, катализаторов, пассивирующих составов, антифризов для двигателей.
• В кожевенном деле для дубления кож и мехов.
• В текстильпроме для протравы тканей перед окраской.
• При изготовлении деталей электрических устройств.
• Входит в состав средств для защиты древесины от микроорганизмов и паразитов.
• Для очистки реактивов, ацетилена.
Дихромат натрия свойства, производство, опасности и применение
дихромат натрия неорганическое соединение формулы Na2Cr2O7. Это одно из многих соединений шестивалентного хрома (Cr VI). Его структура проиллюстрирована на рисунке 1, хотя обычно соль обрабатывается в дигидратированной форме, формула которой будет Na2Cr2O7 · H2O.
Он имеет две ионные связи между молекулами натрия и отрицательно заряженными атомами кислорода. Хромированная руда извлекается из дихромата натрия. Миллионы килограммов бихромата натрия производятся ежегодно.
Китай является крупнейшим производителем дихромата натрия, однако китайские химические заводы имеют относительно низкое производство, менее 50 000 тонн в год, по сравнению с казахстанским заводом, который производит более 100 000 тонн в год..
Заводы в России, Соединенных Штатах и Великобритании имеют промежуточное производство от 50 000 до 100 000 тонн в год (Kogel, 2006)..
С точки зрения реакционной способности и внешнего вида дихромат натрия обладает свойствами, аналогичными дихромату калия, однако натриевая соль более растворима в воде и имеет весовой эквивалент, меньший, чем у калиевой соли..
При нагревании дихромат натрия образует токсичные пары хрома. Это сильный окислитель и очень агрессивный.
Это соединение можно найти в источниках питьевой воды, загрязненных различными промышленными процессами, такими как гальванизация или гальваника, кожевенное дубление и текстильное производство..
Физико-химические свойства
Дихромат натрия состоит из кристаллов с красно-оранжевой моноклинной структурой в их безводной форме и без запаха. Его молекулярная масса составляет 261,97 г / моль в безводной форме и 298,00 г / моль в его дигидратированной форме..
Он имеет температуру плавления 356,7 градусов по Цельсию, температуру кипения 400 градусов по Цельсию, при которой он разлагается. Он имеет плотность 2,52 г / мл..
Рисунок 2 показывает появление дихромата натрия. Его растворимость в воде составляет 187 г на 100 г при 25 градусах Цельсия, а его растворимость в этаноле составляет 513,2 г / литр при 19,4 градусах Цельсия (Национальный центр биотехнологической информации, s.f.).
Он считается стабильным соединением, если хранится в рекомендуемых условиях, и не воспламеняется. Поскольку это сильный окислитель, он вызывает коррозию, а в растворе это кислота, обладающая способностью снижать рН до 4 в растворе 1% мас. / Об..
Методы производства
Хромат натрия может быть преобразован в дихромат с помощью непрерывного процесса, который обрабатывает серной кислотой, диоксидом углерода или комбинацией этих двух.
Испарение раствора бихромата натрия вызывает осаждение сульфата натрия и / или бикарбоната натрия, и эти соединения удаляются перед окончательной кристаллизацией дихромата натрия..
Дихромат натрия можно сделать в три этапа:
Безводный дихромат натрия можно приготовить путем плавления дигидрата дигидрата натрия, кристаллизации водных растворов дихромата при температуре выше 86 ° C или сушки растворов дихромата натрия в распылительных сушилках..
Растворы дихромата натрия в количестве 69 и 70% мас. / Об. Используются в качестве удобного и экономически эффективного способа отправки количеств, избегая необходимости ручной обработки или растворения кристаллов..
Реактивность и опасности
Это сильный окислитель. Несовместимо с сильными кислотами. Контакт с горючими материалами может привести к пожару. Токсичные пары оксида хрома могут образовываться в присутствии тепла или огня.
Известная «смесь хромовой кислоты» дихромата и серной кислоты с органическими остатками вызывает бурную экзотермическую реакцию. Эта смесь в сочетании с остатками ацетона также приводит к бурной реакции.
Сочетание дихромата и серной кислоты со спиртами, этанолом и 2-пропанолом приводит к бурной экзотермической реакции. В связи со многими инцидентами, связанными со смешением дихромат-серной кислоты с окисляемыми органическими материалами, вероятно, лучше избегать таких взаимодействий..
Комбинация дихромата с гидразином является взрывоопасной, можно ожидать, что реакция с дихроматом в целом будет энергичной с аминами. Добавление обезвоженной дихроматной соли к уксусному ангидриду приводит к окончательной взрывной экзотермической реакции.
Вдыхание пыли или тумана вызывает раздражение дыхательных путей, которое иногда напоминает астму. Может возникнуть перфорация перегородки. Считается ядом.
Проглатывание вызывает рвоту, диарею и, что очень необычно, осложнения со стороны желудка и почек. Контакт с глазами или кожей вызывает местное раздражение. Повторное воздействие на кожу вызывает дерматит.
Дихромат натрия является канцерогеном для человека. Существуют доказательства того, что соединения шестивалентного хрома или Cr (VI) могут вызывать рак легких у людей. Было показано, что дихромат натрия вызывает рак легких у животных.
Хотя дихромат натрия не был идентифицирован как тератогенное соединение или репродуктивный риск, известно, что соединения шестивалентного хрома или Cr (VI) являются тератогенными и вызывают репродуктивное повреждение, такое как снижение фертильности и нарушение менструальных циклов..
Дихромат натрия может вызвать повреждение печени и почек, поэтому с ним следует обращаться с особой осторожностью (Департамент здравоохранения Нью-Джерси, 2009 г.).
В случае проглатывания жертва должна пить воду или молоко; никогда не вызывать рвоту. При попадании на кожу или в глаза его следует рассматривать как кислотные ожоги; Промойте глаза водой не менее 15 минут.
Использование и приложения
Помимо важности в производстве других химических соединений хрома, дихромат натрия также имеет множество прямых применений в качестве ингредиента при производстве:
(Дихромат натрия, строительный блок для практически всех других соединений хрома., 2010-2012)
Дихромат натрия дигидрат, его использование идеально в различных условиях, в том числе при высоких температурах, таких как керамические глазури и цветное стекло.
Оксид хрома, твердее других оксидов металлов, таких как титан или железо, идеально подходит для сред, где температура и условия процесса агрессивны.
Это вещество в основном используется для производства других соединений хрома, но оно также используется в бентонитовых грязях, используемых при производстве нефти, в консервантах для древесины, в производстве органических химикатов и в качестве ингибитора коррозии..
При смешивании с алюминием и дихроматом калия с использованием алюмотермического процесса оксид хрома образует металлический хром высокой чистоты. Это жизненно важный ингредиент в производстве высокоэффективных суперсплавов, используемых в аэрокосмической промышленности..
В органическом синтезе дихромат натрия используется в качестве окислителя в окислительных реакциях восстановления в присутствии серной кислоты.
биохимия
Интратрахеальная инстилляция дихромата натрия (CrVI) и гидроксида ацетата хрома (CrIII) у самцов крыс приводила к повышению концентрации хрома в цельной крови, плазме и моче вплоть до 72 часов после воздействия; Максимальные концентрации были достигнуты через 6 часов после воздействия.
Соотношение между концентрациями хрома в плазме крови и хрома в плазме значительно различалось при лечении Cr (VI) и Cr (III). Поэтому анализ хрома в крови и хрома в плазме следует использовать для оценки воздействия хрома.
Хром был также обнаружен в периферических лимфоцитах. Cr (VI), но не Cr (III), значительно накапливался в лимфоцитах после лечения. Эти клетки потенциально могут быть использованы в качестве биомаркеров при оценке воздействия соединений хрома (Hooth, 2008).