Для чего нужен хроматин
Для чего нужен хроматин
• Индивидуальные хромосомы могут быть видны только в митозе
• В интерфазе основная масса хроматина находится в форме эухроматина, который по сравнению с митотическими хромосомами упакован менее плотно
• В интерфазе гетерохроматиновые области остаются плотно упакованными
Каждая хромосома содержит очень длинную двойную цепь ДНК, которая скручена в фибриллу, расположенную по всей хромосоме. Таким образом, при разработке модели структуры интерфазного хроматина и митотических хромосом, мы должны предусмотреть упаковку одной, крайне длинной молекулы ДНК в форму, которая позволяет транскрипцию и репликацию, и периодически может менять степень своей упаковки.
В клетках эукариот индивидуальные хромосомы заметны только в момент деления, когда отчетливо видна каждая из них. На рисунке ниже представлена фотография пары сестринских хроматид в метафазе, полученная в электронном микроскопе. (Сестринские хроматиды представляют собой дочерние хромосомы, образовавшиеся при репликации, но на этой стадии митоза еще остающиеся связанными друг с другом.) Каждая хроматида состоит из фибриллы мозаичного вида диаметром около 30 нм.
Плотность упаковки ДНК в хромосоме в 5-10 раз превышает плотность ее упаковки в интерфазном хроматине.
Однако в течение большей части цикла эукариотической клетки, ее генетический материал занимает в ядре пространство, в котором нельзя различить отдельные хромосомы. 30-нм фибрилла, составляющая основу хроматина, организована так же, как митотическая хромосома, или близка к ней по структуре.

Видны области компактного гетерохроматина, расположенные преимущественно в области ядрышек и ядерной оболочки.
Хроматин обладает двумя типами структуры, каждую из которых можно наблюдать на ядерных препаратах:
• В большинстве областей фибриллы упакованы гораздо менее плотно, чем в митотических хромосомах. Эти области содержат эухроматин. Он отличается относительно менее плотной упаковкой и занимает большую часть ядра.
• Некоторые области, содержащие хроматин, очень плотно упакованы фибриллами, что напоминает упаковку митотических хромосом. Эти области содержат гетерохроматин. Обычно гетерохроматин локализуется в области центромеры, но также может располагаться и в других местах. На протяжении клеточного цикла степень конденсации гетерохроматина практически не изменяется. В ядре гетерохроматин расположен в виде отдельных скоплений, но чаще его области агрегируют, образуя интенсивно прокрашивающийся хромоцентр. (Этот термин применяется к областям ядра, которые всегда содержат гетерохроматин, называемый конститутивным гетерохроматином. Наряду с этим, существует другой вид гетерохроматина, который называется факультативный гетерохроматин. Для него характерна возможность перехода в эухрома-тиновое состояние.)
Одна и та же фибрилла находится в области эу- и гетерохроматина. Это позволяет предполагать, что два вида хроматина отражают различную степень конденсации генетического материала. Точно так же различной степенью конденсации характеризуются области эухроматина в интерфазе и митозе. Таким образом, генетический материал организован таким образом, чтобы обеспечить одновременное существование в хроматине альтернативных состояний и циклических изменений его упаковки между интерфазой и делением. Далее мы обсудим молекулярные основы такой организации.
Структурное состояние генетического материала коррелирует с его функциональной активностью. Конститутивный гетерохроматин характеризуется следующими особенностями:
• Он постоянно находится в конденсированном состоянии.
• В нем часто присутствуют многократные повторы небольших нетранскрибируемых участков ДНК.
• В гетерохроматиновой области плотность генов гораздо ниже, чем в эухроматине, и гены, которые транслоцируются в эту или расположенную поблизости область, часто инактивируются.
• По-видимому, из-за своей плотной упаковки гетерохроматин реплицируется позже, чем эухроматин, и отличается низкой частотой генетических рекомбинаций.
Известны некоторые молекулярные маркеры, позволяющие констатировать изменения свойств ДНК и белковых компонентов хроматина. К числу их относится снижение степени ацетилирования гистонов, усиление метилирования одного из этих белков, и гиперметилирование цитозино-вых остатков в ДНК. Эти молекулярные изменения приводят к конденсации хроматина, которая является причиной отсутствия у него метаболической активности.
Хотя в эухроматине находятся активные гены, в каждый данный момент времени транскрибируется лишь небольшое количество последовательностей ДНК Таким образом, локализация гена в эухроматине является необходимым, но недостаточным условием для его экспрессии.
каждая из которых содержит фибриллу (диаметром 30 нм),
компактно упакованную в хромосому.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Для чего нужен хроматин
Слово «хромосома» означает «окрашенное тело» (окрашивается более эффективно, чем остальные компоненты клетки). Каждая хромосома состоит из очень длинной молекулы ДНК, связанной с РНК и белками, образующей вещество, известное как хроматин. Во время интерфазы клеточного цикла (когда клетка не делится) хромосомы распределены по всему ядру, в то время как при митозе и мейозе они уплотняются, располагаясь ближе друг к другу.
ДНК содержится именно в хромосомах, вероятно, потому, что это облегчает разделение полного набора генов между дочерними клетками на стадии митоза, а также её упаковку в головки сперматозоидов после мейоза.
Способность к окрашиванию используют в диагностических целях для визуального исследования хромосом, их идентификации и выявления патологий. Различают слабоокрашенные части (эухроматин) и области с более выраженной окраской (гетерохроматин).
Генетическая информация (геном) заключена в молекуле ДНК и кодирована определённой последовательностью азотистых оснований в ДНК. Основная часть этой информации находится в составе хромосом в ядре клетки, однако небольшое количество ДНК в виде свободных цепочек локализовано в митохондриях цитоплазмы. Ядра присутствуют практически во всех клетках организма человека, за исключением эритроцитов и клеток хрусталика.
Обычно в каждом ядре содержится двухметровая цепь ДНК, разделённая между 23 парами хромосом (примерно по 4 см на хромосому). Однако непосредственно перед делением она уплотняется до 5 um (0,005 мм) посредством сложных процессов спирализации и уплотнения.
Структура хроматина хромосом
В каждой хромосоме цепь ДНК дважды обмотана вокруг октамерного комплекса, состоящего из восьми «белков хранения» (гистонов), формирующих нуклеосомы, при этом образованная структура напоминает «бусы на нити». Кора (сердцевина) нуклеосомы состоит из двух молекул каждого из четырех гистонов— Н2А, Н2В, НЗ и Н4. Гистоны заряжены положительно, а потому могут образовывать ионные связи с отрицательно заряженными фосфатными группами ДНК.
Последовательность аминокислот в гистонах у всех видов совпадает практически на 100%, указывая на огромную значимость данных элементов в поддержании структуры и функций хроматина. Каждая нуклеосома вмещает порядка 200 пар оснований молекулы ДНК и укорачивает длину цепи ДНК на одну десятую.
Затем подобная бусам нить спирализуется в соленоид, или зигзагообразную спираль (фибрилла длиной 30 нм), состоящую из 5—6 нуклеосом. При этом её структура поддерживается одной молекулой гистона HI на каждую нуклео-сому. Коэффициент упаковки при образовании соленоида примерно равен 5, что в свою очередь даёт общий коэффициент упаковки 50. Существует предположение, что в таком состоянии эухроматин находится во время интерфазы в местах, где гены не экспрессируются.
Во время митоза и мейоза хромосомы ещё больше уплотняются, при этом коэффициент упаковки по отношению к предыдущим уровням составляет 100, а общий коэффициент может достигать 5000. Считают, что фибриллы хроматина складываются в вытянутые петли, в основании которых расположен скаффолд (остов) из негистоновых хромосомных белков, которые прикрепляются к определённым последовательностям оснований, рассредоточенным вдоль молекулы ДНК. Сжатие этих негистоновых хромосомных белков предположительно обусловливает уплотнение хромосом.
Один из ключевых белков скаффолда — топоизомераза II, фермент, который расщепляет двойные цепи ДНК, переносит их через разрыв и вновь соединяет, что в свою очередь необходимо для релаксации суперспиралей ДНК во время репликации или транскрипции. Топоизомераза II прикрепляется к участкам связывания со скаффолдом, которые богаты А- и Т-основаниями (более 65% оснований составляют А и Т, см. главу 4). Считают, что каждая петля выступает в роли независимого функционального домена во время репликации или транскрипции ДНК.
На следующем этапе петли фибрилл хроматина спирализуются, в результате чего возникает наиболее уплотнённый гетерохроматин, входящий в состав хромосомы во время деления клеток.
Дифференциальное окрашивание хромосом
Наиболее уплотнённые части хромосом хорошо окрашиваются красителем Гимзы (G-окраска). При этом отчётливо видны сильно уплотнённые маленькие петли (G-полосы), так как участки связывания со скаффолдом тесно прилегают друг к другу. Их репликация происходит во время S-периода, они не активны во время транскрипции. Полосы, которые плохо окрашиваются раствором Гимзы, или R-полосы, состоят из более свободных петель, богатых Г- и Ц-основаниями, они отличаются высокой активностью во время транскрипции. В основе идентификации хромосом лежат различия в их окраске.
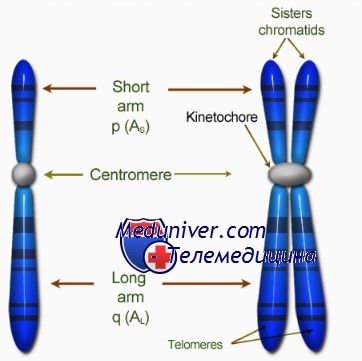
Центромера хромосом
Видимые на ранних стадиях митоза хромосомы состоят из двух абсолютно одинаковых структур, называемых сестринскими хроматидами, которые соединяет первичная перетяжка. Она представляет собой недуплицированный участок ДНК, или центромеру, которая дуплицируется в начале анафазы митоза.
Кинетохор — органелла, которая локализована на каждой стороне каждой центромеры в период ранней профазы митоза и облегчает полимеризацию димеров тубулина, необходимую для образования микротрубочек митотического веретена (веретена деления).
Тепомера хромосом
Теломерой называют специализированный участок конца хромосомы. К ней прикрепляются теломерспецифические белки, образующие «шапочку» (cap) для защиты конца хромосомы.
Теломеры предположительно препятствуют патологическому слиянию концов хромосом конец в конец, обеспечивают полноту репликации, участвуют в образовании пар хромосом во время мейоза и помогают восстанавливать внутреннюю структуру ядра на стадии интерфазы путём присоединения хромосом к ядерной мембране.
Эухроматин и гетерохроматин хромосом
Эухроматин находится в уплотнённом состоянии во время деления клеток и распаковывается на стадии интерфазы. Он обусловливает бледное окрашивание R-полос в уплотнённых хромосомах и содержит большинство структурных генов.
Гетерохроматин очень сильно уплотнён во время деления клетки и остаётся в таком состоянии даже на стадии интерфазы. Он локализован в основном на периферии ядра и около ядрышка и не активен во время транскрипции. Конструктивный (структурный) гетерохроматин одинаков во всех клетках организма, в то время как факультативный гетерохроматин различен в зависимости от типа генов, экспрессируемых в дифференцированных клетках определённых тканей.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Хроматин
Хроматин (греч. chroma — цвет, краска и греч. nitos — нить) — это вещество хромосом — комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК. [1]
Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, — надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков четырех типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа — всего восемь белков. Гистон H1, более крупный, чем другие гистоны, связывается с ДНК в месте её входа на нуклеосому. [2]
Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу. Дальнейшая упаковка этой фибриллы может иметь различную плотность. Если хроматин упакован плотно его называют конденсированным или гетерохроматином, он хорошо видим под микроскопом. ДНК, находящаяся в гетерохроматине не транскрибируется, обычно это состояние характерно для незначащих или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки.
Если хроматин упакован неплотно, его называют эу- или интерхроматином. Этот вид хроматина гораздо менее плотный при наблюдении под микроскопом и обычно характеризуется наличием транскрипционной активности. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием и фосфорилированием
Считается, что в ядре существуют так называемые функциональные домены хроматина (ДНК одного домена содержит приблизительно 30 тысяч пар оснований), то есть каждый участок хромосомы имеет собственную «территорию». Вопрос пространственного распределения хроматина в ядре изучен пока недостаточно. Известно, что теломерные (концевые) и центромерные (отвечающие за связывание сестринских хроматид в митозе) участки хромосом закреплены на белках ядерной ламины.
Хроматин
Из Википедии — свободной энциклопедии
Хроматин (от греч. χρώμα «цвета; краски») — нуклеопротеид, составляющий основу хромосом. Состоит из ДНК и белков (главным образом гистонов). Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот.
Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30-нм фибриллу. Дальнейшая упаковка этой фибриллы может иметь различную плотность. Если хроматин упакован плотно, его называют конденсированным или гетерохроматином, он хорошо видим под микроскопом. ДНК, находящаяся в гетерохроматине не транскрибируется, обычно это состояние характерно для незначащих или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки.
Если хроматин упакован неплотно, его называют эу- или интерхроматином. Этот вид хроматина гораздо менее плотный при наблюдении под микроскопом и обычно характеризуется транскрипционной активностью. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием, фосфорилированием, метилированием и другими модификациями.
Считается, что в ядре существуют так называемые функциональные домены хроматина (ДНК одного домена содержит приблизительно 30 тысяч пар оснований), то есть каждый участок хромосомы имеет собственную «территорию». Вопрос пространственного распределения хроматина в ядре изучен пока недостаточно. Известно, что теломерные (концевые) и центромерные (отвечающие за связывание сестринских хроматид в митозе) участки хромосом закреплены на белках ядерной ламины.
Энциклопедичный YouTube
Субтитры
Неуловимая архитектура хроматина мухи
Архитектура хроматина одиночных клеток плодовой мушки дрозофилы оказалась намного более предсказуемой, чем ожидалось
Автор
Редакторы
Рецензенты
Статья на конкурс «Био/Мол/Текст»: Судьба клетки во многом определяется тем, как ее гены, закодированные в ДНК, считываются и работают. Мы узнаём всё больше о том, как в этом процессе важна пространственная организация хроматина (иными словами — его архитектура). Структурная биология хроматина — большая и кипучая область, и именно здесь можно придумать и поставить такой эксперимент, который прояснит фундаментальные принципы жизни клетки. Мне удалось стать не только свидетелем, но и участником такого события. С помощью непростого эксперимента фиксации конформации хромосом одиночных клеток мы предположили два возможных механизма формирования структуры хроматина мухи, тесно связанных с активностью генов. Более того, мы выяснили ряд особенностей хроматина этого организма. На пути к открытию пришлось преодолеть всевозможные трудности. И теперь, когда работа опубликована в Nature Communications, я делюсь рассказом о том, почему это было не только трудно, но и интересно.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Трехмерная структура хроматина одиночных клеток
Петли (loops) — неоднозначный термин в области биологии хроматина. В данном случае мы используем его как синоним пиков (peaks), которые видны на Hi-C-картах как яркие сигналы вне главной диагонали [3].
Отчасти причина в том, что Hi-C — это метод высокопроизводительного секвенирования, для которого требуется много ДНК: несколько десятков микрограммов. Чтобы получить такое количество ДНК, ученые проводят эксперимент на миллионах клеток. К сожалению, при этом не получается учесть, что каждая клетка и набор ее контактов ДНК — уникальны. Трехмерная организация хроматина одиночного ядра является следствием индивидуального процесса упаковки длинной молекулы ДНК под влиянием термодинамического движения молекул и никогда не повторяется. Глядя на миллионы прочтений после секвенирования, мы не можем назвать те контакты, которые встретились в одном ядре одновременно.
Прочтения, или риды (reads), — это последовательности нуклеотидов, которые можно получить из образца ДНК с помощью секвенирования [4]. Хотя существуют разнообразные методы секвенирования [5], в этой работе мы использовали один из самых эффективных и популярных: секвенирование нового поколения с помощью Illumina. Это высокопроизводительный метод, позволяющий прочитать сотни гигабайт последовательностей ДНК. Именно с этих данных начинается вычислительная работа: прочтения картируют и ищут в них контакты ДНК.
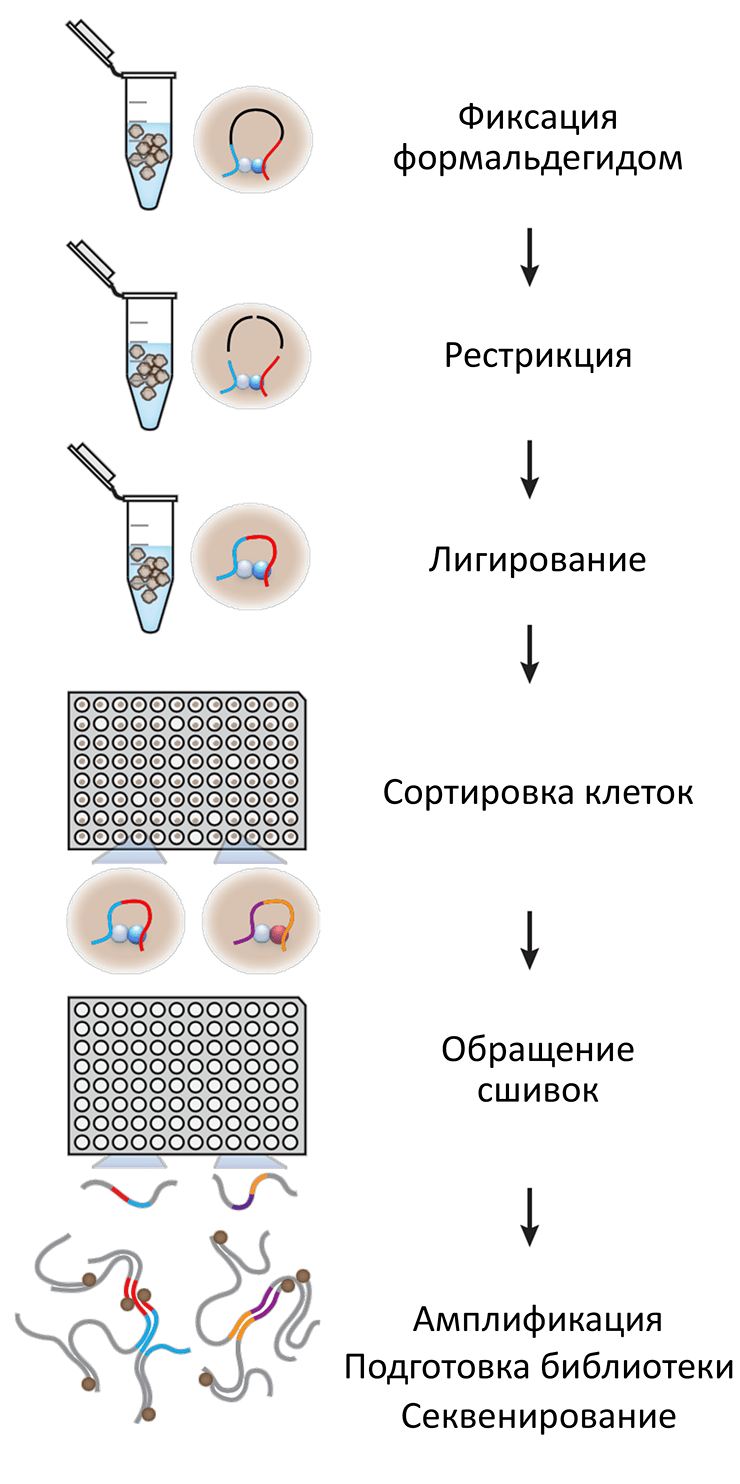
Более того, нам важно не только узнать набор контактов ДНК, но и реконструировать те физические процессы, которые, возможно, привели к тому, что сформировался именно такой набор контактов. К сожалению, такая реконструкция становится сложной и дает неоднозначные и трудно интерпретируемые результаты, если неизвестно, какие контакты ДНК имеются в одной клетке. Чтобы решить эту проблему, удалось интегрировать два экспериментальных протокола. Часть была взята от методов секвенирования геномов одиночных клеток [6], а часть — от Hi-C, и в итоге получилась техника single-cell Hi-C, или Hi-C одиночных клеток (рис. 1) [7].
Рисунок 1. Протокол Hi-C одиночных клеток. В Hi-C одиночных клеток первые этапы напоминают традиционное Hi-C на популяции: хроматин фиксируется, фрагментируется и сшивается с помощью лигазы. На следующем этапе, важном именно для данного протокола, каждая клеточка попадает в собственную лунку с помощью клеточного сортера (FACS). В каждой лунке оказывается порядка одного пикограмма ДНК. Этого недостаточно для того, чтобы прочитать ее последовательность с помощью методов высокопроизводительного секвенирования! Проблему решает амплификация с помощью специальной процессивной полимеразы фага phi29, которая значительно увеличивает количество копий ДНК. Такую амплифицированную ДНК уже можно отправлять на секвенирование и начинать обработку массивных данных.
Сшивки ДНК одиночных клеток
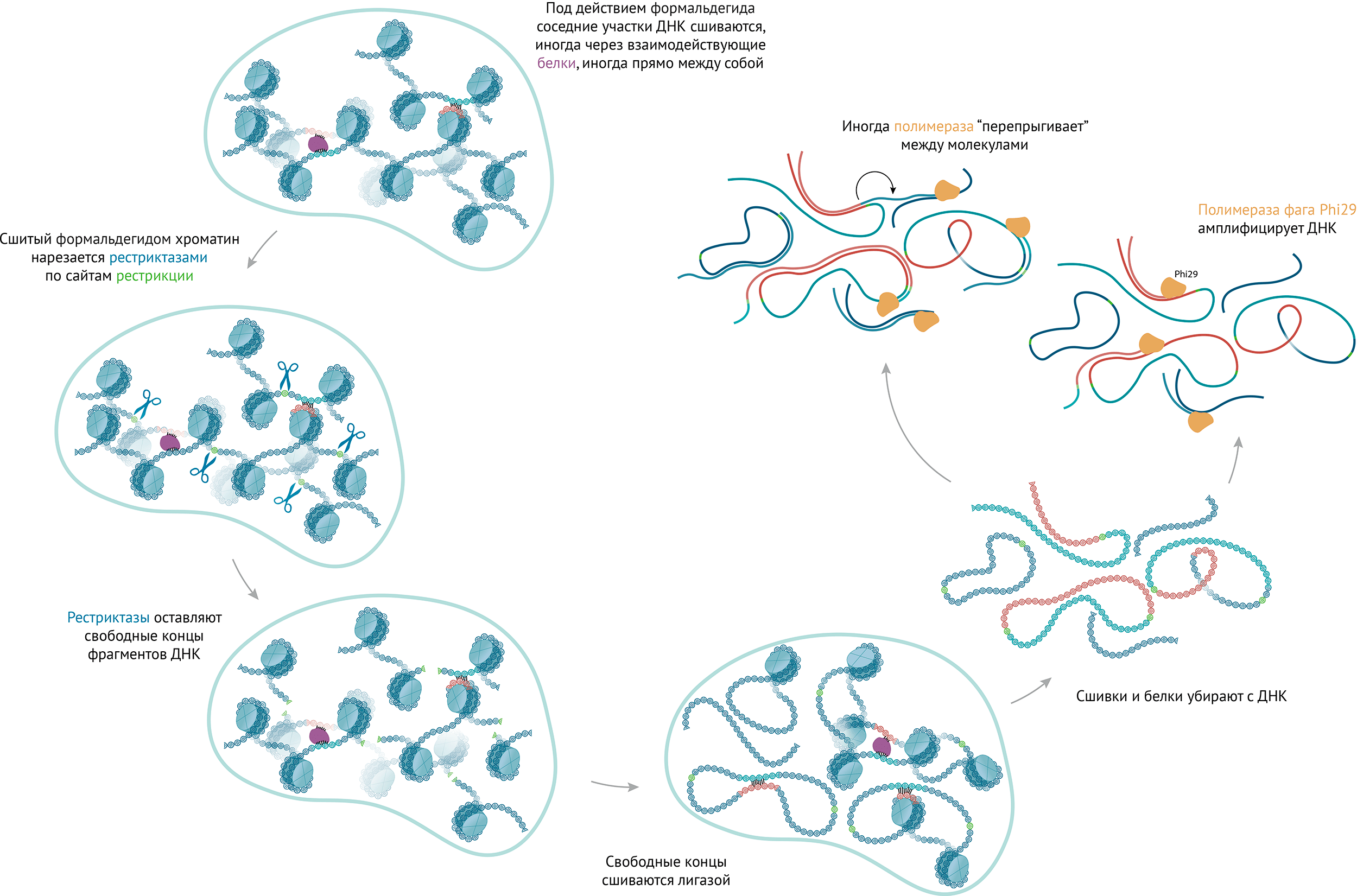
В казалось бы простом экспериментальном протоколе нашлось место и «подводным камням». Оказалось, что полимераза Phi29, с помощью которой мы амплифицировали геномную ДНК индивидуальных клеток, может совершать случайные «прыжки» между молекулами ДНК (рис. 2). Это приводит к возникновению искусственных сшивок, которые традиционные алгоритмы обработки данных Hi-С не отличают от настоящих контактов, образовавшихся в ядре клетки.
Рисунок 2. Последовательность манипуляций с ДНК в протоколе Hi-C одиночных клеток.
иллюстрация Михаила Гурьева
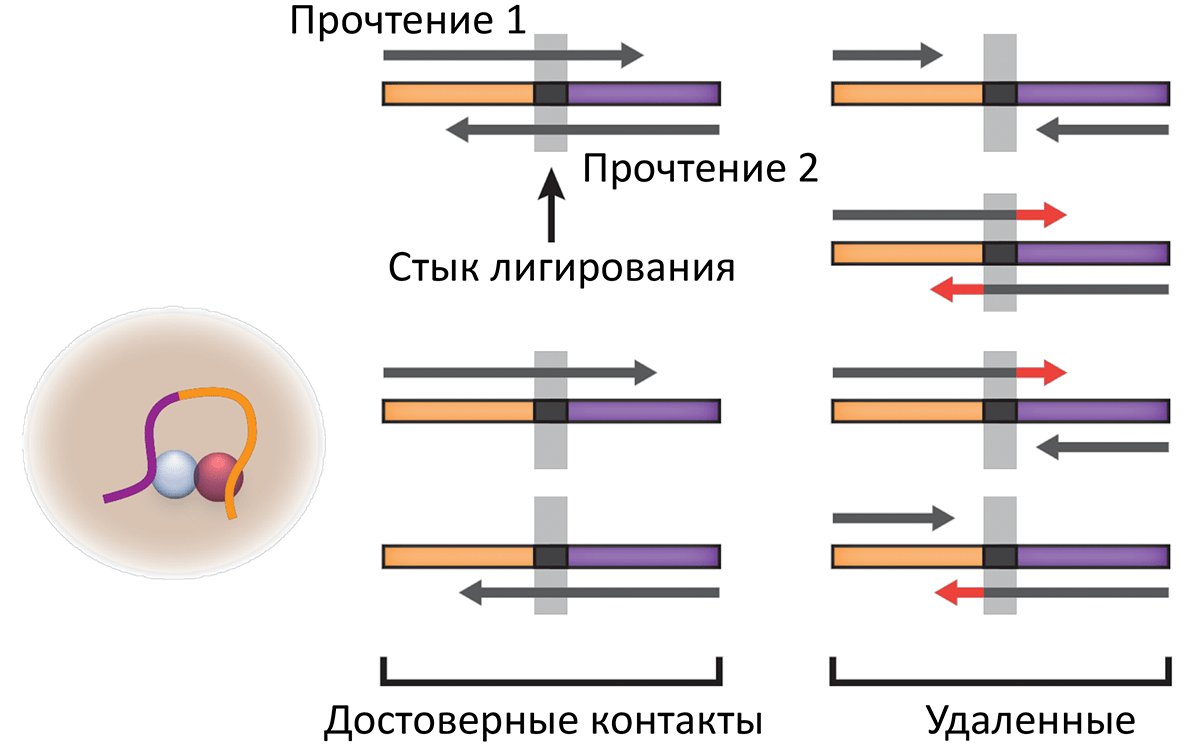
К счастью, нашелся способ отличить настоящие и фальшивые контакты. Дело в том, что при лигировании соединение фрагментов происходит только по сайтам рестрикции, которые легко можно найти в последовательности ДНК. Прыжки полимеразы, напротив, происходят случайно и не имеют характерной подписи.
После картирования отдельно взятого прочтения Hi-C можно обнаружить стык лигирования и проверить, что он совпадает с сайтом рестрикции: значит, такому контакту можно доверять, с большой вероятностью он произошел в результате пространственного сближения и лигирования фрагментов хроматина внутри ядра. А по позициям картирования этих участков на геноме можно определить, какие участки ДНК последовательно соединялись в ходе эксперимента.
Чтобы вычислительно реализовать эту процедуру обработки данных, мы разработали алгоритм ORBITA (One-Read Based InTeractions Annotation), основанный на программе pairtools (рис. 3) [8]. Он позволяет извлекать и фильтровать настоящие сшивки ДНК, которые произошли в ходе пространственно-зависимого лигирования в ядре. Масштабное сравнение с подходом, который использовался ранее [9], [10], показало, что фильтрация по сайтам рестрикции помогает находить достоверные контакты Hi-C одиночных клеток и улучшает анализ.
Рисунок 3. ORBITA-подход для получения настоящих контактов Hi-C одиночных клеток
Совпадение или правило?
После того, как отлажена техника работы с Hi-C одиночных клеток, можно перейти к самому интересному — наблюдениям за новыми свойствами и механизмами формирования пространственной структуры хроматина. Пожалуй, самый интересный вопрос — являются ли механизмы и способы укладки хроматина разных организмов универсальными? Ранее Hi-C одиночных клеток проводили только для млекопитающих. Одно из важных наблюдений состояло в том, что хроматин одиночных клеток образует разбросанные по геному домены (участки с повышенной частотой контактов внутри).
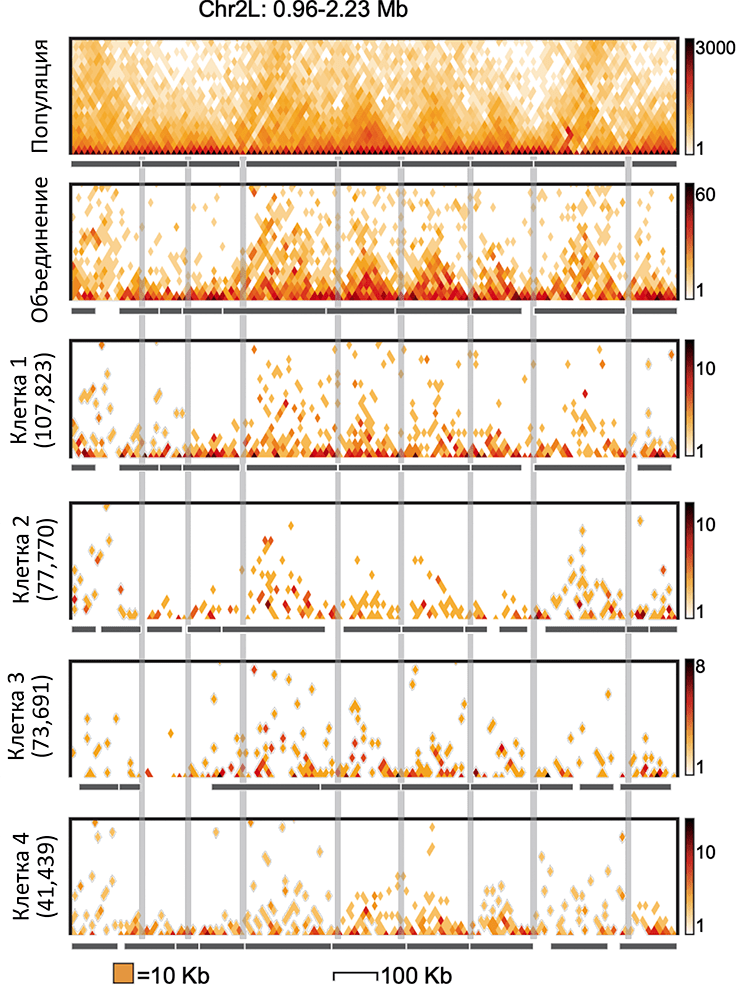
Теперь же мы применили Hi-C для одиночных клеток плодовой мушки дрозофилы [11]. Оказалось, что хроматин и этого организма в каждой отдельно взятой клетке сформирован из топологически ассоциированных доменов (ТАДов), однако структуры эти гораздо более упорядочены, чем у млекопитающих (рис. 4).
Рисунок 4. Сравнение результатов «популяционного» и «одноклеточного» Hi-C. Регион генома на традиционном популяционном Hi-C (верхняя панель), в объединении контактов 20 клеток (вторая панель) и в нескольких индивидуальных клетках дрозофилы. ТАДы видны как увеличенное количество контактов на участке («треугольники»). Положение ТАДов в индивидуальных клетках часто совпадает, а значит, что ТАДы — это довольно стабильные структурные единицы хроматина дрозофилы.
Конечно, совпадение позиций ТАДов может оказаться случайным, без какой-либо биологической причины. В данном случае с помощью моделирования и статистических тестов мы доказали, что относительно консервативные в разных клетках позиции ТАДов дрозофилы действительно являются следствием какого-то биологического механизма.
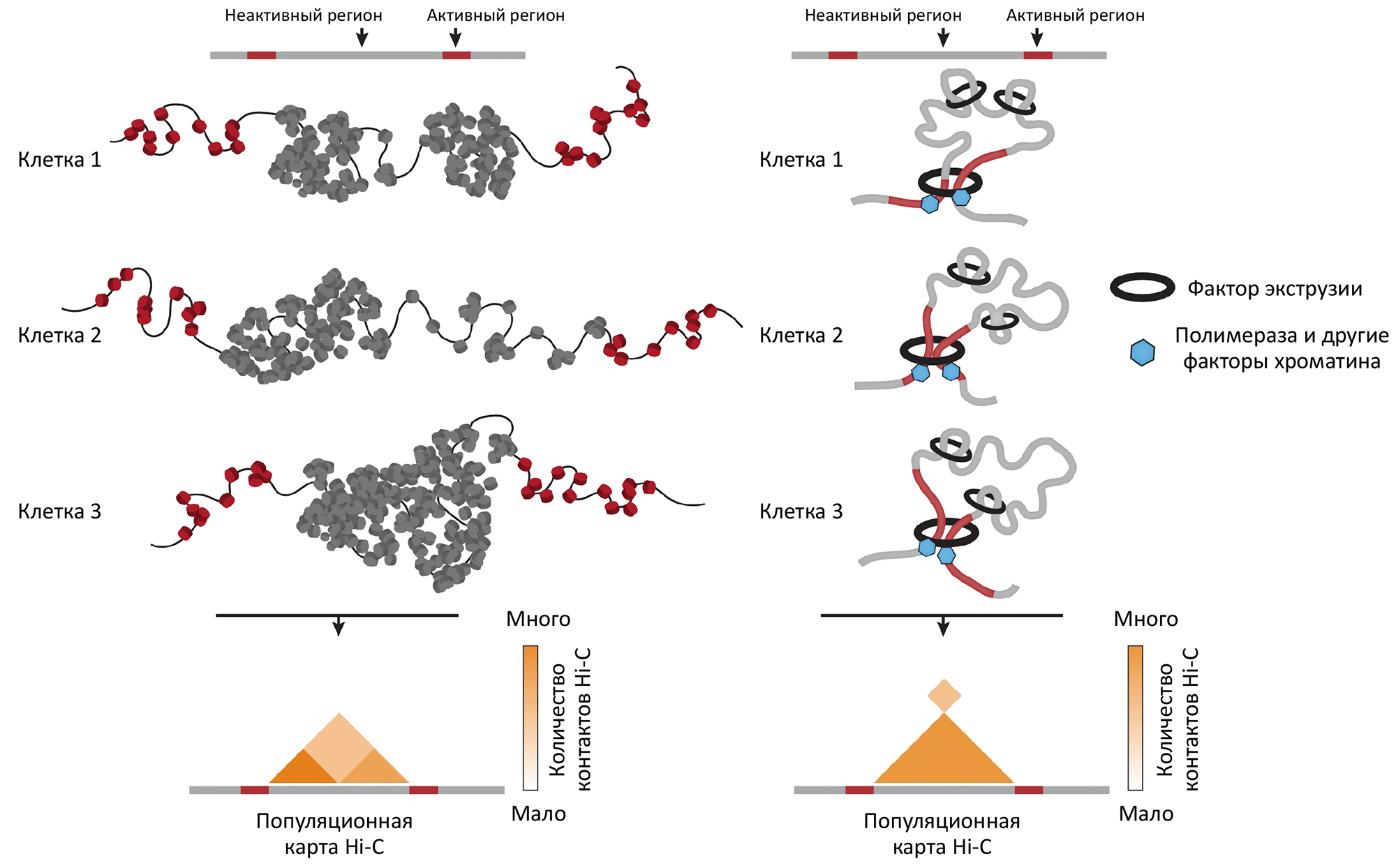
Каким может быть этот механизм? На наш взгляд, возможны как минимум два сценария (рис. 5). Хроматин дрозофилы может обладать особенными свойствами липкости, которые приводят к образованию стабильных конгломератов ДНК. Альтернативное объяснение — механизм выпетливания ДНК с помощью специальных факторов экструзии, которые останавливаются на участках ДНК, где располагаются активные гены. Обе эти гипотезы согласуются с тем, что известно о хроматине эукариот, однако для проверки этих гипотез требуются более детальные исследования (и, возможно, с помощью других методов).
Рисунок 5. Гипотезы формирования стабильных доменов в хроматине дрозофилы
Многолетняя коллаборация
Все эти исследования выполнялись в многолетней коллаборации, объединившей усилия ученых из Сколтеха, Института биологии гена РАН и МГУ им. М.В. Ломоносова, Национального центра научных исследований Франции, российско-французского Центра Понселе и нескольких других организаций.
Каждый из участников взял на себя отдельную важную роль, без которой проект не смог бы состояться. Так, Сергей Ульянов и Влада Захарова провели отработку экспериментальной техники. Моя роль заключалась в разработке вычислительных подходов и интерпретации данных. Павел Кос создал метод моделирования структуры хроматина единичных клеток дрозофилы. Кирилл Половников показал, что данные действительно отличаются от шума. Часть экспериментов провел наш давний коллаборатор Илья Флямер, который ранее применял подобную технику для исследования структуры хроматина ооцитов и зигот мыши [9], [10].
Похожий подход можно масштабировать и исследовать с его помощью разнообразие архитектур хроматина одиночных клеток, тканей и даже целых организмов. А пока что нам удалось зафиксировать неуловимую архитектуру хроматина клеток плодовой мушки и сформулировать гипотезы об упаковке ДНК этого организма. Подробности можно прочитать в журнале Nature Communications, где недавно вышла публикация о работе [12].
Работа поддержана грантами РФФИ №19-34-90136 и РНФ №19-14-00016.