Для чего нужен капсид вируса
Капсид ВИЧ

На рисунке изображены два варианта структуры капсида вируса иммунодефицита человека (ВИЧ), определенные экспериментально с помощью комбинации различных методов: рентгеноструктурного анализа, электронной микроскопии, криоэлектронной томографии и компьютерного моделирования. Капсид — это белковый «контейнер», внутри которого находится геном вируса. Капсид ВИЧ имеет длину около 90 нм и ширину около 50 нм и состоит из множества (более тысячи) одинаковых молекул белка, известного как белок CA или p24.
Cначала молекулы белка СA собираются в группы по шесть штук и образуют гексамеры — симметричные шестиугольные структуры. Затем гексамеры стыкуются друг с другом подобно шестиугольной плитке. Также молекулы белка СА могут собираться по пять штук в пентамеры — симметричные пятиугольники. Эти пятиугольники (выделенные на рисунке фиолетовым цветом) стыкуются с шестиугольниками (голубого цвета), создавая фрагменты с меньшим радиусом кривизны и позволяя капсиду «закруглиться» и замкнуться. Поэтому структуры капсида ВИЧ часто сравнивают со структурой фуллеренов — углеродных наночастиц в форме замкнутых многогранников, которые также состоят из пяти- и шестиугольных граней.
Вариант капсида, изображенный справа, состоит из 186 гексамеров и 12 пентамеров. Вариант, изображенный слева, включает 216 гексамеров и 12 пентамеров — это самая большая биомолекулярная структура, когда-либо определенная экспериментально и загруженная в базу данных Protein Data Bank: он имеет молекулярную массу 34 853 кДа (35 миллионов единиц молекулярной массы!) и состоит из 1356 (216*6 + 12*5 = 1356) одинаковых белковых цепей.
Вирус иммунодефицита человека вряд ли нуждается в особом представлении. В настоящий момент 38 миллионов человек по всему миру живет с ВИЧ; в 2019 году было зарегистрировано 1,7 миллиона новых случаев инфицирования, и 690 тысяч человек умерли от причин, связанных с ВИЧ-инфекцией. Несмотря на то что современная антиретровирусная терапия помогает избежать осложнений, позволяет пациенту дожить до старости и делает инфицированного человека незаразным для окружающих, инфекция ВИЧ продолжает оставаться одной из крупнейших проблем здравоохранения. Все существующие препараты против ВИЧ различными способами подавляют размножение вируса, но никак не могут повлиять на те клетки, в чью ДНК вирусный геном уже встроился. Поэтому, если прекратить принимать лекарства, вирус «воскресает» и снова начинает разрушать иммунную систему.
Вирус иммунодефицита человека относится к подтипу оболочечных вирусов, то есть его капсид заключен в дополнительную липидную оболочку, состоящую из фрагментов мембраны клетки-хозяина (см. Вирусная оболочка). Таким образом вирус прячется от иммунной системы: благодаря наличию оболочки поверхность вируса становится похожа на поверхность обычной клетки. Главный же недостаток липидной оболочки состоит в том, что она гораздо более чувствительна к изменениям внешней среды, чем жесткий белковый капсид безоболочечных вирусов, поэтому оболочечные вирусы (в том числе и ВИЧ) гораздо быстрее разрушаются при высыхании, перепаде температур и воздействии дезинфицирующих средств.
Жизненный цикл вируса хорошо показан в анимированном видео:
На нем видно, как при инфицировании новой клетки липидная оболочка вируса сливается с мембраной клетки-хозяина, высвобождая во внутриклеточное пространство содержащийся внутри нее капсид с геномом. Капсид ВИЧ не только защищает заключенный в нем генетический материал и вирусные белки, но и взаимодействует с некоторыми белками клетки-хозяина, обеспечивая перемещение вирусных частиц внутри клетки вдоль микротрубочек и их транспортировку внутрь клеточного ядра, где вирусный геном встраивается в геном клетки-хозяина.

A — строение вириона ВИЧ. Геном, представляющий собой две копии одноцепочечной РНК, заключен внутрь капсида, а капсид, в свою очередь, заключен в липидную оболочку (также называемую суперкапсид). На оболочке находятся гликопротеиновые шипы, необходимые для распознавания клетки-хозяина и проникновения вируса внутрь клетки. Внутри капсида, помимо геномной РНК, находятся также белки, необходимые для жизнедеятельности вируса, в частности обратная транскриптаза, синтезирующая ДНК на основе вирусной РНК, и интеграза, встраивающая получившуюся ДНК в геном клетки-хозяина. Более подробно рассмотреть структуру вириона и узнать про функции его компонентов можно в замечательной интерактивной модели RCSB Protein Data Bank. Рисунок с сайта en.wikipedia.org. B — фотография вирионов ВИЧ, сделанная с помощью трансмиссионного электронного микроскопа. Вирионы заключены в сферическую оболочку, внутри которой видны капсиды конической формы. Фото © Maureen Metcalfe, Tom Hodge с сайта phil.cdc.gov
Вирусы сильно отличаются друг от друга по размеру (от 10 до 500 нм), форме и наличию дополнительной внешней оболочки. Капсиды вирусов бывают разной формы, но чаще всего встречается икосаэдрическая (в виде симметричного многогранника) как, например, у аденовирусов и герпесвирусов, и спиралевидная, как у вируса Эбола или коронавируса SARS-CoV, где множество одинаковых белковых молекул укладывается по спирали и образует длинную трубку вокруг цепи ДНК или РНК. У большинства вирусов, включая ВИЧ, капсид образован одним-единственным белком, что экономит место в вирусном геноме.

Схематичное изображение структур и сравнительных размеров вирусов, вызывающих заболевания человека. Зеленым цветом обозначен капсид, светло-голубым — оболочка (суперкапсид), сформированная из липидной мембраны клетки-хозяина, желтым — гликопротеиновые шипы, коричневым — белки матрикса (см. Viral matrix protein). Верхний ряд слева направо: вирус натуральной оспы, вирус герпеса, вирус бешенства, кори, ВИЧ-1, SARS-CoV. Нижний ряд слева направо: вирус Эбола, папилломавирус; вирус, вызывающий лихорадку Денге, и вирус Зика, вирусы гепатитов C, B и A, парвовирус. Рисунок с сайта Viral Zone SIB Swiss Institute of Bioinformatics viralzone.expasy.org
Первым этапом в изучении структуры капсида ВИЧ было решение структуры отдельной молекулы белка CA. Рекомбинантный белок нарастили в бактериальных клетках, очистили, получили его кристаллы и определили его структуру методом рентгеноструктурного анализа. Оказалось, что он состоит из двух доменов, N-концевого и С-концевого, соединенных между собой гибким линкером. Также методом рентгеноструктурного анализа была определена структура гексамеров и пентамеров. То, что один и тот же белок может образовывать и пентамеры, и гексамеры, объясняется гибкостью его молекулы. Вообще, такая ситуация, когда большой и не идеально симметричный капсид состоит всего лишь из одного вида белка, часто встречается в мире вирусов и возможна как раз благодаря тому, что молекулы белка капсида достаточно гибкие и могут принимать разные конформации.
Чтобы детально изучить то, как гексамеры стыкуются между собой, исследователи разработали экспериментальный метод, когда очищенные гексамеры in vitro соединяются между собой и образуют трубчатые структуры (в отсутствие пентамеров структура не может замкнуться). Полученные трубки были исследованы методом электронной микроскопии, и их структура была определена с высоким разрешением. Для того чтобы определить структуру целого капсида, у зрелых вирусных частиц ВИЧ разрушили внешнюю оболочку и исследовали очищенные от оболочки капсиды методом криоэлектронной томографии, когда с помощью электронного микроскопа делаются снимки образца под разными углами и на их основе определяют трехмерную структуру (по такому же принципу, только на макроскопическом уровне, работает компьютерная томография, широко применяемая в медицинской диагностике). Затем, на основании всех вышеперечисленных данных, методом компьютерного моделирования (методом молекулярной динамики) были построены две модели капсида ВИЧ, изображенные на главной картинке.
А — cтроение пентамера и гексамера белка СА. Структуры из базы данных Protein Data Bank визуализированы с помощью программы PyMOL. B — белок СА состоит из двух доменов, соединенных гибким линкером. Если сравнить конформации белка СА в составе пентамера и в составе гексамера, то видно, что домены по-разному расположены относительно друг друга, так как белок способен изгибаться и скручиваться. Если сравнить разные гексамеры в составе одной структуры, то их форма может слегка отличаться, опять же из-за гибкости белковых молекул
При сравнении большого количества вирусных частиц становится заметно, что капсиды неоднородны по форме. Они могут содержать разное число гексамеров (обычно от 170 до 220), но всегда включают 12 пентамеров, необходимых для образования замкнутой структуры. Поэтому структуры, показанные на главной картинке, — это лишь два из множества возможных вариантов формы капсидов, существующих в природе.
Разнообразие форм частиц ВИЧ. Длина масштабного отрезка — 100 нм. Фото из статьи J. A. G. Briggs et al., 2003. Structural organization of authentic, mature HIV-1 virions and cores
Изучение структуры капсида полезно не только для фундаментального понимания того, как функционирует вирус, но и для создания нового класса противовирусных препаратов. На данный момент существует восемь различных классов препаратов против ВИЧ (нуклеозидные и не-нуклеозидные ингибиторы обратной транскриптазы, ингибиторы вирусной протеазы, ингибиторы слияния и т.д.), отличающихся друг от друга тем, с каким белком они связываются и какой этап жизненного цикла вируса они блокируют. Но все они обладают одним существенным недостатком: вирус со временем вырабатывает к ним устойчивость и препараты перестают действовать. Вирус иммунодефицита человека уникален тем, что в его геноме очень часто, гораздо чаще, чем у других болезнетворных вирусов, происходят мутации. Через некоторое время в организме пациента может появиться форма вируса с мутацией, делающей его устойчивым к действию принимаемого препарата. Эта форма получает эксклюзивную способность размножаться и передает эту мутацию дочерним вирусным частицам. В результате количество жизнеспособного вируса в крови пациента (вирусная нагрузка) увеличивается, иммунная система снова начинает разрушаться, и приходится подбирать новую схему лечения с другими препаратами. Поэтому создание новых лекарств, к которым вирус пока не выработал устойчивость, остается важной и актуальной задачей.
На данный момент не зарегистрировано ни одного препарата, воздействующего на капсид ВИЧ, но работа в этом направлении ведется. Компания Gilead разработала соединение GS-6207 (препарат Lencapavir). Оно связывается с поверхностью капсида ВИЧ, с двумя субъединицами белка CA одновременно и, во-первых, стабилизирует капсид, не давая ему после попадания в клетку реорганизоваться и высвободить геномную РНК и вирусные белки. Во-вторых, GS-6207 блокирует связывание капсида с ядерными порами, поэтому вирусный геном не может попасть в клеточное ядро и встроиться в геном клетки-хозяина.

А — химическая формула GS-6207 (Lencapavir). Рисунок с сайта commons.wikimedia.org. B — структура препарата Lencapavir (розовый), связанного с гексамером белка СA (голубой). Структура (PDB ID 6VKV) из базы данных Protein Data Bank визуализирована с помощью программы PyMOL
На момент написания этого текста (май 2021 года) GS-6207 (Lencapavir) проходит клинические испытания фазы 2/3 среди пациентов с формами вируса, устойчивыми к другим препаратам. Судя по предварительным результатам, Lencapavir хорошо переносится и вызывает снижение вирусной нагрузки у большинства пациентов. Большим его плюсом является то, что для эффективной борьбы с вирусом достаточно делать инъекции раз в полгода, в этом плане он гораздо удобнее большинства других антиретровирусных препаратов, которые нужно принимать каждый день. Возможно, его удастся применять не только для терапии ВИЧ-инфекции, но и для предотвращения заражения; клинические испытания по профилактике заражения в группах риска планируются в ближайшем будущем. Теоретически, и к Lencapavir’у вирус может со временем выработать устойчивость (хотя у пациентов, участвующих в клинических испытаниях, этого пока не произошло), но знания о его структуре и механизме действия помогут создать на его основе препараты следующего поколения, продолжив гонку, в которой медицинские химики соревнуются с эволюцией.
Рисунок Екатерины Кузиной, структуры из базы данных Protein Data Bank визуализированы с помощью программы PyMOL.
Капсид
Из Википедии — свободной энциклопедии
Капси́д — внутренняя оболочка вируса, состоящая из белков. Структурной субъединицей капсида является капсомер. Капсид выполняет несколько функций:
В заражённой клетке вирус рано или поздно начинает размножаться, используя инфраструктуру клетки. Белки, составляющие капсид, синтезируются на основе генетического материала вируса. Некоторые типы вирусов, покидая заражённую клетку, отхватывают часть билипидного слоя клеточной мембраны или мембраны некоторых органелл и «закутываются» в них, создавая тем самым дополнительный уровень защиты. Данная дополнительная оболочка вируса носит название суперкапсид.
Капсиды большинства вирусов имеют спиральную или икосаэдрическую симметрию. В случае спиральной симметрии (например, у вируса табачной мозаики) составные части капсида формируют цилиндр из уложенных по спирали белковых глобул, внутри которого находится генетический материал вируса. В случае икосаэдрической симметрии (например, у многих бактериофагов) образуется квази-сферическая структура капсида. В случае «закутанного» капсида отдельные части капсида (спирального или икосаэдрического) открыты окружающей среде, в то время как большая часть его скрыта мембраной.
Классификации вирусов (для определения семейства вирусов) осуществляется на основе структурного анализ основных типов структурных белков, входящих в состав капсида. Так, по результатам структурного анализа капсида в одно семейство были помещены бактериофаг PRD1, вирус хлорелл, обитающих в Paramecium bursaria, и аденовирус млекопитающих.
Что мы знаем о вирусах и методах защиты от них?
Что такое вирус?
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
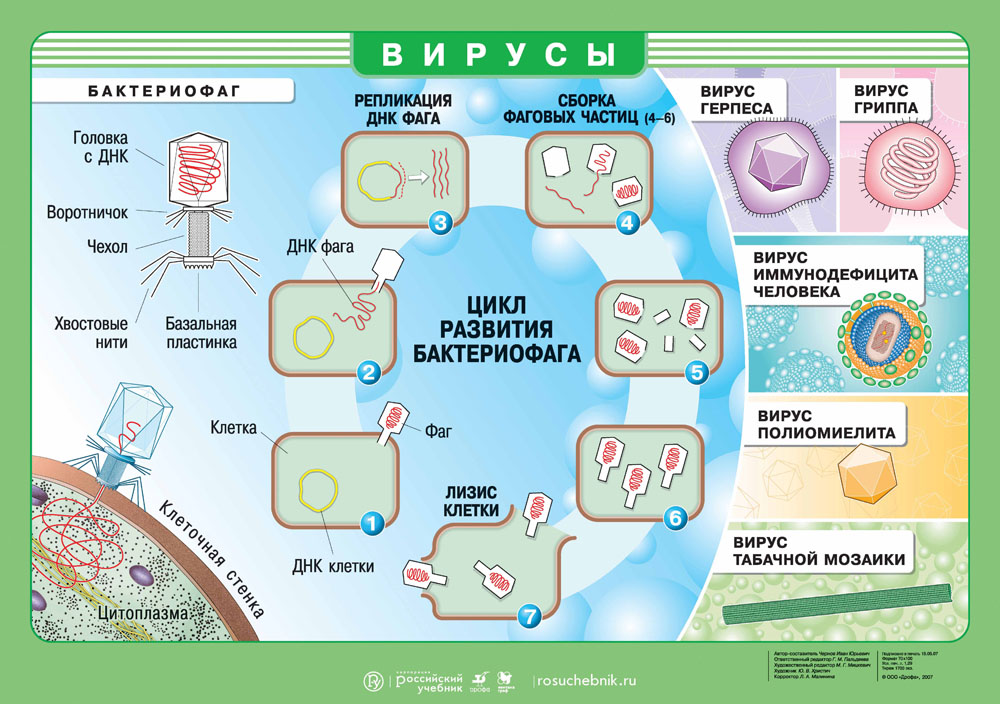
Вирусы. Цикл развития бактериофага. Скачать наглядное пособие в большом разрешении можно здесь.
Как вирус попадает в организм?
Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
«Для проникновения в клетку белки поверхности вируса связываются со специфическими поверхностными белками клетки. Прикрепление, или адсорбция, происходит между вирусной частицей и клеточной мембраной. В мембране образуется дырка, и вирусная частица или только генетический материал попадают внутрь клетки, где будет происходить размножение вируса. Сегодня ученые всего мира сделали важное открытие о том, что заражение коронавирусом людей преклонного возраста объясняется тем, что у пожилых людей накапливается специфический белок, который помогает COVID-19 проникать внутрь клетки эпителия».
Выход вируса
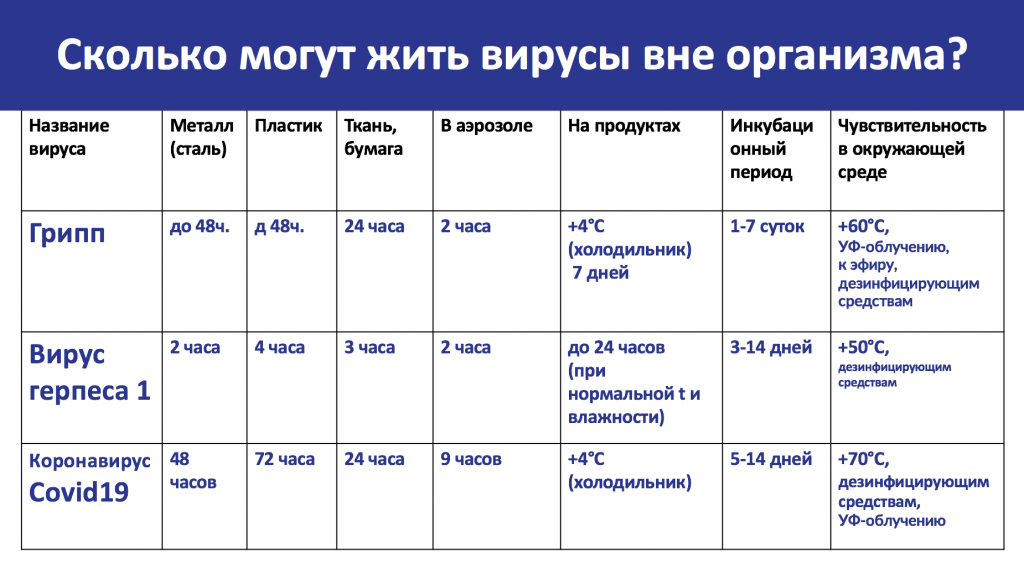
Скорость распространения вирусной инфекции
Вирусная латентность
Как вирус распространяется?
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
«Мы пытались рассказать Вам не только о существующих научных фактах о вирусах, но и показать, что определенные знания помогают нам в нынешней практической ситуации сохранить свое здоровье и здоровье своих близких. Мы понимаем, что сегодня коронавирус может находиться практически везде: на поверхностях любых предметов, в окружающей среде и т.д. Поэтому самоизоляция – это один из важнейших способов защиты от инфекции. Находясь дома, вы защищаете не только свое здоровье, но и помогаете медикам и ученым, которые сражаются с этим вирусов и день и ночь. Ведь, чем меньше шансов у нас с вами заболеть, тем больше шансов появляется у них, чтобы победить коронавирус. Пожалуйста, оставайтесь дома и соблюдайте режим самоизоляции и нормы гигиены».
Крохотные курьеры: как аденоассоциированные вирусы спасают жизни
Крохотные курьеры: как аденоассоциированные вирусы спасают жизни
Авторы
Редакторы
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
Эта история началась в середине 1960-х, когда в препаратах аденовируса обезьян случайно было обнаружено загрязнение из маленьких неизвестных частиц [1]. Эти частицы были впоследствии названы аденоассоциированным вирусом (сокращенно ААВ, англ. adeno-associated virus, AAV). Тогда мало кто мог предположить, что именно эти крошечные вирусы дадут надежду многим неизлечимым больным. И лишь несколько исследовательских групп, движимых чисто научным любопытством, отправились изучать базовую биологию ААВ.
Прошло несколько десятков лет, и стало понятно, что ААВ обладает множеством уникальных свойств. Эти особенности позволяют использовать его в поистине революционном направлении — генной терапии. По разным оценкам, около 5% новорожденных детей страдает от различных генетических заболеваний [2]. Долгие годы такие болезни считались неизлечимыми, и для многих подобный диагноз приравнивался к приговору. К счастью, времена изменились. Мы находимся на пороге эры лекарств принципиально нового типа [3], и немаловажную роль в этом сыграл аденоассоциированный вирус [4].
Биология вируса
Какими же уникальными особенностями обладает ААВ? Чтобы ответить на этот вопрос, нужно подробнее поговорить про его жизненный цикл и строение.
Аденоассоциированный вирус принадлежит к роду Dependoparvovirus семейства Parvoviridae. Название рода отражает его необычный жизненный цикл, когда для размножения необходимо наличие вспомогательного вируса (от лат. Dependo — «зависеть»). В качестве такого вируса-помощника, как правило, выступает аденовирус (что явно следует из названия) или представители семейства герпесвирусов [5].
ААВ настолько безобиден, что помимо неспособности самостоятельно размножаться, он не вызывает никаких заболеваний человека и животных. Более того, согласно некоторым исследованиям, большинство людей (>70%) в течение жизни были заражены одним или несколькими серотипами ААВ [6]. (Серотип — вариант вируса, который отличается от других антигенами на своей белковой оболочке).
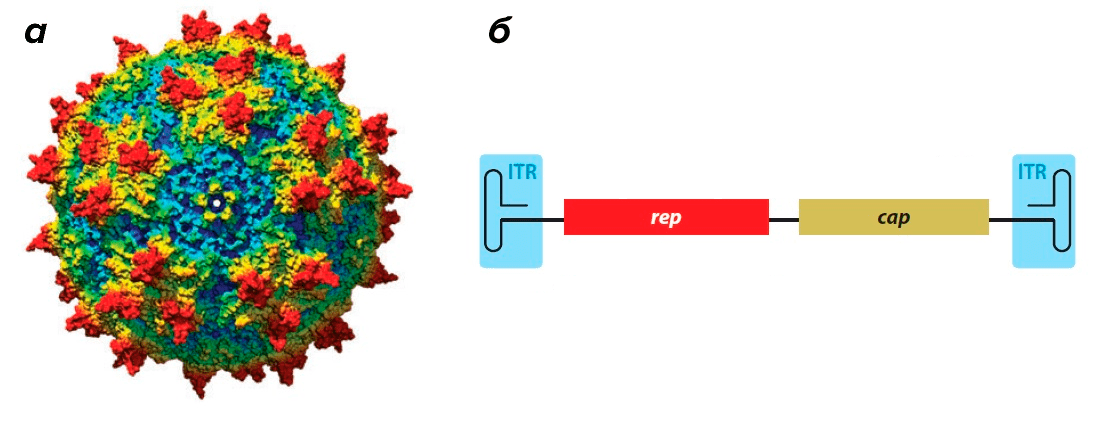
Вирус довольно мал — его икосаэдрическая белковая оболочка (капсид) в диаметре составляет всего около 25 нм (риc. 1а). Капсид необычайно стабилен: устойчив к кратковременному воздействию тепла, кислой среде и протеазам [7]. Геном, представленный одноцепочечной ДНК, по размерам также весьма скромен — всего 4,7 тысяч нуклеотидов [7].
Этот небольшой геном содержит минимальное количество генов. Ген rep (от слова replication) кодирует белки, необходимые для размножения вируса и его дальнейшей сборки внутри клетки (рис. 1б). Ген cap (от слова capsid) кодирует белки капсида (рис. 1б).
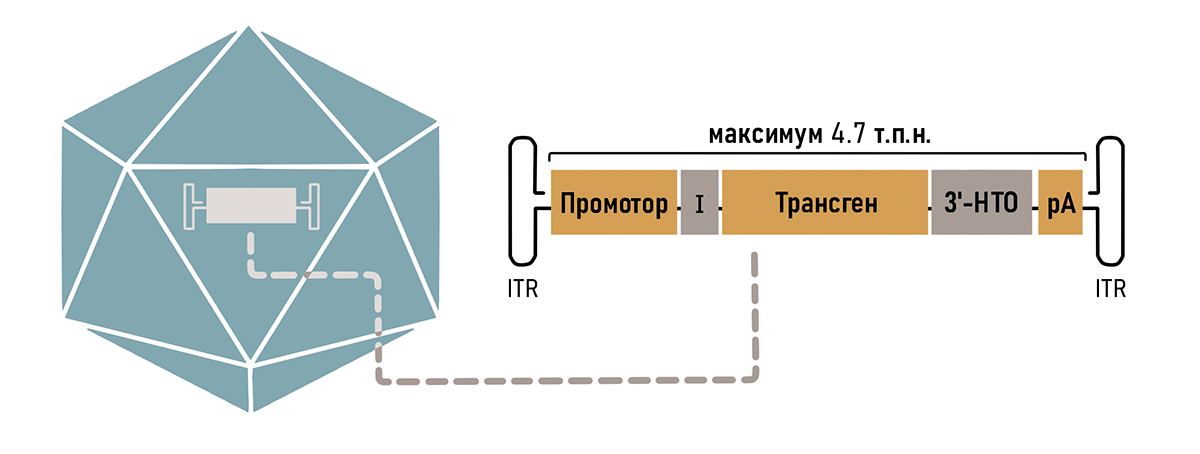
Геном ААВ обрамлен двумя Т-образными шпильками — инвертированными концевыми повторами (inverted terminal repeats, ITR) (рис. 1б).
Рисунок 1. Аденоассоциированный вирус. а — Модель капсида ААВ. б — Геном аденоассоциированного вируса. ITR (inverted terminal repeats) — инвертированные концевые повторы, образующие Т-образные шпильки; rep — ген, кодирующий белки, отвечающие за репликацию; cap — ген, кодирующий белки капсида.
Судьба вируса в клетке
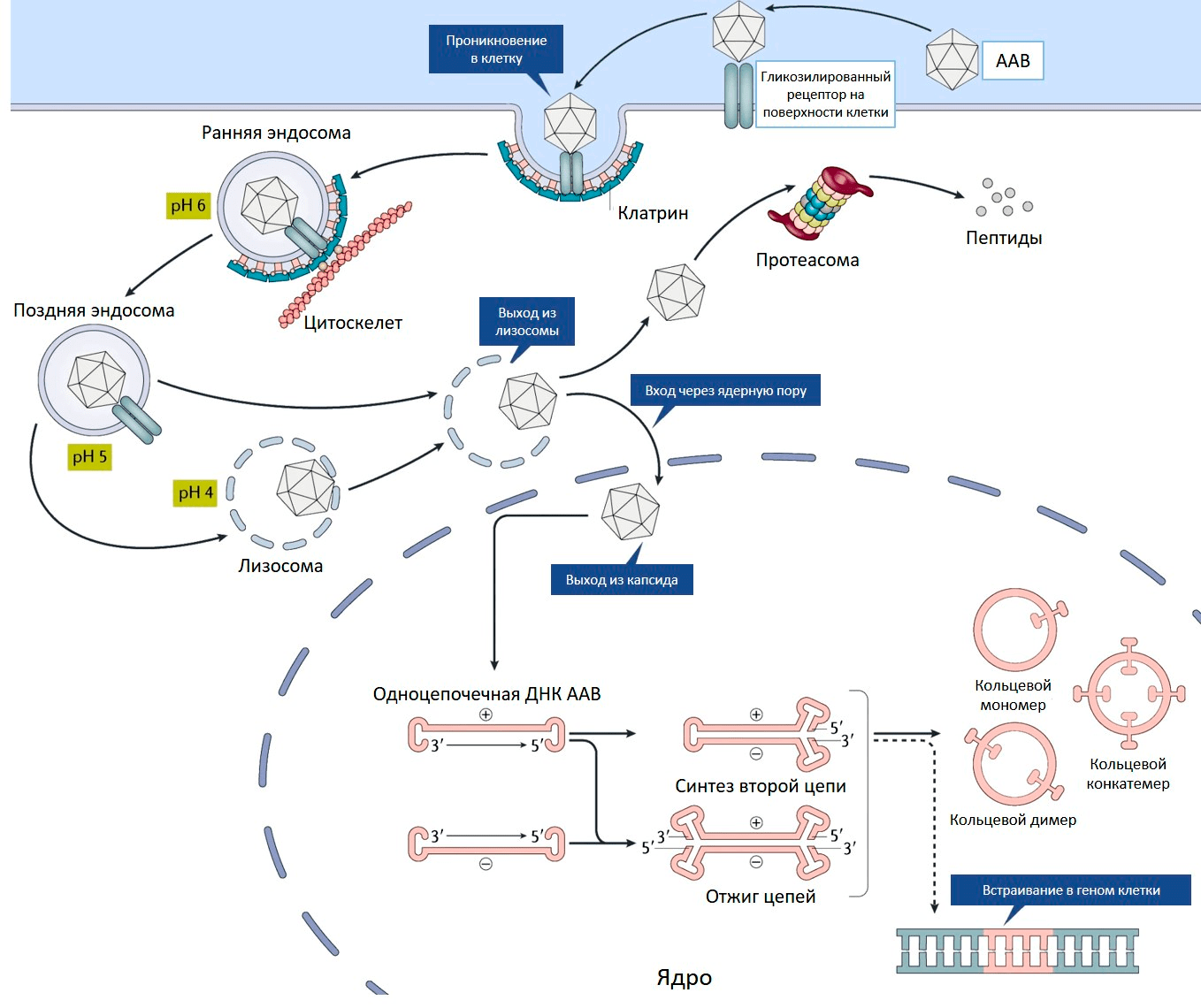
Ценное свойство ААВ — его способность проникать как в делящиеся, так и неделящиеся клетки [8]. На первом этапе аденоассоциированный вирус связывается с рецептором на поверхности клетки (рис. 2) [9]. Разные серотипы ААВ предпочтительно связываются со своими рецепторами, характерными для определенных типов клеток [10].
Рисунок 2. Проникновение ААВ внутрь клетки. Пояснения в тексте.
[9], рисунок с изменениями
И это важное свойство — определенный серотип преимущественно проникает лишь в конкретную ткань или орган, то есть обладает своим уникальным тропизмом.
Связывание вируса с рецептором запускает процесс проникновения внутрь клетки. Эндосома (мембранный пузырек, содержащий вирусную частицу) передвигается в цитоплазме по цитоскелету. Постепенно среда в эндосоме закисляется, что приводит к изменениям капсида, необходимым для дальнейшего успешного заражения клетки. После выхода из эндосомы у вируса два пути. Либо он попадает в клеточную машину по уничтожению белков (протеасому) и разрушается, либо переносится в ядро, где вирусный геном высвобождается из капсида (рис. 2) [10].
С одноцепочечного вирусного генома еще не могут нарабатываться белки, для этого необходимо достроить вторую цепь ДНК. Она синтезируется с помощью ДНК-полимеразы клетки-хозяина, используя шпильку ITR в качестве затравки для построения второй цепи.
Вирусные ITR помогают не только строить вторую цепь ДНК, но способствуют межмолекулярной и внутримолекулярной рекомбинации геномов вируса. В результате в ядре клетки образуются кольцевые молекулы ДНК — эписомы (рис. 2). В такой форме геномы ААВ могут в течение многих лет присутствовать в ядре [10].
Кроме того, геном ААВ может с низкой частотой встраиваться в определенный локус на 19 хромосоме человека [11]. Этот феномен обусловлен сходством последовательностей ДНК данного локуса и ITR вируса. У ААВ, лишенного гена rep, способность к встраиванию своего генома сильно снижена. Такие вирусные геномы присутствуют в клетках в виде эписом.
Модификация ААВ для применения в генной терапии
Если в гене человека произошла мутация, которая привела к развитию заболевания, то болезнь можно победить или облегчить, если доставить в клетки организма рабочую копию поломанного гена. Вот тут и выходит на сцену аденоассоциированный вирус.
Что же нужно было в нем изменить, чтобы он стал курьером для доставки таких терапевтических генов? Как это часто бывает в биологии, ученые просто воспользовались успешными решениями, уже созданными природой. Раз капсид ААВ сам по себе является ключом к входу в клетку и ядро, то можно смело этим воспользоваться. Остается только заменить гены самого вируса на гены, интересующие исследователя, и вирусный курьер готов!
Модификация генома ААВ
Оказалось, что от всего генома ААВ необходимо было оставить только концевые шпильки ITR, необходимые для сборки самого вируса и сохранения его генома в ядре (рис. 3) [12]. Таким образом, можно без последствий удалить до 96% генома ААВ, используя полученное пространство для кодирования нужных генов.
Так как ААВ вмещает в себя всего около 5000 пар нуклеотидов, то нужно очень тщательно продумать остальной состав кассеты. В первую очередь туда необходимо поместить рабочую копию гена (трансген), в зависимости от того генетического заболевания, на которое направлено лечение. Также обязательно наличие регуляторных последовательностей, таких как промотор и сигнал полиаденилирования (рис. 3). Разберем элементы кассеты подробнее.
Рисунок 3. Компоненты типичной кассеты ААВ вектора. Оранжевые блоки (промотор, трансген и сигнал полиаденилирования — рА) являются обязательными компонентами. Для повышения эффективности экспрессии могут быть включены необязательные регуляторные элементы, такие как интрон (I) и другие компоненты 3′-нетранслируемой области (НТО). Кассета обрамлена инвертированными терминальными повторами (ITR).
рисунок авторов статьи
Из-за ограниченной емкости вируса могут возникнуть трудности с доставкой больших терапевтических генов. Очевидное решение проблемы — разработка сокращенной версии гена, который кодирует усеченный, но функциональный белок. Создание таких укороченных генов требует глубокого понимания биологии терапевтического белка, взаимосвязи его структуры и функции. Такой подход уже успешно применяется в нескольких клинических испытаниях по лечению миодистрофии Дюшенна [13] (ссылки на клинические испытания: NCT03368742, NCT04281485, NCT03769116), в доклинических исследованиях по лечению дисферлинопатии, амавроза Лебера и многих других заболеваний.
Другим потенциально перспективным подходом для доставки слишком больших трансгенов может быть разделение гена между двумя ААВ-векторами [14]. Два этих векторных генома, попадая в одно и то же ядро клетки, могут подвергаться межмолекулярной рекомбинации с последующим восстановлением полноразмерного гена. Такой двухвекторный подход пока применяется лишь в редких клинических испытаниях (пример — NCT02710500). Низкая эффективность восстановления полноразмерного гена ограничивает более широкое применение этого приема.
Правильно выбранный промотор — во многом залог успешной генной терапии. Идеальный промотор должен запускать стабильную высокую экспрессию трансгена в пораженных органах в течение длительного периода, при этом быть неактивным в других тканях. Малая емкость ААВ также требует уменьшения размера промотора [15].
К кассету можно добавить необязательные элементы, способные улучшить экспрессию трансгена (рис. 3). Так, например, присутствие интрона повышает стабильность РНК в ядре [16], а также способствует эффективному транспорту мРНК из ядра в цитоплазму [17].
К обеспечению тканеспецифичности можно подойти с другой стороны — не только стимулируя экспрессию в целевых тканях, но и подавляя ее в нежелательных органах с помощью механизмов РНК-интерференции [18]. Для этого в 3′-НТО-кассеты добавляют сайты связывания микроРНК, присутствующих строго в нецелевых органах (рис. 3) [19]. Если трансген оказывается в нежелательном органе, то микроРНК связывается с комплементарными ей сайтами в транскрипте и запускает его деградацию.
Модификация капсида ААВ
Хотя капсид ААВ — сам по себе уже удачное изобретение природы, человечество не остановилось в своем научном поиске. Новые серотипы ААВ могут обладать рядом преимуществ:
Благодаря развитию новых методов анализа выделяют несколько основных направлений для создания или выявления новых серотипов.
К сожалению, всегда существует вероятность, что хорошо работающий in vitro модифицированный капсид в экспериментах на лабораторных животных продемонстрирует низкую эффективность или даже токсичность. Всестороннее изучение свойств разрабатываемых препаратов и строгий контроль качества призваны минимизировать риск неблагоприятного исхода исследований [23].
Применение ААВ в клинике
Целевые органы, на которые направлена терапия
К 14 декабря 2020 года 227 препаратов на основе ААВ проходят клинические испытания (по данным сайта ClinicalTrials.gov). Сегодня уже существует несколько препаратов на основе ААВ, которые получили одобрение от регулирующих органов для коммерческого использования у пациентов (подробнее про эти препараты можно почитать в [4]):
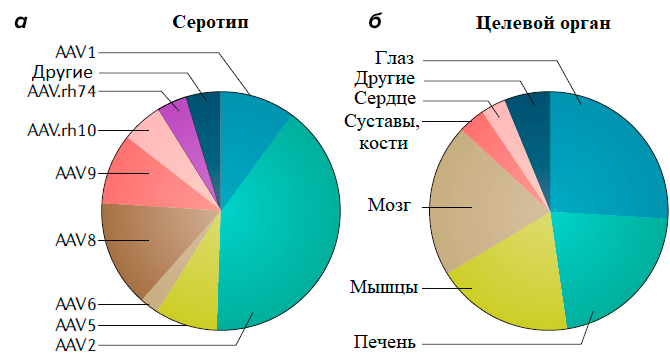
Большинство серотипов ААВ «предпочитают» проникать в такие органы, как печень, поперечно-полосатые мышцы и ЦНС, что и определило направление большинства программ генной терапии (рис. 4).
Рисунок 4. Данные с сайта ClinicalTrials.gov: на 13 ноября 2018 г. было зарегистрировано 145 клинических испытаний с использованием ААВ. а — Классифицикация клинических испытаний на основе примененного серотипа ААВ (AAV). б — Целевой орган, на который направлена терапия в указанных клинических испытаниях. Можно заметить, что спустя два года количество клинических испытаний с применением ААВ почти удвоилось (227 на сегодняшний день против 145 испытаний два года назад).
Почти все природные серотипы ААВ эффективно заражают печень после внутривенного введения. Благодаря данному свойству вируса в клинических испытаниях находятся препараты для лечения гемофилии A и B (NCT03392974, NCT03587116), семейной гиперхолестеринемии (NCT02651675), дефицита орнитинтранскарбамилазы (NCT02991144), мукополисахаридоза-IIIA (NCT03612869) и синдрома Криглера—Найяра (NCT03223194) [25].
Серотипы ААВ8 и ААВ9 могут эффективно заражать разные типы мышц по всему телу. Такое свойство делает их идеальными векторами для генной терапии множества мышечных заболеваний [26]. Так, активно исследуются в клинике препараты для лечения миодистрофии Дюшенна (NCT03375164), дисферлинопатии (NCT02710500), миотубулярной миопатии (NCT03199469), болезни Помпе (NCT03533673). Примечательно, что зараженная мышца может также служить биофабрикой для производства секретирующихся терапевтических белков для лечения немышечных заболеваний. Хотя большинство сердечных заболеваний полигенны и подвержены влиянию окружающей среды, ведется разработка препаратов генной терапии для лечения сердечной недостаточности [26].
Большой процент разрабатываемых препаратов на основе ААВ направлен на лечение неврологических и глазных болезней (рис. 4) [27], [28]. Глаз — весьма обособленный орган, обладающий уникальной иммунологической толерантностью, и легко доступный для прямого введения препарата. Нетрудно понять, почему один из первых одобренных препаратов, «Люкстурна», был направлен именно на лечение наследственной слепоты. Мозг, напротив, намного более крупный и сложно организованный орган. Прямая доставка препарата в мозг или спинномозговую жидкость позволяет локализовать вирус и снизить дозу препарата, но это инвазивная процедура, сопряженная со многими рисками. К счастью, такие серотипы, как ААВ9 или ААВrh.10, могут пересекать гематоэнцефалический барьер, что позволяет использовать рутинное внутривенное введение. В настоящий момент в клинических испытаниях уже находятся препараты для лечения болезни Паркинсона (NCT02418598), метахроматической лейкодистрофии (NCT01801709), болезни Баттена (NCT01414985), мукополисахаридоза 3 типа (NCT03300453).
Основные стратегии генной терапии на основе рААВ
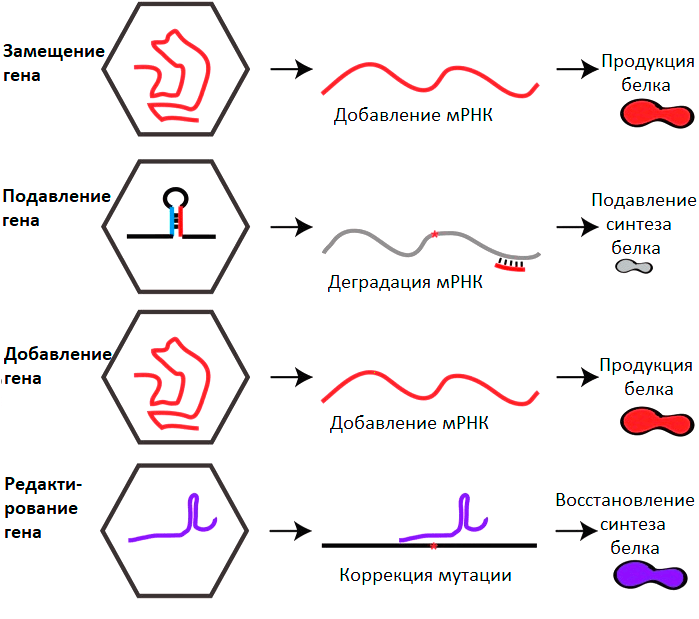
Можно выделить 4 глобальных направления генной терапии с применением ААВ (рис. 5).
Рисунок 5. Основные стратегии генной терапии на основе ААВ. Пояснения в тексте.
[29], рисунок с изменениями
Производство ААВ
Когда речь идет о клинических испытаниях, требуется очень большое количество вирусного препарата высокого качества. Его производство — весьма нетривиальная задача.
Вирусы не могут самостоятельно себя воспроизводить, им необходима помощь клеточной машинерии. Для наработки ААВ стали использовать культуры клеток. Вариантов может быть много: использование культуры дрожжей (Saccharomyces cerevisiae) [33], клеток насекомых (культура клеток Sf9 бабочки Spodoptera frugiperda) [34], человека — HEK293, HeLa. Некоторые из этих подходов, — скорее, экзотика, но использование культур клеток млекопитающих (HEK293) или насекомых (Sf9) уже прочно закрепилось на производстве.
Итак, для начала необходимо определиться с методикой производства, ведь от этого зависит, в чем будет расти сама культура. Вариантов масса: для клеток, растущих, прикрепившись к субстрату, это могут быть большие чашки Петри, специальные сосуды с множеством перегородок для увеличения площади поверхности (рис. 6а). Для культур, хорошо чувствующих себя в виде суспензии и при постоянном перемешивании, — колбы, герметичные пакеты и многое другое. При увеличении масштабов производства можно переходить на специальные биореакторы (рис. 6б). С их помощью можно следить за целой панелью важных для процесса параметров. Они делают производство более технологичным и позволяют увеличить объемы продукции до нескольких сотен литров вирус-содержащей суспензии за один цикл работы.
Рисунок 6. Производство ААВ: на культуральных чашках (а) и в биореакторе iCellis Nano (Pall corporation) (б)
фотографии авторов статьи
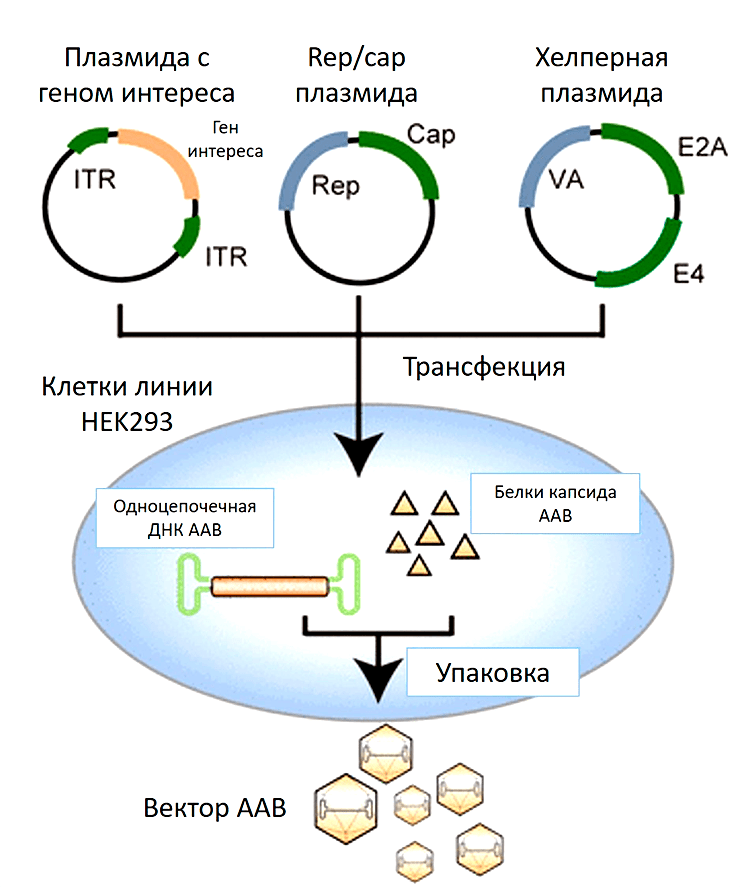
Что нужно сделать с культурой клеток, чтобы она стала биофабрикой по производству вирусных частиц? В такие клетки-производители вносят плазмидную ДНК, кодирующую необходимую для сборки вирусов информацию. Наиболее популярный протокол предполагает одновременное заражение клеток тремя плазмидами (рис. 7):
Кстати, вместо третьей плазмиды может быть добавлен сам вирус-помощник (аденовирус или герпесвирус), как это было в более ранних протоколах по производству частиц ААВ [35].
Рисунок 7. Производство ААВ, использующее в качестве клеток-производителей культуру клеток человека HEK293. Смесь трех плазмид доставляют внутрь клетки (плазмиду с терапевтическим геном, плазмиду, кодирующая гены rep/cap, и плазмиду с генами вируса помощника). Начинается наработка необходимых белков для сборки вирусных частиц. ДНК, содержащая терапевтический ген, упаковывается в готовый капсид ААВ.
Клетки начинают производить вирусные частицы, после чего их надо собрать и очистить.
Это критически важный этап, которому стоит уделить особое внимание [22], [23]. Любые примеси, которые будут содержаться в препарате, могут вызвать нежелательный иммунный ответ.
Вначале собирают сырой материал: это может быть клеточная среда, если вирусы выделяются клетками преимущественно в жидкость вокруг, а могут быть и сами клетки, если большинство вирусных частиц накапливается внутри. Как правило, это зависит от конкретного серотипа ААВ. Чтобы разрушить клеточные мембраны и высвободить вирус, клетки подвергают многочисленным циклам замораживания-оттаивания, ультразвуковой обработке или воздействию детергентов.
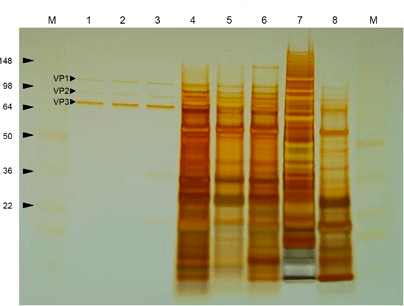
Теперь основная задача — очистить вирусные частицы от многочисленных примесей, находящихся в суспензии (рис. 8). В сыром материале находятся внутриклеточные свободные ДНК и РНК, белки и ферменты, крупные обломки клеточных мембран и многое другое. Способов очистки существует множество, и постоянно появляются как улучшенные версии уже применяемых методик, так и принципиально новые подходы. Все они различаются по уровням специфичности, эффективности и, разумеется, стоимости. Условно способы очистки можно разделить на серотип-специфичные и универсальные. К первой категории относится, например, аффинная хроматография [37], основанная на специфическом узнавании капсидов антителами. Ко второй — ультрацентрифугирование в градиентах плотности растворов йодиксанола или хлорида цезия, преципитация полиэтиленгликолем или сульфатом аммония, ионообменная хроматография и многие другие методы, основанные на общих физических свойствах вирусных частиц [38].
Рисунок 8. Окрашивание серебром очищенного (лунки 1–3) и загрязненного другими белками (лунки 4–8) препарата ААВ после гель-электрофореза [38].
Одна из неочевидных нежелательных примесей — так называемые пустые капсиды — вирусные частицы, не несущие в себе терапевтический ген, или содержащие внутри себя постороннюю ДНК. Дело в том, что изначально в клетке формируется пул пустых капсидов. Лишь потом ДНК связывается с пустым капсидом при помощи специальных сигналов на ITR и компактно упаковывается, формируя полноценную вирусную частицу. Но иногда пустой капсид может так и остаться пустым при нехватке вирусной ДНК или ее неэффективной упаковке. В пустой капсид может также упаковаться обрывок свободной ДНК, находящейся в клетке и содержащей последовательность, схожую с сигналом упаковки. Такие частицы (совсем пустые или несущие неправильную последовательность) не функциональны и подлежат удалению из очищаемого препарата. С определенной эффективностью их можно отделить от функциональных капсидов, используя градиенты плотности или методы хроматографии.
Основные проблемы
Наработка большого количества плазмид высокой степени очистки, поддержание культур клеток, дорогостоящие реактивы, сложный процесс очистки вирусных частиц и разработка аналитических методик для характеризации препаратов ведут к таким космическим ценам при масштабировании производства. На стоимость также влияет серьезный контроль качества вирусного препарата. Чтобы препарат вышел на рынок, проводятся исследования его токсичности, безопасности, биораспределения, эффективности. Оценивается содержание белковых примесей, бактериальных эндотоксинов, количество пустых капсидов, стерильность препарата, концентрация вирусных частиц в растворе и множество других характеристик [23]. В настоящий момент гиганты производств ААВ по всему миру работают над удешевлением препаратов, разрабатывая более эффективные протоколы сборки и очистки ААВ.
Иммунный ответ также представляет собой серьезную проблему. Потенциально иммунные реакции могут возникать на вирусный капсид, его геном, а также на белковый продукт трансгена. Препаратам на основе ААВ могут помешать нейтрализующие антитела к его капсиду [39]. Связываясь с вирусами в кровотоке, антитела препятствуют проникновению вирусных частиц в клетки, что ведет к низкой эффективности препарата. В настоящий момент обязательно проводится скрининг пациентов на наличие антител к применяемому серотипу ААВ [40]. В случае их обнаружения такой пациент исключается из клинических испытаний. Ведется разработка новых капсидов, которые не будут узнаваться нейтрализующими антителами [41]. После доставки терапевтических доз ААВ быстро развивается гуморальный иммунный ответ, который впоследствии помешает повторному введению препарата [42]. Именно поэтому большинство генотерапевтических препаратов на основе ААВ рассчитано на однократное введение. Для подавления Т-клеточного иммунного ответа у пациентов применяется фармакологическая супрессия стероидами [40].
Заключение
Генная терапия на основе ААВ — бурно развивающееся направление, и мы в данном обзоре затронули лишь небольшой кусочек этой удивительной области. Текущий экспоненциальный рост клинических испытаний с использованием ААВ предполагает, что мы находимся в самом начале эры новых генотерапевтических препаратов. Еще очень много задач предстоит решить, и для этого требуются мультидисциплинарные усилия. Дальнейшее развитие молекулярной биологии, биоинформатики, эпидемиологии, структурной биологии, иммунологии, геномики и других дисциплин, безусловно, будет способствовать совершенствованию технологии. Уже пройден длинный путь в попытке человечества победить генетические заболевания. Мы надеемся, что именно генная терапия приведет к окончательной победе!