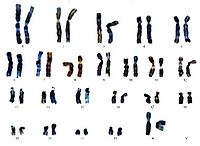Для чего нужен спутник в хромосоме
Научная электронная библиотека
Юров И. Ю., Ворсанова С. Г., Воинова В. Ю., Чурносов М. И., Юров Ю. Б.,
1.1. Хромосомы человека
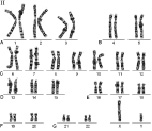
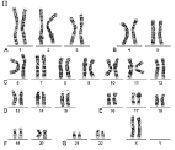
Хромосомный набор человека, определяемый как кариотип – совокупность данных о структуре, размерах и количестве митотических хромосом, – установлен в начале 60-х годов прошлого века. Ещё в 1888 году Г. Вальдеер (H. Waldeyer, 1836–1921 гг.) ввёл термин «хромосома» для обозначения окрашенных нитевидных структур, видимых в ходе стадий деления клетки (митоза). Характерные особенности строения каждой хромосомы человека определяются, как известно, положением в ней центромеры – важнейшей структуры, которая в делении клетки (митозе) соединяется с нитями веретена и определяет расхождение сестринских хроматид к противоположным полюсам клетки. Метафазная хромосома состоит из двух хроматид (сестринские хроматиды) и центромеры, при помощи которой они соединяются. В районе центромеры хромосома сужена, две её хроматиды сближены, и этот район в теле хромосомы образует первичную перетяжку. Центромера делит хромосому на два плеча (короткое и длинное). По положению центромеры и первичной перетяжки среди хромосом человека различают метацентрические хромосомы, у которых центромера расположена в середине хромосомы (медианно) и делит её на два равных по длине плеча; субметацентрические хромосомы, в которых центромера расположена субмедианно и делит хромосому на два плеча неравной длины; и акроцентрические хромосомы, у которых центромера расположена почти на конце хромосомы (терминально), отделяя от длинного очень короткое плечо. У некоторых хромосом на коротком плече двух хроматид на красящейся тонкой нити располагаются маленькие хроматические тельца – спутники. Участки на концах хромосомы называются теломерами. Структуры в виде точек прикрепления нитей митотического веретена к центромерам называются кинетохорами. Плечи некоторых хромосом содержат перетяжки, называемые «вторичными» (например, хромосомы 1, 9, 16). Диплоидный набор человека, состоящий из 46 хромосом, составлен из 23 пар гомологичных хромосом – гомологов (отцовского и материнского происхождения): 22 пары аутосом и плюс половые хромосомы (гоносомы) – ХХ у женщин или ХY у мужчин. Гомологичные хромосомы, как правило, сходны между собой в размерах и строении, хотя могут встречаться некоторые отклонения от каждого показателя, и это носит название «гетероморфизм хромосом». Термин «кариотип» рекомендуется применять к систематизированному набору хромосом отдельной клетки человека. Существует также термин «идиограмма», который сохраняется для представления кариотипа в виде схемы, построенной на основании измерений хромосом большого числа клеток. Хромосомы пронумерованы серийно от 1 до 22 в соответствии с их длиной, а также с другими особенностями их строения, допускающими идентификацию. Половые хромосомы (гоносомы) не имеют номеров и обозначаются как Х и Y. Следует отметить, что термины и «кариотип», и «идиограмма», получившие международное признание и распространение, принадлежат русским цитологам: «идиограмма» – С.Г. Навашину (1857–1930 гг.) в 1921 году и «кариотип» – Г.А. Левитскому (1878–1942 гг.) в 1924 году. В фазах деления – метафазах и прометафазах (см ниже) – хромосомы можно увидеть в световом микроскопе как дискретные удлинённые структуры длиной от 2 до 11 мкм. На рисунках 1 и 2 представлены мужской и женский кариотипы человека.
Рис. 1. Мужской кариотип: I – метафазная пластинка; II – классификация по группам и нумерация хромосом
Как указано выше, кариотип человека состоит из 46 хромосом, которые нумеруются от 1 до 22 (аутосомы) и делятся на 7 групп, – A, B, C, D, E, F, G и половые хромосомы (гоносомы) X и Y (рис. 1 и 2).
К первой группе А относятся хромосомы 1, 2 и 3, которые хорошо отличаются друг от друга. Хромосома 1 (размер – 11 мкм) – метацентрическая, содержит вторичную перетяжку в околоцентромерном участке длинного плеча. Хромосома 2 (10,8 мкм) по размерам почти равна хромосоме 1 и является субметацентрической. Хромосома 3 (размер – 8,3 мкм) – практически метацентрическая.
Рис. 2. Женский кариотип: I – метафазная пластинка; II – классификация по группам и нумерация хромосом
К группе В относятся хромосомы 4 и 5 (размер – 7,7 мкм каждая) – это крупные субметацентрические хромосомы, которые не отличаются друг от друга при рутинном окрашивании ни размером, ни положением центромер.
К группе С относятся хромосомы с 6 по 12 и Х. В основном, это субметацентрические хромосомы крупных и средних размеров. Наиболее крупные хромосомы из группы С – 6, 7 и Х (6,8–7,2 мкм). Хромосома Х является половой хромосомой (гоносомой). Хромосома 7 более метацентрична, чем хромосома 6. Хромосомы 8 и 9 – практически одинаковы по размеру (5,8 мкм). Хромосома 8 метацентричнее хромосомы 9, которая характеризуется регулярной вторичной перетяжкой в прицентромерном районе длинного плеча.
К группе D относятся хромосомы 13, 14 и 15 (4,2 мкм) – средних размеров акроцентрические хромосомы с почти терминальным расположением центромеры. Эти хромосомы между собой не различаются ни по размерам, ни морфологически после рутинного окрашивания. Короткое плечо всех трёх пар хромосом может формировать спутники (рис. 1, 2 и 5).
К группе Е относятся хромосомы 16, 17 и 18. Хромосома 16 (размер – 3,6 мкм) – сравнительно небольшая метацентрическая хромосома, содержащая вторичную перетяжку в длинном плече. Хромосома 17 (размер – 3,5 мкм) – сравнительно короткая субметацентрическая хромосома. Хромосома 18 (размер – 3,2 мкм) – самая короткая субметацентрическая хромосома.
Группа F представлена хромосомами 19 и 20 (размеры – 2,9 мкм). Это короткие метацентрические хромосомы, которые не отличаются между собой без дифференциального окрашивания по длине.
Хромосомы 21 и 22 (2,8 мкм) относятся к группе G. Это наиболее короткие акроцентрические хромосомы в кариотипе, которые обладают способностью формировать спутники на коротком плече (рис. 1, 2 и 5).
Хромосома Y (2,3 мкм) является маленькой акроцентрической хромосомой, сравнимой по размерам с хромосомами 21 и 22, но не имеющая спутников.
Важнейшая работа по созданию общей системы обозначения и классификации хромосом человека, представляемая в виде отдельной книги, проводилась регулярно из года в год, куда в последние десятилетия включались и результаты использования современных молекулярно-цитогенетических методов. Первые результаты работы учёных по номенклатуре и классификации хромосом человека были представлены в 1960 году в Денвере, в Университете штата Колорадо (США). Работа комиссии была проведена при поддержке американского онкологического общества. В состав комиссии входили известнейшие учёные: 14 учёных-цитологов и 3 учёных-генетика. Результаты были опубликованы в Денвере в том же 1960 году в ряде журналов в виде документа (книги), названного как «Стандартная система номенклатуры митотических хромосом человека». Впоследствии был создан комитет по номенклатуре хромосом человека. Комиссия и комитет периодически собирались для работы и, по мере развития цитогенетических, а в последние десятилетия и молекулярно-цитогенетических исследований, вносили поправки и дополнения в существующую классификацию. Работа комиссий проводилась регулярно в различных странах и городах. Комитет последовательно собирался в Париже, Чикаго, Мехико, Лэйк-Плэсиде, Эдинбурге, Стокгольме, где было решено разработать и опубликовать унифицированный вариант номенклатуры хромосом человека, включающий основные положения первых совещаний (Денвер, Лондон, Чикаго, Париж). Результаты работы комитета публиковались в различных издательствах. Этот важный документ получил название «Международная система номенклатуры хромосом человека» – «An International System for Human Cytogenetic Nomenclature» (ISCN). В дальнейшем поправки и дополнения в документе делались, учитывая новые разработанные технологии, включая молекулярно-цитогенетические, и докладывались на различных конференциях. Последний документ – «ISCN 2016» – An International System for Human Cytogenetic Nomenclature» опубликован в 2016 году. Таким образом, в одном документе даётся полная номенклатура хромосом в норме и при хромосомных синдромах и аномалиях, исходя из цитогенетических и современных молекулярно-цитогенетических технологий (см рекомендуемую литературу).
Следует отметить, что хромосомные синдромы и аномалии связаны с хромосомными (геномными) мутациями (аномалиями) в виде различных структурных перестроек хромосом или с изменением их числа (n). Численные изменения хромосом могут быть двух типов: полиплоидии – умножение хромосомного набора (3n, 4n и т. д.) или генома, кратное гаплоидному числу хромосом; анеуплоидии – увеличение или уменьшение числа хромосом, некратное гаплоидному. Структурные хромосомные (геномные) перестройки классифицируют по принципу линейной последовательности расположения генов: делеции (потеря хромосомных участков), дупликации (удвоение хромосомных участков), инверсии (перевертывание на 180° относительно нормальной последовательности хромосомных участков), инсерции (вставки хромосомных участков) и транслокации (изменение расположения хромосомных участков). Подробная информация по возможным аномалиям хромосом человека представлена в главе 3.5.
Сателлиты (цитология)
Хромосо́мы (греч. χρώμα — цвет и греч. σώμα — тело) — хорошо окрашиваемые включения в ядре эукариотической клетки, которые становятся легко заметными в определённых фазах клеточного цикла (во время митоза или мейоза). Хромосомы представляют собой высокую степень конденсации хроматина, постоянно присутствующего в клеточном ядре. Исходно термин был предложен для обозначения структур, выявляемых в эукариотических клетках, но в последние десятилетия все чаще говорят о бактериальных хромосомах. В хромосомах сосредоточена большая часть наследственной информации.
Содержание
Хромосомы эукариот
Хромосомы эукариот имеют сложное строение. Основу хромосомы составляет линейная (не замкнутая в кольцо) макромолекула дезоксирибонуклеиновой кислоты (ДНК) значительной длины (например, в молекулах ДНК хромосом человека насчитывается от 50 до 245 миллионов пар азотистых оснований). В растянутом виде длина хромосомы человека может достигать 5 см. Помимо неё, в состав хромосомы входят пять специализированных белков — H1, H2A, H2B, H3 и H4 (так называемые гистоны) и ряд негистоновых белков. Последовательность аминокислот гистонов высококонсервативна и практически не различается в самых разных группах организмов.
В интерфазе хроматин не конденсирован, но и в это время его нити представляют собой комплекс из ДНК и белков. Макромолекула ДНК обвивает октомеры (структуры, состоящую из восьми белковых глобул) гистоновых белков H2A, H2B, H3 и H4, образуя структуры, названные нуклеосомами. В целом вся конструкция несколько напоминает бусы. Последовательность из таких нуклеосом, соединённых белком H1, называется нуклеофиламентом (nucleofilament), или нуклеосомной нитью, диаметром около 10 нм.
В ранней интерфазе (фаза G1) основу каждой из будущих хромосом составляет одна молекула ДНК. В фазе синтеза (S) молекулы ДНК вступают в процесс репликации и удваиваются. В поздней интерфазе (фаза G2) основа каждой из хромосом состоит из двух идентичных молекул ДНК, образовавшихся в результате репликации и соединённых между собой в районе центромерной последовательности.
Перед началом деления клеточного ядра хромосома, представленная на этот момент цепочкой нуклеосом, начинает спирализовываться, или упаковываться, образуя при помощи белка H1 более толстую хроматиновую нить, или хроматиду, (chromatin fiber) диаметром 30 нм. В результате дальнейшей спирализации диаметр хроматиды достигает ко времени метафазы 700 нм. Значительная толщина хромосомы (диаметр 1400 нм) на стадии метафазы позволяет, наконец, увидеть её в световой микроскоп. Конденсированная хромосома имеет вид буквы X (часто с неравными плечами), поскольку две хроматиды, возникшие в результате репликации, по-прежнему соединены между собой в районе центромеры (подробнее о судьбе хромосом при клеточном делении см. статьи митоз и мейоз).
Центромера
Первичная перетяжка
X. п., в которой локализуется центромера и которая делит хромосому на плечи.
Вторичные перетяжки
Морфологический признак, позволяющий идентифицировать отдельные хромосомы в наборе. От первичной перетяжки отличаются отсутствием заметного угла между сегментами хромосомы. Вторичные перетяжки бывают короткими и длинными и локализуются в разных точках по длине хромосомы. У человека это 13, 14, 15, 21 и 22 хромосомы.
Типы строения хромосом
Различают четыре типа строения хромосом:
Тип хромосом является постоянным для каждой гомологичной хромосомы и может быть постоянным у всех представителей одного вида или рода.
Спутники (сателлиты)
Сателлит — это округлое или удлинённое тельце, отделённое от основной части хромосомы тонкой хроматиновой нитью, по диаметру равный или несколько меньший хромосоме. Хромосомы, обладающие спутником принято обозначать SAT-хромосомами. Форма, величина спутника и связывающей его нити постоянны для каждой хромосомы.
Зона ядрышка
Зоны ядрышка (организаторы ядрышка) — специальные участки, с которыми связано появление некоторых вторичных перетяжек.
Хромонема
Хромонема — это спиральная структура, которую удаётся увидеть в декомпактизованных хромосомах через электронный микроскоп. Впервые наблюдалась Баранецким в 1880 году в хромосомах клеток пыльников традесканции, термин ввёл Вейдовский. Хромонема может состоять из двух, четырёх и более нитей, в зависимости от исследуемого объекта. Эти нити образуют спирали двух типов:
Хромосомные перестройки
Нарушение структуры хромосом происходит в результате спонтанных или спровоцированных изменений (например, после облучения).
Гигантские хромосомы
Такие хромосомы, для которых характерны огромные размеры, можно наблюдать в некоторых клетках на определённых стадиях клеточного цикла. Например, они обнаруживаются в клетках некоторых тканей личинок двукрылых насекомых (политенные хромосомы) и в ооцитах различных позвоночных и беспозвоночных (хромосомы типа ламповых щёток). Именно на препаратах гигантских хромосом удалось выявить признаки активности генов.
Политенные хромосомы
Впервые обнаружены Бальбиани в 1881-го, однако их цитогенетическая роль была выявлена Костовым, Пайнтером, Гейтцем и Бауером. Содержатся в клетках слюнных желёз, кишечника, трахей, жирового тела и мальпигиевых сосудов личинок двукрылых.
Хромосомы типа ламповых щеток
Обнаружены Рюккертом в 1892 году. По длине превышают политенные хромосомы, наблюдаются в ооцитах на стадии первого деления мейоза, во время которой процессы синтеза, приводящие к образованию желтка, наиболее интенсивны. Общая длина хромосомного набора в ооцитах некоторых хвостатых амфибий достигает 5900 мкм.
Бактериальные хромосомы
Прокариоты (архебактерии и бактерии, в том числе митохондрии и пластиды, постоянно обитающие в клетках большинства эукариот) не имеют хромосом в собственном смысле этого слова. У большинства из них в клетке имеется только одна макромолекула ДНК, замкнутая в кольцо (эта структура получила название нуклеоид). У ряда бактерий обнаружены линейные (не замкнутые в кольцо) макромолекулы ДНК. Помимо нуклеоида или линейных макромолекул, ДНК может присутствовать в цитоплазме прокариотных клеток в виде небольших замкнутых в кольцо молекул ДНК, так называемых плазмид, содержащих обычно незначительное, по сравнению с бактериальной хромосомой, число генов. Состав плазмид может быть непостоянен, бактерии могут обмениваться плазмидами в ходе парасексуального процесса.
Имеются данные о наличии у бактерий белков, связанных с ДНК нуклеоида, но гистонов у них не обнаружено.
Хромосомы и их роль в наследственности
Характеристика морфологической и молекулярной структуры хромосом. Проведение исследования главных типов спутников. Особенность корреляционной изменчивости. Изменение структуры популяций под влиянием изоляции. Основные признаки естественного отбора.
| Рубрика | Биология и естествознание |
| Вид | контрольная работа |
| Язык | русский |
| Дата добавления | 29.11.2016 |
| Размер файла | 97,4 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
1. Хромосомы, их роль в наследственности, морфологическая и молекулярная структура
Размеры хромосом у разных организмов варьируют в широких пределах. Число хромосом у различных объектов также значительно колеблется, но характерно для каждого вида животных или растений.
Хромосомы животных и растений представляют собой палочковидные структуры разной длины с довольно постоянной толщиной, у большей части хромосом удается легко найти зону первичной перетяжки, которая делит хромосому на два плеча. В области первичной перетяжки находится центромера, где расположен кинетохор. Некоторые хромосомы имеют вторичную перетяжку.
3. линейные спутники, имеющие форму длинного хромосомного сегмента. Вторичная перетяжка значительно удалена от терминального конца;
4. терминальные спутники, локализованные на конце хромосомы;
5. интеркалярные спутники, локализованные между двумя вторичными перетяжками.
Вторичная перетяжка, соединяющая спутник с телом хромосомы, способна к участию в процессе формирования и сборки ядрышек. Такая вторичная перетяжка называется еще ядрышковым организатором.
Нормальная длина каждой хромосомы и суммарная длина всех хромосом кариотипа постоянна. Морфология хромосомы определяется в первую очередь положением центромеры. В соответствии с местом расположения центромеры выделяют основные формы хромосом: метацентрические, субметацентрические, акроцентрические и изохромосомы.
Метацентрические хромосомы отличаются тем что плечи у них одинаковой или почти одинаковой длины. Субметацентрические хромосомы имеют плечи разной длины. У акроцентрических хромосом центромера расположена к близко к одной из теломер.
Молекулярная структура хромосом достаточно сложная. Функция этой структуры заключается в такой упаковке ДНК, чтобы она поместилась в хромосоме. Если бы геномная ДНК была представлена в виде обычной двунитевой спирали, то она протянулась бы на 2 метра. Упаковка ДНК в хроматин обеспечивает многократное сокращение линейных размеров ДНК, необходимое для размещения её в ядре, которая происходит в первых три наиболее изученных уровня упаковки:
1) накручивание ДНК на нуклеосомы с образованием нуклеосомной нити диаметром 10 нм (нанометров),
2) компактизация нуклеосомной нити с образованием так называемой 30-нм фибриллы,
Различают следующие типы корреляции:
1) Морфогенетические корреляции приурочены преимущественно к эмбриональной фазе онтогенеза. Именно на примерах этих корреляций четко выявляется природа коррелятивных зависимостей. С первых стадий развития (дробления) яйца и последующего-органогенеза морфогенетические или формообразовательные корреляции играют ведущую роль в эмбриогенезе. Морфогенетические коррелятивные изменения происходят вследствие возникновения первичных изменений, которые влекут за собой соответственные зависимые вторичные изменения.
2) Эргонтические корреляции по преимуществу относятся к постэмбриональному периоду онтогенеза, но особенно характерны для ювенильного периода. Их значение: окончательная моделировка индуцируемых частей. Эргонтические (рабочие) корреляции возникают в результате контакта между соответственными частями организма. Особенно отчетливо выявляются эргонтические корреляции во взаимоотношениях между работающей мышцей и подлежащей костной опорой. Чем сильнее развита мышца, тем резче развиваются гребни на участках кости, к которым мышца прикрепляется. Поэтому по развитию костных гребней можно судить о степени развития мышцы, служащей эргонтическим индуктором.
Корреляции могут быть обусловлены чисто генетическими причинами (плейотропия) или взаимозависимостями процессов становления определенных признаков и свойств в индивидуальном развитии особей (онтогенетические корреляции), а также сходными реакциями разных признаков и свойств на одни и те же внешние воздействия (физиологические корреляции). Наконец, корреляции могут отражать историю происхождения популяций из смеси двух или более форм, каждая из которых привносит не отдельные признаки, а комплексы взаимосвязанных признаков и свойств (исторические корреляции). Изучение коррелятивной изменчивости имеет важное значение в палеонтологии (например, при реконструкции вымерших форм по отдельным ископаемым остаткам), в антропологии (например, при восстановлении черт лица на основе изучения черепа), в селекции и медицине. молекулярный хромосома спутник популяция
3. Изменение структуры популяций под влиянием изоляции. Влияние миграции и отбора
Изоляцию делят на три основные формы: географическую, биологическую и экологическую.
Биологическая изоляция делится на генетическую и физиологическую. При генетической изоляции ограничивается или полностью исключается свободное комбинирование генов. К факторам генетической изоляции относятся: полиплоидия, хромосомные перестройки, несовместимость ядра и цитоплазмы, различные нарушения нормального течения мейоза, приводящие к образованию нежизнеспособных гамет, возникновение мутаций, вызывающих стерильность или летальный эффект, и т. д. Физиологическая изоляция, будучи генетически обусловленной, проявляется, например, в избирательности спаривания или опыления, специфического опыления насекомыми, в действии безусловных рефлексов, под влиянием которых птицы ежегодно возвращаются к прежним местам гнездовий, а рыбы уходят на нерест в определенные реки, в различиях в строении половых органов, отсутствии полового влечения между самцами и самками разных популяций и т. д.
Экологическая изоляция возникает в результате того, что разные группы организмов, обитающие в одной географической области, занимают различные местообитания. Она может быть обусловлена и тем, что у разных групп организмов одной популяции период размножения не совпадает во времени, то есть приходится на различные сезоны года.
Различные формы изоляции, ограничивающие обмен генами между группами организмов или препятствующие такому обмену, действуют не только отдельно, но часто и в сочетании друг с другом.
В любую популяцию путем скрещивания могут включиться, мигрировать генотипы из другой популяции. При этом быстро изменяется частота имеющихся в популяции аллелей или появляются новые гены, ранее в ней отсутствовавшие. Следовательно, популяция может подвергаться давлению миграции, в результате которого границы между популяциями сглаживаются, а генетическое разнообразие возрастает.
При однократной миграции в результате стабилизирующего скрещивания в исходной популяции установится генетическое равновесие. Если же миграция происходит систематически, то концентрации генов будут меняться с каждым новым стабилизирующим скрещиванием.
1. Меттлер Л., Грегг Т., Генетика популяций и эволюция, пер. с англ., М., 1972;
3. Лобашев М. Е., Генетика, 2 изд., Л., 1967;
4. Айала Ф., Кайгер Дж. Современная генетика, тт. 1-3, М., 1988
Chromosome Satellite
‘Chromosomal satellite’ is the term given to that part of the end of a chromosome that is separated from the rest of the chromosome by a secondary constriction.
Related terms:
Satellite Chromosomes
Abstract
‘Chromosomal satellite’ is the term given to that part of the end of a chromosome that is separated from the rest of the chromosome by a secondary constriction. (The primary constriction refers to the region of the chromosome occupied by the centromere.) It seems that chromosomal satellites were first described by Russian cytologists early in the twentieth century who used the term ‘sputnic’. The secondary constriction marks the site of a nucleolar organizer region (NOR), a region containing multiple copies of the 18S and 28S ribosomal genes that synthesize ribosomal RNA required by ribosomes. The NOR remains attached to the nucleolus during interphase, and nucleolar remnants remaining on the chromosome may lead the chromatin fiber containing the ribosomal genes to persist as a thin thread at metaphase.
Endometriosis
Cytogenetics of Endometriosis
Cytogenetic methods that assess gene content in intact or microdissected endometriotic tissues include chromosome satellite painting and comparative genomic hybridization. Kosugi and colleagues 66 used fluorescence in situ hybridization (FISH) to find substantially increased aneuploidy and loss of heterozygosity of chromosome 17 in endometriotic lesions. Interestingly, this chromosomal region is the location of several tumor suppressor genes important in the normal regulation of the mitotic cell cycle. Among these is the p53 locus, which is lost in cases of severe endometriosis, 67 and the TOB1 tumor suppressor, noted to be preferentially down-regulated in endometriotic cells treated with IL-1β. 59 A 50% loss of heterozygosity (LoH) for chromosomes 1p and 22q was noted by Gogusev and colleagues 68 in endometriotic implants. Lower levels of LoH also have been reported for chromosomes 9p and 11q. 69 These findings suggest that genomic instability is a feature of endometriosis.
Comparative genomic hybridization is a technique based on the competitive in situ hybridization of differentially labeled DNA from endometriosis and normal endometrial tissue to human metaphase spreads. Regions of gain of DNA sequences are seen as an increased color ratio of the two fluorochromes labeling the respective DNAs. Using this method, Gogusev and colleagues in Paris identified chromosomal regions in which gene copy numbers are altered in endometriosis. 68 In an established endometriosis cell line (FbEM-1), these investigators observed that the c-ERBB2 protooncogene was overexpressed. 70 This result complements the finding that TOB1 is reduced in endometriosis and suggests that ERBB2 signalling is important in endometriosis.
Genomes
The Structure and Complexity of Virus Genomes
Unlike the genomes of all cells, which are composed of DNA, virus genomes may contain their genetic information encoded in either DNA or RNA. The chemistry and structures of virus genomes are more varied than any of those seen in the entire bacterial, plant, or animal kingdoms. The nucleic acid making up the genome may be single stranded or double stranded, and it may have a linear, circular, or segmented structure. Single-stranded virus genomes may be either positive-sense (i.e., the same polarity or nucleotide sequence as the mRNA ), negative-sense, or ambisense (a mixture of the two). Virus genomes range in size from approximately 2,500 nucleotides (nt) (e.g., the Geminivirus tobacco yellow dwarf virus at 2,580 nt of single-stranded DNA) to 2.8 million base pairs of double-stranded DNA in the case of Pandoravirus, which is nearly five times as large as the smallest bacterial genome (e.g., Mycoplasma genitalum at 580,000 bp). Some of the simpler bacteriophages are well-studied examples of the smallest and least complex genomes. At the other end of the scale, the genomes of the largest double-stranded DNA viruses such as herpesviruses and poxviruses are sufficiently complex to have escaped complete functional analysis yet, even though the complete nucleotide sequences of the genomes of a large number of examples have been known for many years.
Whatever the composition of a virus genome, they must follow one rule. Because viruses are obligate intracellular parasites only able to replicate inside the appropriate host cells, the genome must contain information encoded in a way that can be recognized and decoded by the particular type of host cell. The genetic code used by the virus must match or at least be recognized by the host organism. Similarly, the control signals that direct the expression of virus genes must be appropriate to the host. Many of the DNA viruses of eukaryotes closely resemble their host cells in terms of the biology of their genomes. Chapter 4 describes the ways in which virus genomes are replicated, and Chapter 5 deals in more detail with the mechanisms that regulate the expression of virus genetic information. The purpose of this chapter is to describe the diversity of virus genomes and to consider how and why this variation may have arisen.
Vaccinia virus mRNAs were found to be polyadenylated at their 3′ ends by Kates in 1970—the first time this observation had been made in any organism.
Introns in prokaryotes were first discovered in the genome of bacteriophage T4 in 1984. Several examples of this phenomenon have now been discovered in T4 and some other phages. This raises an important point. The conventional view is that prokaryote genomes are smaller and replicate faster than those of eukaryotes and hence can be regarded as “streamlined.” The genome of phage T4 consists of 160 kbp of double-stranded DNA and is highly compressed, for example, promoters and translation control sequences are nested within the coding regions of overlapping upstream genes. The presence of introns in bacteriophage genomes, which are under constant ruthless pressure to exclude “junk sequences,” suggests that these genetic elements must have evolved mechanisms to escape or neutralize this pressure and to persist as parasites within parasites. All virus genomes experience pressure to minimize their size. Viruses with prokaryotic hosts must be able to replicate sufficiently quickly to keep up with their host cells, and this is reflected in the compact nature of many (but not all) bacteriophages. Overlapping genes are common, and the maximum genetic capacity is compressed into the minimum genome size. In viruses with eukaryotic hosts there is also pressure on genome size. Here, however, the pressure is mainly from the packaging size of the virus particle (i.e., the amount of nucleic acid that can be incorporated into the virion ). Therefore, these viruses commonly show highly compressed genetic information when compared with the low density of information in eukaryotic cellular genomes.
There are exceptions to this rule. Some bacteriophages (e.g., the family Myoviridae, such as T4) have relatively large genomes, up to 170 kbp. The genome of Mimivirus, at approximately 1.2 Mbp, contains around 1,200 open reading frames (ORFs), only 10% of which show any similarity to proteins of known function. Among viruses of eukaryotes, herpesviruses and poxviruses also have relatively large genomes, up to 235 kbp. It is notable that these virus genomes contain many genes involved in their own replication, particularly enzymes concerned with nucleic acid metabolism. These viruses partially escape the restrictions imposed by the biochemistry of the host cell by encoding additional biochemical equipment. The penalty is that they have to encode all the information necessary for a large and complex particle to package the genome—which is also an upward pressure on genome size. Later sections of this chapter contain detailed descriptions of both small, compact and large, complex virus genomes.
It’s Not the Size of Your Genome that Counts, it’s What You Do with it
Traditionally it was thought that virus genomes were smaller than bacterial genomes. Often that is true, but not always. So does having a bigger genome make a better virus? Not in my opinion. As discussed in this chapter, some virus genomes are as complex as bacterial genomes, and larger than some of the smaller ones. This means they have nearly the same capabilities as bacteria—but not quite. No virus genome contains all the genes needed to make ribosomes, so in the end they are still parasites. Personally, my admiration goes to those stripped down miniature marvels which contain only a handful of genes and yet still manage to take over a cell and replicate themselves successfully. Now that’s impressive.
Role of subcellular organelles: the nucleus
The nucleolus
Usually, densely staining granules (the nucleoli) can be detected by light microscopy in the nucleus; selective stains give a strong reaction for RNA, but stain weakly for DNA. The number of nucleoli varies from one cell type to another and they disappear during cell division, at prophase, becoming associated with their satellite chromosomes, probably at the organizer region.
The nucleoli are built up from bead-like structures, 15 nm in diameter, containing dense particles of RNA embedded in a matrix. Nucleolar DNA codes for ribosomal RNA with special arrays of bases coding for 28-S and 18-S rRNA. RNA polymerases are found in the nucleoli, as are ribonucleases, which are enzymes essential for RNA synthesis and RNA degradation. The experimental evidence therefore indicates that nucleoli are primarily involved with the synthesis of rRNA for the ribosomes.
Lycopersicon assays of chemical/radiation genotoxicity for the study of environmental mutagens
4.5 Pretreatment
For the induction of polyploidy, Choudhury [41] found that the best result was to pre-soak seeds in water for 24 h and then treat the seed in 0.2% colchicine for 6–8 days.
Zea mays assays of chemical/radiation genotoxicity for the study of environmental mutagens
Genome organization in and around the nucleolus
Chromosomal constitution of the human nucleolus-associated DNA
The detailed analysis of nucleolus-associated chromatin domains (NADs) [25] revealed that: (i) only a specific subset of the genome is associated with nucleoli (4% without the rDNA-containing short arms of the acrocentric chromosomes); (ii) NADs are enriched in different sequence features [e.g. satellite repeats (mainly alpha-, beta-, (GAATG)n/(CATTC)n-types), members of the zinc-finger, olfactory receptor defensin and immunoglobulin protein-coding gene families, transcriptionally active 5S rRNA genes and tRNA genes]; and (iii) the transcriptional status and chromatin feature analysis of NADs shows that they contain mainly inactive chromosomal regions.
Genome Architecture and Expression
New approaches advance our knowledge of satellite evolution and function
Evolutionary patterns across taxa
Neutral mutation and detecting selection
Extensive variation in specific satellite abundances across lineages suggests that they have high rates of copy number change. However, estimates of neutral rates of copy number change and sequence variation, including the relative contributions of gene conversion versus unequal exchange to these parameters, remain unknown. Estimation of these parameters is important in order to detect selection — for example, a satellite under stabilizing selection will have a narrower copy number distribution than expected given neutral processes, and, as the eventual fate of arrays is extinction ( Box 1 ), remain in genomes longer than expected under neutrality. One approach for neutral rate estimation is assessment of satellites in whole-genome sequencing of mutation accumulation studies. Recently, Flynn and colleagues used k-Seek [ 22 ] to compare the satellite composition of Daphnia pulex lines derived from a single progenitor either evolving under neutrality (bottlenecked to N = 1 each generation) or under selection (maintained as a large population) [ 26 • ]. They found very high rates of satellite copy number change in the lines evolving under neutrality, on the order of 10 −3 changes in copy number per repeat unit per generation. Further, variation in copy number across individuals from the large population was 33% lower than the variation across the mutation accumulation lines, suggesting that total satellite abundance is under stabilizing selection. Interestingly, some satellites were much more constrained than others.
Including satellites in assemblies
Technologies that generate long-range data, such as long reads from single molecules or optical mapping, are now enabling assembly into or even across satellite regions [ 5 • ]. Recently, Jain and colleagues (bioRxiv https://doi.org/10.1101/170373 ) assembled the entire centromere of the human Y-chromosome using Oxford Nanopore long reads. Once assembled, patterns predicted by theoretical models can be tested ( Box 1 ). Combining PacBio long reads and optical mapping, Weissensteiner and colleagues confirmed the inverse relationship of repeat array length and recombination rate in the Eurasian crow [ 41 • ]. Depending on array size and homogeneity, complete assemblies may still remain out of reach for some regions of the genome.
Functional consequences of satellite variation
Assembly-free methods of quantifying satellite variants applied to ChIP-seq data have revealed some of the selfish and functional roles of satellite sequences. For example, Iwata-Otsubo and colleagues identified differences in array length and sequence diversity associated with selfishly transmitted centromeres in mice by assessing satellite sequences immunoprecipitated with the centromere protein CenP-A [ 42 •• ]. While, in this study, specific satellite DNA sequences were associated with centromeres, studies in other organisms have suggested that sequence identity may not be as important. In a comparative ChIP-seq approach across races of maize, satellite sequence identity was not as closely associated with centromere function [ 43 • ]. More work is necessary to further distinguish possible functional roles of different satellites and the relationship of function to copy number and sequence variation across the genome.