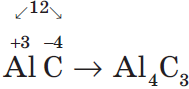Для чего нужна электроотрицательность
Электроотрицательность
Между атомами в молекуле образуется определенная химическая связь, которую в современном научном мире описывает квантовая механика. Заряженные частицы в атоме взаимодействуют между собой, обеспечивая молекуле определенную устойчивость.
В зависимости от расстояния между атомами, полярности и прочности, химическая связь между атомами может быть:
Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Она является необходимым показателем для описания молекулярных систем, определения типа связей в молекуле, распределения ионного заряда между взаимодействующими элементами. К факторам, которые влияют на эту величину, относятся: валентное состояние атома, степень окисления, координационное число и другие.
Приняв значение электроотрицательности водорода равной 2.1 произвольно и используя известные термодинамические данные, сравнивая электроотрицательность элементов с водородом, Поллинг составил первую шкалу относительных атомных электроотрицательностей.
Необходимо помнить, что электроотрицательность — величина не постоянная, а относительная, и позволяет лишь определить, в сторону какого элемента сдвигается общая электронная пара.
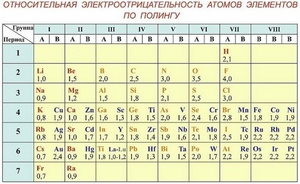
Помимо шкалы Поллинга, что изучают в школьном курсе химии, и которую можно найти на странице 276 учебника «Химия 8 класс» под редакцией В.В.Еремина, в мире существует около двадцати шкал определения электроотрицательности.
Таблица электроотрицательности Поллинга — справочный материал, и не всегда есть под рукой. Однако существуют общие закономерности электроотрицательности, и, зная расположение элемента в Периодической системе Д.И.Менделеева, можно косвенно оценить, в сторону какого из элементов в молекуле будет сдвигаться общая электронная пара.
Электроотрицательность химических элементов, расположенных правее, больше, чем у элементов, расположенных левее в одном периоде. Электроотрицательность элементов, расположенных выше, больше, чем у элементов, расположенных ниже в одной группе. Исходя из этих данных, самый высокий показатель у элементов, расположенных в правом верхнем углу, и самый низкий у элементов внизу слева.
По этим данным был составлен ряд электроотрицательности, в котором химические элементы расположены в порядке убывания ее величины: F, O, N, Cl, Br, S, C, P, H, Si, Mg, Li, Na.
Если таблица Поллинга под рукой, с помощью несложных арифметических действий можно определить тип связи в молекуле. Для этого нужно найти относительную электроотрицательность атомов, входящих в молекулу по таблице, и из большего значения вычесть меньшее, а по результату оценить связь.
Разность значений равна 0,5 или меньше — сила притяжения у атомов практически равна, электронное облако находится примерно посередине расстояния между атомами веществ, а связь является ковалентной неполярной. Если молекула состоит из двух одинаковых атомов, то разность значений электроотрицательностей равна 0. Атомы в молекуле с ковалентной полярной связью прочно соединены.
Разность значений составляет от 0,5 до 1,6 — сила притяжения у одного из атомов значительно больше, и он смещает общую электронную пару к себе, приобретая таким образом частичный отрицательный заряд. Атом, от которого общая электронная пара на более далеком расстоянии, приобретает частичный положительный заряд. Между атомами возникает ковалентная полярная связь. Сдвиг общей электронной пары приводит к определенному дисбалансу и молекула может вступать в определенные химические превращения.
Разность значений равна 2,0 и выше. В этом случае общая пара электронов достанется атому, чья электроотрицательность больше. Заряд у такого атома становится отрицательным, а у другого атома в молекуле за счет потери электрона — положительным. Между атомами возникает ионная связь. Ионная связь нестойкая, и молекулы легко вступают в реакции с другими атомами и полярными молекулами.
Разность значений составляет от 1,6 до 2,0. Самый сложный для определения тип связи, поскольку зависит от входящих в состав молекулы атомов. Если в молекулу входит атом металла, то связь ионная. Если в молекуле атомы металла отсутствуют — связь ковалентная полярная.
Электроотрицательность
Эле́ктроотрица́тельность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B (A, B — символы любых химических элементов) в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B.
В настоящее время для определения электроотрицательностей атомов существует много различных методов, результаты которых хорошо согласуются друг с другом, за исключением относительно небольших различий, и во всяком случае внутренне непротиворечивы.
Первая и широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (3,0). Активные щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,1. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0. Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных подгрупп. Существует также несколько других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.
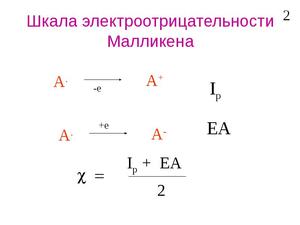
Теоретическое определение электроотрицательности было предложено американским физиком Р. Малликеном. Исходя из очевидного положения о том, что способность атома в молекуле притягивать к себе электронный заряд зависит от энергии ионизации атома и его сродства к электрону, Р. Малликен ввёл представление об электроотрицательности атома А как о средней величине энергии связи наружных электронов при ионизации валентных состояний (например, от А − до А + ) и на этой основе предложил очень простое соотношение для электроотрицательности атома:
где J1 A и εA — соответственно энергия ионизации атома и его сродство к электрону.
Помимо шкалы Малликена, описанной выше, существует более 20-ти различных других шкал электроотрицательности, среди которых шкала Л. Полинга (основана на энергии связи при образовании сложного вещества из простых), шкала Олреда-Рохова (основана на электростатической силе, действующей на внешний электрон) и др.
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, т. е. от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
В период бурного развития квантовой химии как средства описания молекулярных образований (середина и вторая половина XX века) плодотворной оказался подход Л.Полинга, который в числе прочих исследований ввел собственную шкалу электроотрицательностей, в которой из «стандартных» элементов максимальную имеет фтор (

где 
Одним из наиболее развитых в настоящее время подходов является подход Сандерсона. В основу этого подхода легла идея выравнивания электроотрицательностей атомов при образовании химической связи между ними. В многочисленных исследованиях были найдены зависимости между электроотрицательностями Сандерсона и важнейшими физико-химическими свойствами неорганических соединений подавляющего большинства элементов периодической таблицы. [1] Очень плодотворной оказалась и модификация метода Сандерсона, основанная на перераспределении электроотрицательности между атомами молекулы для органических соединений. [2] [3] [4]
Электроотрицательность элементов по таблице Менделеева
Электроотрицательность — это характеристика атома, показывающая, насколько высока его способность притягивать к себе электроны. Когда химическая связь образована двумя разными элементами, электроны у одного из них всегда расположены более плотно, чем у другого. Тот атом, у которого электронная плотность выше, называется электроотрицательным, тот, у кого ниже — соответственно, электроположительным.
Как определить электроотрицательность
Существует несколько шкал, ориентируясь на которые, можно определить электроотрицательность того или иного элемента. Попробуем их перечислить:
Чтобы определить параметр «электроотрицательность» по таблице Менделеева, нужно всего лишь знать, что наиболее электроотрицательные свойства имеют те элементы, которые располагаются вверху таблицы и в правой ее части. То есть, чем выше и правее элемент находится в таблице Менделеева, тем выше у него электроотрицательность и наоборот, чем ниже и левее — тем выше у него электроположительность.
Шкала Полинга — наиболее часто используемая таблица электроотрицательности. Названа она в честь американского химика Лайнуса Полинга, который впервые ввел понятие электроотрицательности. Согласно шкале Поллинга, электроотрицательность всех имеющихся в природе элементов лежит в интервале от 0,7 (таковой она является у щелочного металла франция) до 4,0 (у газа-галогена фтора). В таблице приводятся относительные и неточные величины.
Шкала Малликена рассматривает электроотрицательность как величину энергии связи между валентными электронами. Приводятся максимально точные расчеты.
Расположение элементов в каждой из таблиц является идентичным, несмотря на то, что методы определения отличаются друг от друга, и величины тоже.
Самые высокие значения электроотрицательности
Фтор, один из галогенов — это элемент, обладающий наивысшей электроотрицательностью, а точнее — 3,98. Его химическая активность невероятно высока, настолько, что химики называют его не иначе как «все разгрызающий».
Следом за фтором идет кислород. Электроотрицательность кислорода немного пониже — 3,44, но тоже достаточно высока.
Следом за ними (спускаясь все ниже по правой части таблицы Менделеева) идут:
Большая часть неметаллов имеет электроотрицательность, колеблющуюся между значениями 2 и 3. У отличающихся наиболее высокой активностью металлов, от франция до бериллия, она колеблется от значения 0,7 до 1,57.
Как определить валентные электроны
Валентностью называют способность атома вступать во взаимодействие с другими атомами, образуя с ними определенные химические связи. Валентными электронами именуются электроны, непосредственно участвующие в образовании химической связи. Основными создателями, внесшими в теорию валентности наибольший вклад, являются русский ученый Бутлеров и немецкий ученый Кекуле. Электроны, которые принимают участие в образовании химической связи, называют валентными.
Атом, как мы все знаем из школьного курса, устроен таким образом, что довольно-таки напоминает по своему устройству Солнечную систему. В центре атома находится огромное ядро, чья масса чуть менее, чем полностью равняется массе всего атома, а вокруг него по орбиталям вращаются мелкие электроны, неодинаковые по своим внутренним характеристикам. Ядро атома окажется не таким уж и большим, если сравнить его размеры с длиной расстояния до орбиталей, по которым вращаются атомы. Чем дальше от ядра и чем ближе к внешней электронной оболочке находится электрон конкретно взятого атома, тем быстрее он вступает во взаимодействие с электронами других атомов.
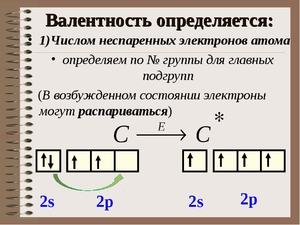
Итак, перед нами таблица Менделеева. Найти на ней нужно третий период. Последовательно перебираем элементы главных подгрупп в нем. Существует правило, согласно которому валентность элемента определяется по номеру его группы и равняется количеству электронов на внешней оболочке его атома.
Помимо главных, есть еще и побочные подгруппы. Когда дело касается их, учитываются еще и d-электроны на предыдущем подуровне. В таблице Менделеева все эти значения легко можно отыскать. Попробуем определить высшую валентность хрома. На внешнем уровне у хрома находится 1 электрон, на d-подуровне — 5. Следовательно, его высшая валентность равна 6. У марганца на внешнем уровне 2 электрона, на d-подуровне — 5. Значит, его высшая валентность — 7.
Все вышеописанное, за некоторыми исключениями, действительно для элементов всех других побочных подгрупп (помимо тех, в которые включены марганец и хром). Вот исключения:
Видео
Это видео поможет вам лучше усвоить такое понятие, как электроотрицательность.
Электроотрицательность, степень окисления и валентность химических элементов
Теория к заданию 3 из ЕГЭ по химии
Электроотрицательность, степень окисления и валентность химических элементов
Электроотрицательность
В химии широко применяется понятие электроотрицательности (ЭО).
Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электроотрицательностью.
Электроотрицательность лития условно принимается за единицу, ЭО других элементов вычисляют соответственно. Существует шкала значений ЭО элементов.
Числовые значения ЭО элементов имеют приблизительные значения: это безразмерная величина. Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства. По ЭО элементы можно записать следующим образом:
$F > O > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs$. Наибольшее значение ЭО имеет фтор.
В Периодической системе элементов ЭО в периоде растет с увеличением номера элемента (слева направо), а в главных подгруппах — уменьшается (сверху вниз).
В периодах по мере увеличения зарядов ядер атомов число электронов на внешнем слое увеличивается, радиус атомов уменьшается, поэтому легкость отдачи электронов уменьшается, ЭО возрастает, следовательно, усиливаются неметаллические свойства.
Степень окисления
Сложные вещества, состоящие из двух химических элементов, называют бинарными (от лат. би — два), или двухэлементными.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно ставится над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т.е. атомы более электроотрицательных элементов.
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т.е. атомы менее электроотрицательных элементов.
Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии.
Валентность
Очень важное значение в описании химического строения органических соединений имеет понятие валентности.
Валентность характеризует способность атомов химических элементов к образованию химических связей; она определяет число химических связей, которыми данный атом соединен с другими атомами в молекуле.
Валентность атома химического элемента определяется, в первую очередь, числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные возможности атомов определяются:
В органической химии понятие «валентность» замещает понятие «степень окисления», с которым привычно работать в неорганической химии. Однако это не одно и то же. Валентность не имеет знака и не может быть нулевой, тогда как степень окисления обязательно характеризуется знаком и может иметь значение, равное нулю.
Электроотрицательность
Элементы с высокой электроотрицательностью, атомы которых имеют большое сродство к электрону и высокую энергию ионизации, т. е. склонные к присоединению электрона или смещению пары связывающих электронов в свою сторону, называются неметаллами.
К ним относятся: водород, углерод, азот, фосфор, кислород, сера, селен, фтор, хлор, бром и иод. По ряду признаков к неметаллам относят также особняком стоящую группу благородных газов (гелий-радон).
К металлам относится большинство элементов Периодической системы.
Для металлов характерны низкая электроотрицательность, т. е. низкие значения энергии ионизации и сродства к электрону. Атомы металлов либо отдают электроны атомам неметаллов, либо смешают от себя пары связывающих электронов. Металлы отличаются характерным блеском, высокой электрической проводимостью и хорошей теплопроводностью. Они в большинстве своем обладают прочностью и ковкостью.
Такой набор физических свойств, отличающих металлы от неметаллов, объясняется особым типом связи, существующей в металлах. Все металлы имеют четко выраженную кристаллическую решетку. В ее узлах наряду с атомами находятся катионы металлов, т.е. атомы, потерявшие свои электроны. Эти электроны образуют обобществленное электронное облако, так называемый электронный газ. Эти электроны находятся в силовом поле многих ядер. Такая связь называется металлической. Свободная миграция электронов по объему кристалла и обусловливает особые физические свойства металлов.