Для чего нужна митохондрия в животной клетке
Митохондрии – клеточные батарейки
Общеизвестный факт: энергию мы получаем вместе с едой.
Еще один общеизвестный факт: нам нужно постоянно дышать – мы вдыхаем кислород, выдыхаем углекислый газ и жизни нам отведено всего 2 минуты, просто мы с каждым вдохом обновляем цикл.
Третий общеизвестный факт: все это как-то связано с выработкой энергии.
Это, пожалуй, все, что может сказать среднестатистический житель планеты Земля про энергообмен собственного организма. Как он происходит, где именно все случается, каким боком тут еда и дыхание, и главное, что можно сделать, чтобы энергии в нашем теле вырабатывалось больше – на эти вопросы сложно найти понятные ответы. Давайте же поговорим об этом в сегодняшней статье.
Из тарелки – внутрь клетки
Итак, вот вы съели вредный чизбургер или полезную диетическую куриную грудку на пару. Механически обработанная пища (не забываем тщательно жевать!) перемещается в желудок. На самом деле перевариваться она начинает уже в ротовой полости, ведь в слюне содержится ряд пищеварительных ферментов. Но в желудке еда подвергается полноценной химической агрессии – ее разбирают буквально на молекулярном уровне.
Потом пища попадает в тонкий кишечник. Здесь настоящее царство специализированных ферментов, которые продолжают расщеплять жиры и белки до составляющих кирпичиков. И уже они постепенно всасываются в кишечную стенку, проникая в кровеносные сосуды, в изобилии покрывающие ее. Такая же судьба в кишечнике ожидает углеводы, витамины, микроэлементы и воду.
А как же выработка энергии, спросит внимательный читатель? Рановато, ответим мы ему! Все эти питательные вещества должны сначала разнестись по организму с током крови, потом проникнуть сквозь мембрану каждой клетки и уже внутри нее начнется процесс «подзарядки» нашего организма.
То есть, еда начинает приносить нам пользу, только попав внутрь клетки в расщепленном виде. А желудок и кишечник – это лишь предварительный этап, где на переваривание пищи энергия, наоборот, активно расходуется.
Внутриклеточный пожар
Хорошо, но что происходит уже в самой клетке? Ведь не сгорает же там пища в прямом смысле этого слова, как сгорает газ или уголь в наших ТЭС, отдавая накопленное тепло?!
Вы будете удивлены, но эти процессы чем-то схожи. Те питательные вещества, которые предназначены для выработки энергии в клетке, проходят сложный каскад биохимических реакций. Но основой этого каскада является окисление – взаимодействие с кислородом. Как это ни странно, но горение, то, которое всем нам знакомо – это ровно такое же окисление, только протекающее намного более бурно.
И вот именно для этого окисления нам и нужен постоянный приток кислорода, который мы получаем при дыхании. Он, как и пища, совершает свой путь из легких через кровеносную систему, попадая, опять же, в каждую клетку нашего организма. Причем расход его очень велик, а энергетический синтез в клетке протекает достаточно быстро. Именно поэтому нам нужно делать новый вдох как минимум раз в две минуты.
Соответственно, в результате внутриклеточного окисления питательных веществ образуется углекислый газ и вода. Воду наши ткани используют для своих нужд, а СО2 выводится из клетки обратно в кровь, переносится в легкие и выбрасывается с выдохом. Часть этого цикла, протекающая в клетке, называется клеточным дыханием – и это конечный этап всего дыхательного процесса в организме.
Клеточные электростанции
Окей, вот мы, наконец, собрали в клетке все компоненты для энергетического синтеза. И что, они сами собой начнут взаимодействовать друг с другом? Нет, не все так просто. Ведь для эффективного производства энергии мы строим электростанции. И такие электростанции имеются и в наших собственных клетках.
Знакомьтесь – митохондрии! Микроскопические внутриклеточные органеллы, благодаря которым мы имеем возможность двигаться, разговаривать, мыслить, и в конце концов, жить. Именно эти неприметные труженики день и ночь снабжают наше тело энергией, перерабатывая питательные вещества и расходуя кислород.
Откуда взялись митохондрии?
Это еще одна удивительная история. Современное научное мнение по этому поводу гласит, что на заре зарождения жизни на нашей планете митохондрии были вполне себе самостоятельными протобактериями. Но именно им повезло первыми научиться вырабатывать энергию с использованием кислорода. И вот эти бактерии начали слегка свысока смотреть на тех одноклеточных, которые производили энергию по старинке, бескислородным способом. Медленно, мол, неэффективно, несовременно.
Одноклеточные организмы были покрупнее тех протобактерий, а потому, обидевшись, принялись их без затей поедать. Но в один прекрасный для всей эволюции момент съеденная бактерия не разрушилась и более того даже сохранила способность вырабатывать энергию. Ого! – сказали одноклеточные, – А давайте-ка мы будем вас защищать и снабжать всем необходимым, а вы внутри нас будете вырабатывать энергию в больших количествах! Протобактерии подумали и согласились.
Ну, шутки шутками, но, тем не менее, такой внутриклеточный симбиоз действительно возник. И оказался настолько эффективным, что сегодня митохондрии – основа энергообмена практически для всех клеток, содержащих ядро. Они обеспечивают жизнедеятельность простейших, растений, грибов, животных и, конечно же, нас с вами.
Как устроены митохондрии?
От своего бактериального прошлого митохондрии унаследовали многие черты. Например, эти органеллы имеют две полноценные мембраны – внутреннюю и внешнюю. Они пронизаны большим количеством сложных ферментных комплексов. В них, собственно, и происходят процессы переработки питательных веществ (обычно – жиров и простых углеводов) в энергию. Также в этом задействовано и внутреннее пространство митохондрии – ее матрикс.
В матриксе помимо большого количества ферментов, находится и еще одно доказательство бывшей самостоятельности митохондрий. Это единственное место в клетке, кроме ядра, где находится генетический материал. Да, митохондрии содержат собственную небольшую ДНК, а также все необходимое для синтеза ряда белков, нужных для клеточного дыхания. Более того, эта ДНК передается по наследству, причем только от матери.
А что еще, кроме выработки энергии?
Очень долгое время считалось, что энергетический синтез – основная и единственная функция митохондрий. Конечно, уже этого вполне достаточно, чтобы с полным правом называть их жизненно важными органеллами. Однако во второй половине ХХ века началось активное изучение других функций, которыми обладают митохондрии. Особенно интенсивно научный поиск ведется с нулевых годов XXI века, когда улучшение лабораторного оборудования позволило ученым изучать работу митохондрий буквально на молекулярном уровне.
Итак, на сегодня уже достоверно известно, что эти органеллы:
На настоящий момент ученые утверждают, что митохондрии проявляют себя не только внутри клетки, но имеют и важные внеклеточные функции. То есть, способны влиять на состояние всего организма! А раз так, то логично предположить, что нарушение их работы, нарушение митохондриального здоровья будет отражаться на общем здоровье человека и может вызывать какие-либо заболевания.
Чем опасно нарушение работы митохондрий?
Предположение, высказанное выше, находит все больше подтверждений в последние годы. Разумеется, ухудшение состояния митохондрий первым делом отразится на выработке энергии в клетках, органах и, наконец, во всем нашем теле. Причем, быстрее и сильнее всех пострадают те ткани, которые потребляют энергию наиболее активно. В организме человека – это нервная, мышечная и секретирующая ткань:
Знакомые многим симптомы, не правда ли? Ведь митохондриальное здоровье может пострадать под влиянием массы причин, с которыми сталкивается каждый из нас:
Хроническое, длительное нарушение митохондриального здоровья помимо ухудшения выработки энергии становится фактором риска и полноценных заболеваний:
Как помочь своим митохондриям?
Раз уж здоровье этих органелл настолько важно, эволюция не могла не предусмотреть здесь какие-то защитные механизмы. Но человечество смогло разобраться в этих механизмах только в последние 10-15 лет. Оказалось, что митохондрии – это отнюдь не скучные сосиски, которые уныло плавают внутри клетки случайным образом. Они умеют целенаправленно перемещаться к местам, где требуется наибольшее количество энергии в данный момент. Более того, они, памятуя свое бактериальное прошлое, способны делиться и даже сливаться друг с другом. В ходе этих процессов они восстанавливают поврежденные мембраны и ферментные комплексы, обмениваются целыми участками мтДНК, то есть активно обновляются и регенерируют. А если повреждения зашли слишком далеко, то такие митохондрии могут самоуничтожаться, запуская интенсивный процесс образования новых органелл.
Ученые уже знают, что одним из стимуляторов этой митохондриальной динамики служит вещество под названием уролитин А. Следовательно, обеспечив его приток, можно усилить процессы обновления и восстановления митохондрий. Удобнее всего это делать посредством функциональных продуктов здорового питания. В нашей стране такие продукты выпускает, например, компания VILAVI.
Тут есть одна сложность: сам по себе уролитин А не встречается ни в одном источнике питательных веществ. Однако его эффективно производит наша собственная микрофлора из эллаговой кислоты. А эта кислота получается в результате переваривания в нашем желудке соединений, относящихся к классу эллаготаннинов. Именно такими эллаготаннинами и богат функциональный продукт компании VILAVI, названный T8 Era Mit Up. Его употребление в качестве профилактического средства поможет вам сохранить здоровье митохондриального пула клеток, а значит, обеспечить себя достаточным количеством энергии для успешной работы и полноценного отдыха.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Митохондрии: энергостанции нашего организма
На молекулярном уровне наш организм можно рассматривать как своеобразный биологический механизм. Очень сложную, многогранную, но, тем не менее, машину, принципы работы которой мы сегодня начинаем понимать все лучше и лучше. И один из этих принципов является по-настоящему фундаментальным: никакая машина не сможет работать без притока энергии.
Для более простых механизмов этот принцип нам понятен, что называется, на интуитивном уровне. Двигатель автомобиля получает энергию, сжигая топливо в баке, телевизор использует энергию тока в розетке и так далее. Но вот с нашей собственной биологической машиной – нашим телом – все не так очевидно. То есть, наверняка наш читатель знает, что мы берем энергию из пищи (и об этом мы уже рассказывали более подробно). Но вот как именно это происходит? Где и как в нашем теле условные углеводы или жиры превращаются в ту движущую силу, которая необходима для всех без исключения процессов, протекающих в организме?
Клеточные «электростанции»
Основные объемы энергии в человеческом теле вырабатываются внутри отдельных клеток. Можно сказать, что каждая из них самостоятельно отвечает за собственное энергоснабжение. А это значит, что в каждой клетке (как минимум в тех клетках, которые имеют ядра, эритроциты не в счет), должна быть своя «электростанция». И это действительно так! Более того, нередко таких «электростанций» имеется несколько десятков или даже сотен. Зависит их число от того, насколько интенсивно работает клетка, а значит, и от того, насколько много ей требуется энергии в единицу времени. Научное название таких «электростанций» – митохондрии, а их совокупность именуют митохондриальным пулом клетки.
Как появились митохондрии?
Один из важных вопросов, который давно беспокоил научную общественность: а откуда вообще взялись митохондрии в наших клетках? Самая современная и достоверная теория предлагает крайне необычный ответ: митохондрии – это потомки бактерий.
Давным-давно одноклеточные организмы, которым предстояло стать нашими предками, научились поглощать крохотные бактерии, присутствующие в окружающей среде. Если попросту – они ими питались. Но в один прекрасный день такая протобактерия не разрушилась, попав во внутриклеточную среду. И более того, она сохранила не только целостность, но и кое-какие свои функции. В частности, способность вырабатывать энергию с помощью кислорода. Каков до этого был механизм получения энергии у тех одноклеточных, которые впоследствии станут нами, известно плохо. Но с уверенностью можно сказать, что аэробный путь, предложенный им проглоченной бактерией, был однозначно более выгодным и эффективным.
Результатом этого удивительного события стал внутриклеточный симбиоз. Бактерия вырабатывала много энергии, а одноклеточный организм-хозяин снабжал ее достаточным количеством кислорода и других необходимых соединений. Со временем протобактерия упростилась, видоизменилась и стала необходимой клеточной органеллой. Этот союз оказался настолько успешным, что сейчас на нем построено энергоснабжение практически всех эукариотических клеток растений, грибов и животных. В том числе и нас с вами [1].
Как устроены митохондрии?
Многое в строении митохондрий до сих пор напоминает о том, что когда-то они были самостоятельными бактериями. Так, например, они окружены внешней липидной мембраной – такую мембрану имеют и все остальные клетки нашего организма. Основная функция внешней мембраны – защита митохондрии, отграничение ее от окружающей внутриклеточной среды, а также транспортировка необходимых веществ внутрь и выведение результатов ее работы наружу [2].
Внутреннее пространство митохондрии занимает матрикс. Это жидкая среда, состоящая из смеси жирных кислот, белков, рибосом и других соединений. В матриксе проходит первая стадия кислородного дыхания, то есть, выработки энергии. Кроме того, здесь находится и еще одно свидетельство прошлой самостоятельности митохондрий – митохондриальная ДНК. Да, оказывается, не весь наш генетический материал помещен в клеточное ядро! Эти небольшие кольцевые митохондриальные ДНК (мтДНК) кодируют 13 белков, которые нужны для работы самой митохондрии. В основном это ферменты, участвующие в дыхательной цепи окисления водорода [3].
Что еще интересно: люди наследуют мтДНК исключительно по материнской линии, а мтДНК, полученная от сперматозоида, разрушается сразу после оплодотворения [4]. Эта «женская» мтДНК мутирует по очень четким законам и поэтому можно отследить то, как именно она изменялась с течением времени. Ряд исследований последних лет убедительно доказал, что примерно 200 000 лет назад в Африке жила женщина, от которой свою мтДНК получило все современное человечество. Ученые поэтически назвали эту женщину «митохондриальной Евой» [5].
Наконец, между внешней мембраной и матриксом имеется и вторая, внутренняя мембрана. Она очень неровная и образует кристы – длинные складки, направленные к центру митохондрии. Именно их – как темные полосы – видели первые исследователи XIX века. На внутренней мембране как раз и происходит запасание энергии в виде молекул аденозинтрифосфата (АТФ). В процессе этого потребляется более 80% того кислорода, который попадает в нашу кровь при дыхании [6].
Чем еще заняты наши митохондрии?
Основная функция этих органелл – обеспечение энергией всех протекающих в клетке процессов. Однако, помимо этого митохондрии выполняют и еще целый ряд витальных (жизненно важных) функций. В их числе:
Опираясь на данные современных исследований, можно смело утверждать, что митохондрии, во-первых, активно участвуют во внутриклеточных процессах, а во-вторых, влияют и на физиологию всего организма. Такая «широкая специализация» стала причиной того, что нарушения работы митохондрий сегодня рассматривают как одну из важных причин появления множества заболеваний [12].
Что будет при нарушении работы митохондрий?
Очевидно, что самым первым и самым ярким проявлением дисфункции митохондрий будет уменьшение выработки энергии в клетке. На клиническом уровне такое обстоятельство может проявляться по-разному. И больше всего пострадают те ткани, которые работают максимально активно, а значит, требуют наибольшего притока энергии [13]:
Кроме того, учитывая другие функции митохондрий, о которых мы рассказывали выше, их неправильная работа может становиться фактором риска развития многих нарушений [14]:
Как улучшить работу митохондрий?
На настоящий момент предложены две стратегии того, как улучшить функции митохондриального пула. Первая связана с тем, что митохондрии, как органеллы, не статичны. Они могут сливаться, делиться, увеличиваться и уменьшаться в размерах, а также обмениваться своим генетическим материалом [15]. Это тоже своеобразное «наследие» их бактериального прошлого. В ходе таких слияний и делений поврежденные участки митохондрий и мтДНК отсеиваются и распадаются. Итогом становится образование новых, полноценных митохондрий, которые намного лучше выполняют все свои функции. То есть, благодаря этим процессам происходит обновление всего митохондриального пула клетки [16].
Мы имеем возможность ускорить это обновление. В частности, таким действием обладает функциональный продукт здорового питания под названием T8 ERA MIT UP, который недавно выпустила на рынок компания VILAVI INT LTD. В этом продукте содержится концентрат гранатового сока, который богат веществами под названием эллаготаннины [17]. Попадая в наш желудок, они быстро распадаются с образованием эллаговой кислоты, а ее, в свою очередь, перерабатывают кишечные бактерии, производя уролитин А [18]. Это соединение как раз и стимулирует митохондрии активнее обновляться путем слияния и деления. Уже есть исследования, которые показывают, что дефицит уролитина А – важный фактор преждевременного старения [19]. Помимо этого, доказано, что приток этого вещества увеличивает сопротивляемость физическим и умственным нагрузкам как раз за счет улучшения выработки энергии в митохондриях [20].
Вторая стратегия основана на защите митохондрий от разрушающего воздействия оксидативного стресса. Как мы уже говорили, в ходе выработки энергии они также синтезируют активные формы кислорода. Это молекулы-суперокислители (они же – свободные радикалы), которые играют сигнальную роль. Но, помимо этого, они обладают и немалой химической агрессивностью, являясь основной причиной оксидативного клеточного стресса [21]. А еще один действующий компонент активной формулы T8 ERA MIT UP – комплекс SibXP, содержащий полипренолы, клеточный сок пихты и хвойную пасту CGNC. При этом полипренолы – это многоатомные спирты растительного происхождения, которые обладают выраженной антиоксидантной активностью. Именно это их свойство и важно для улучшения функции митохондрий. Полипренолы химически связывают свободные радикалы, не давая им повреждать митохондриальные мембраны и ферменты. Благодаря этому выработка энергии в клетке и поддерживается на необходимом уровне [22].
Источники
1. Evans A., Neuman N. The Mighty Mitochondria. Molecular Cell. 2016, March, 3, 61 (5): 641.
2. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
3. Gaston D., Tsaousis A.D., Roger A.J. Predicting proteomes of mitochondria and related organelles from genomic and expressed sequence tag data. Methods in Enzymology. 2009, 457: 21-47.
4. Al Rawi S., Louvet-Vallée S., Djeddi A., Sachse M., Culetto E., Hajjar C., Boyd L., Legouis R., Galy V. Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science. 2011, 334: 1144-1147.
5. Fu Q., Mittnik A., Johnson P.L., Bos K., Lari M., Bollongino R., Sun C., Giemsch L., Schmitz R., et al. A revised timescale for human evolution based on ancient mitochondrial genomes. Current Biology. 21 March 2013, 23 (7): 553–59.
6. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
7. Bock F.J., Tait S.W.G. Mitochondria as multifaceted regulators of cell death. Nature Reviews Molecular Cell Biology. 2020, February, 21 (2): 85-100.
8. Kornmann B. The endoplasmic reticulum-mitochondria encounter structure: coordinating lipid metabolism across membranes. Journal of Biological Chemistry. 2020, May, 26, 401 (6-7): 811-820.
9. Liu X., Hajnóczky G. Ca2+-dependent regulation of mitochondrial dynamics by the Miro-Milton complex. International Journal of Biochemistry and Cell Biology. 2009, 41: 1972-1976.
10. Murphy M.P. How mitochondria produce reactive oxygen species. Biochemistry Journal. 2009, 417: 1-13.
11. Clark A., Mach N. The crosstalk between the gut microbiota and mitochondria during exercise. Frontiers of Physiology. 2017, May 19, 8: 319.
12. Annesley S.J., Fisher P.R. Mitochondria in Health and Disease. Cells. 2019. July, 5, 8 (7): 680.
13. van der Giezen M., Tovar J. Degenerate mitochondria. Reports of European Molecular Biology Organization. 2005, June, 6, (6): 525-30.
14. Duchen M.R. Mitochondria in health and disease: perspectives on a new mitochondrial biology. Molecular Aspects of Medicine. 2004, August, 25 (4): 365-451.
15. Youle R.J., van der Bliek A.M. Mitochondrial fission, fusion, and stress. Science (New York, N.Y.), 2012, 337(6098), 1062–1065.
16. Ashrafi G., Schwarz T.L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death & Differentiation. 2013, January, 20 (1): 31-42.
17. Johanningsmeier S.D., Harris G.K. Pomegranate as a functional food and nutraceutical source. Annual Review of Food Science and Technology. 2011-02-28, 2 (1): 181–201.
18. Selma M.V., Beltrán D., Luna M.C., Romo-Vaquero M., García-Villalba R., Mira A., et al. Isolation of Human Intestinal Bacteria Capable of Producing the Bioactive Metabolite Isourolithin A from Ellagic Acid. Frontiers in Microbiology. 2017, 8: 1521.
19. D’Amico D., Andreux P.A., Valdés P., Singh A., Rinsch C., Auwerx J. Impact of the Natural Compound Urolithin A on Health, Disease, and Aging. Trends in Molecular Medicine, May 2021, S1471491421001180.
20. Ryu D., Mouchiroud L., Andreux P.A., Katsyuba E., Moullan N., Nicolet-Dit-Félix A.A., et al. «Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents». Nature Medicine. August 2016, 22 (8): 879–88.
21. Lin M.T., Beal M.F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 2006, October, 19, 443 (7113): 787-95.
22. Михайлова Е.А., Локошко Д.В., Большакова Е.М. Полипренолы и долихолы, как важный компонент антиоксидантной защиты фосфолипидных мембран. Обзор данных современной научной литературы. Современная Российская наука: актуальные вопросы, достижения и инновации: сборник статей II Всероссийской научно-практической конференции, Пенза, 07 мая 2021 года. С. 97-101.
Митохондрии – маленькие труженики или большие начальники?
Если вы думаете, что самая важная для нас история совместной жизни начинается во время свадьбы, то это совсем не так. Самая важная история совместной жизни каждого человека началась более миллиарда лет назад, когда наши далекие одноклеточные предки вынуждены были подписать «брачный контракт» с теми, кого мы сейчас называем митохондрии (см. теория симбиогенеза).
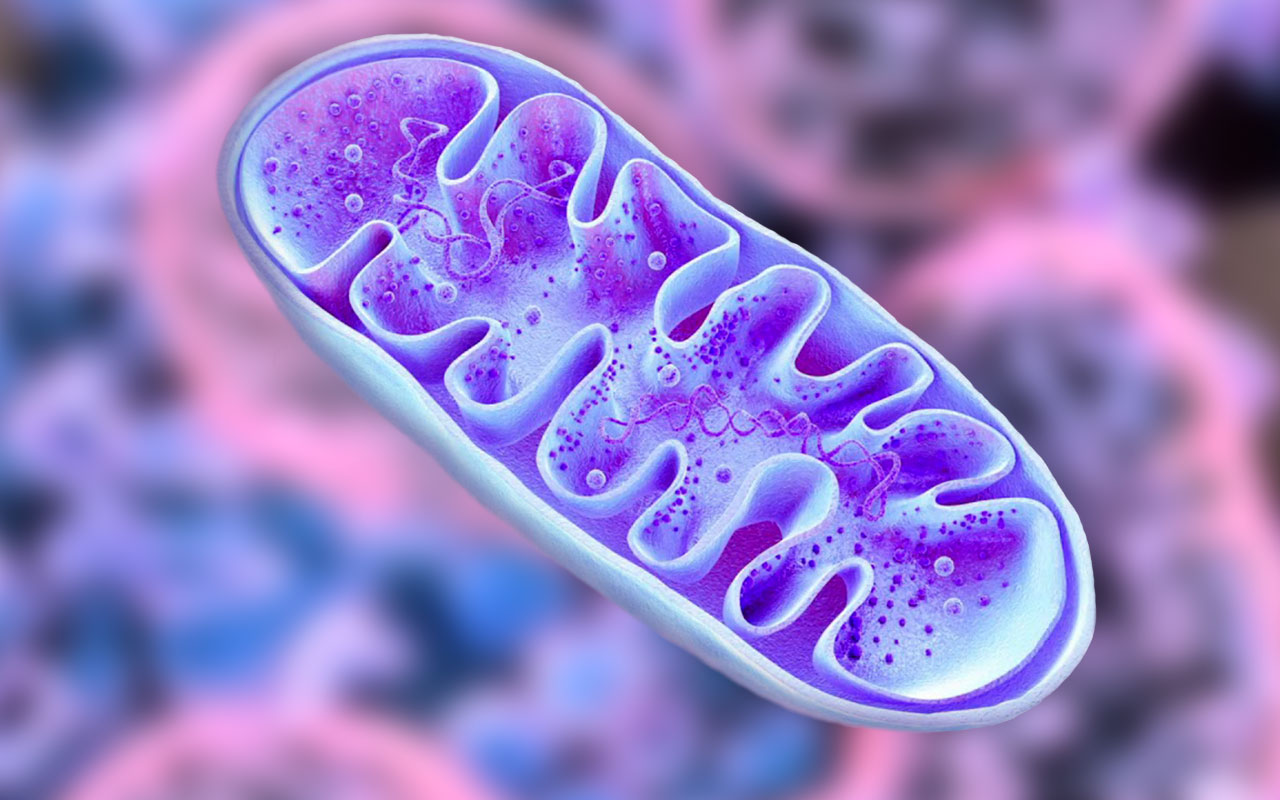
Митохондрии имеют две мембраны (внутреннюю и внешнюю) и собственный наследственный материал в виде ДНК (рис.1). На внутренней мембране митохондрий находится система окислительного фосфорилирования, работа которой обеспечивает окисление энергетических субстратов с образованием АТФ.
Рис. 1. Схематическое строение митохондрии
«Как белка в колесе» — динамика митохондрий
Не вся вина за метаболические нарушения лежит на нашем переедании. Метаболические нарушения связывают, в первую очередь, с неспособностью митохондрий справиться с питательными веществами. Митохондриям в клетке приходится нелегко. Мы «кормим» свои клетки то слишком много, то слишком мало, а предъявляем им «заявку» выдать энергию в виде АТФ, количество которой точно должно соответствовать нашим потребностям. Для того чтобы регулярно «выкручиваться» из этой ситуации митохондрии и правда используют некоторые «движения» — деление (fission) и слияние (fusion). Эти «митодвижения» объединяют под названием «динамика митохондрий». Баланс между делением и слиянием митохондрий — центральный механизм биоэнергетической адаптации к метаболическим потребностям клетки [2, 3].
Больше всего митохондрий находится в тканях с высокими энергетическими потребностями, — мышцы, печень, бурая жировая ткань, мозг. Неудивительно, что и динамика митохондрий в этих тканях изучена лучше.
Итак, если в клетку какой-либо из этих тканей (кроме некоторых нейронов в мозге, об этом потом) поступает большое количество питательных веществ (поступление превышает затраты), то митохондрии находятся в разделенном (фрагментированном) состоянии. Если клетка находится в состоянии голода (поступления меньше затрат), то происходит слияние митохондрий и они находятся в соединенном состоянии. [3,4]. Так поддерживается гомеостаз клетки (рис.2).

Рис. 2 Регулирование морфологии и биоэнергетической эффективности митохондрий в ответ на избыточное или недостаточное поступление питательных веществ [из 2]
Клеточный метаболический гомеостаз зависит от баланса между потреблением питательных веществ и их расходом. Перемены в поставке питательных веществ приводит к клеточным адаптациям для восстановления баланса. Избыток питания приводит к фрагментации митохондриальной сети, что вызывает снижение биоэнергетической эффективности митохондрий. Это позволит избежать потерь энергии. Напротив, при метаболическом голоде митохондрии удлиняются, чтобы увеличить свою биоэнергетическую эффективность.
В чем хитрость этих движений? Если клетка находится в состоянии голода, то слияние митохондрий позволяет увеличить их биоэнергетическую эффективность (количество АТР, которое создается на молекулу питательного вещества). Если же в клетку поступает избыток питательных веществ, то их можно либо 1) запасти, либо 2)рассеять эту энергию в виде тепла. Задача митохондрий в этом случае, — рассеять больше энергии в виде тепла, запасти меньше в виде АТФ (накопление NADH и АФК приведет к окислительному стрессу). Фрагментация митохондрий позволяет им снизить биоэнергетическую эффективность, главным механизмом снижения которой считается «утечка» протонов.
Так что, мы ходим на работу, а жизнь митохондрий постоянно протекает в режиме цикла деления и слияния (рис 3).

Рис.3 Баланс энергопотребления и энерогообеспечения связан с соответствующими изменениями архитектуры митохондрий и их биоэнергетической эффективностью [из 3]
Физиологические процессы, связанные с увеличением спроса на энергию и снижением энергопоставок, (например, острый стресс, голодание и фаза G1/S) характеризуются удлинением митохондрий и дыханием, связанным с синтезом АТФ. С другой стороны, физиологические процессы, связанные с уменьшением спроса на энергию и увеличением ее поставок (высокий уровень питательных веществ, ожирение и диабет типа 2), связаны с фрагментацией митохондрий, выделением тепла или снижением функции митохондрий.
Здоровые циклы деления и слияния – залог метаболического здоровья клетки
Нормальный цикл деления митохондрий и их слияния является ключевым звеном контроля их качества. Почему? При делении митохондрий образуется две дочерние, одна из которых имеет более высокий мембранный потенциал и идет дальше в цикл слияния-деления, а другая, с более деполяризованной мембраной, остается отделенной до восстановления мембранного потенциала. Если потенциал восстанавливается, — она воссоединяется с митохондриальной сетью. Если она остается деполяризованной, то она элиминируется в процессе аутофагии, что является залогом качества пула митохондрий (рис.4).
Длительное ингибирование деления митохондрий (при длительном клеточном голодании) приводит к накоплению поврежденных митохондрий, которые не могут быть сегрегированы [3, 4].
С другой стороны, избыток питательных веществ приводит к ингибированию слияния митохондрий, что приводит к нарушению цикла митохондриальной динамики, увеличивает внутриклеточную митохондриальную гетерогенность. Да, при избытке еды фрагментация митохондрий протективна, однако длительная фрагментация, как и длительное слияние, вредна для контроля качества митохондрий. Не происходит селективного удаления, митохондриальная масса будет уменьшаться и состоять из небольших деполяризованных митохондрий.

Рис.4 Жизненный цикл митохондрий и его регулирование доступностью питательных веществ [из 3]
Митофузины – не просто какие-то белки
На молекулярном уровне слияние митохондрий является двухстадийным процессом, который требует координированного слияния внешней и внутренней мембран в ходе отдельных последовательных событий. У млекопитающих этот процесс регулируется тремя белками, которые относятся к GTPазам: Mfn1 и Mfn2 необходимы для слияния внешней мембраны, а ОРА1 – для слияния внутренней мембраны. Для деления нужны другие белки, — Fis1 и Drp1.
Роль белков-митофузинов была изучена в loss- and gain-of function studies. Мышки, мутантные по белкам-митофузинам, погибают еще в mid-gestation, потому что у них невозможным становится слияние митохондрий. Митофузины важны для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах блокирует запуск процесса аутофагии, потому что блокируется слияние аутофагосом с лизосомами. Истощение Mfn2 приводит к снижению потенциала мембран митохондрий, для компенсации происходит снижение работы дыхательной цепи, возрастает поглощение глюкозы и снижается синтез гликогена. Клетка переходит на анаэробный глиоклиз, а это – путь к онкологическому перерождению клетки. Дефицит Mfn2 приводит к нейродегенеративным изменениям. Повышение экспрессии Mfn2 в скелетных мышцах повышает их чувствительность к инсулину.
Mfn1 выполняет сходные функции, однако, вероятно, в других тканях (экспрессия Mfn2 и Mfn1 различается в разных тканях) – Mfn1 экспрессируется в большей степени в сердце, печени, поджелудочной, яичках, а Mfn2 в сердце, скелетных мышцах, мозге, бурой жировой ткани.
Таким образом митофузины являются ключевыми регуляторами динамики митохондрий. Экспрессия митофузинов различна в различных органах, они обеспечвают биоэнергетическую эффективность и механизмы адаптации к доступности питательных веществ, а также от них зависит «судьба» клетки. Не удивительно, что митохондриальные fusion белки являются потенциальными таргетами фармакологических вмешательств [2, 5].
Гипоталамус, митохондрии, метаболическая дисфункция и старение
Динамика митохондрий важна во всех клетках. В бета-клетках поджелудочной железы митохондрии являются сенсорами питательных веществ и генераторами сигналов синтеза инсулина, в мышцах динамика митохондрий важна для регуляции метаболизма глюкозы и т.д. Однако человек не просто совокупность клеток разного типа, каждая из которых принимает самостоятельные решения. Организм – это система, у которой есть центральное регуляторное звено поддержания гомеостаза энергии и глюкозы. Этим главным регулятором является гипоталамус.
Гипоталамус расположен в промежуточном мозге и именно он обеспечивает взаимосвязь нервной и гуморальной систем регуляции. Нейроны гипоталамуса воспринимают, обрабатывают и реагируют на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин), и прочие гормональные стимулы (грелин, холецистокинин, панкреатический полипептид и др.). Гипоталамус управляет деятельностью эндокринной системы человека благодаря тому, что его нейроны способны выделять нейроэндокринные трансмиттеры, стимулирующие или угнетающие выработку гормонов гипофизом. Иными словами, гипоталамус, масса которого не превышает 5 % мозга, является центром регуляции эндокринных функций и поддержания гомеостаза всего организма.
Еще Дильман (Дильман В. М «Большие биологические часы») указывал на ведущую роль гипоталамуса в планомерном развитии метаболической дисфункции, приводящей к ожирению, сахарному диабету, сердечно-сосудистым, онкологическим заболеваням и старению. Согласно сформированной Дильманом теории гиперадаптоза чувствительность рецепторов гипоталамуса к сигналам, поступающим от тканей организма (лептин, инсулин и др.) постепенно планомерно снижается с возрастом. Для того, чтобы вызывать его «ответ» нужно все больше и больше того или иного гормона, — больше инсулина, больше лептина. Развивается инсулин- и лептинрезистентность, метаболические заболевания, приводящие к старению и смерти.
В зависимости от выполняемых функций группы нейронов объединяют в ядра гипоталамуса. Одно из них – аркуатное (дугообразное) ядро является ключевым регулятором пищевого поведения и обмена веществ. В нем могут образовываться орексигенные нейропептиды (стимулируют аппетит) и анорексигенные (подавляют аппетит), относящиеся, соответственно к AgRP и POMC нейронам. Периферические сигналы (инсулин, грелин, лептин и др) влияют на экспрессию пептидов, стимулирующих либо подавляющих аппетит, что обеспечивает слаженность центральной регуляции (рис.5).
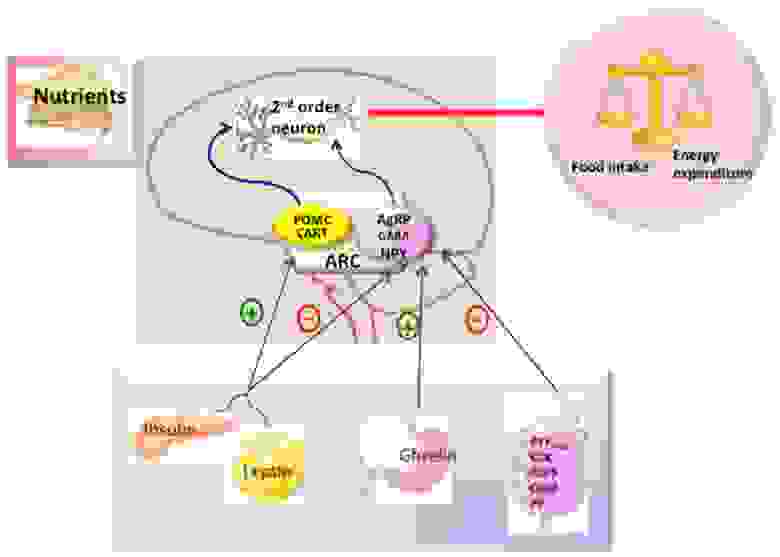
Рис. 5. Гипоталамический контроль метмболизма энергии. Мозг интегрирует метаболические сигналы (лептин, инсулин, грелин, PYY3-36) от периферических тканей, таких как поджелудочная железа, жировая ткань, желудок. В мозге специализированные нейронные сети координируют адаптивные изменения в поглощении и расходе пищи [из 5].
Так кто и как регулирует чувствительность нейронов гипоталамуса?
Изучение динамики митохондрий в тканях мозга показало, что динамика митохондрий играет существенную роль в способности нейронов гипоталамуса контролировать уровень глюкозы и гомеостаз энергии в организме [6,7,8].
В AgRP нейронах (hunger-promoting AgRP neurons), которые стимулируют аппетит и регулируют набор массы, голодание приводит к делению митохондрий, а high-fat feeding – к слиянию. То есть ответ митохондрий отличается от такового в большинстве других клеток.
Слияние МХ в этих нейронах регулирует электрическую активность в ответ на высокожировую диету, стимулируя выработку орексигенного пептида (AgRP пептида) оно необходимо для набора веса и отложения жира при избытке питательных веществ. Делеции Mfn1 и Mfn2 в этих нейронах приводили к меньшему набору веса у крыс за счет снижения уровня циркулирующего лептина.
РОМС нейроны (подавляют аппетит) имеют противоположную функцию, и динамика митохондрий в ответ на поступление питательных веществ у них иная. Снижение экспрессии митофузинов в этих нейронах приводит к нарушению связи митохондрий с ЭПС, а в результате – гиперфагия, лептинрезистентность и ожирение. При этом возрастало употребление пищи, а энергозатраты снижались.
Таким образом, ответ организма на высокожировую диету зависит от паттернов динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает их ответ на поступление в организм питательных веществ, стимулирует выработку нейропептидов, которые будут либо стимулировать либо подавлять аппетит, влияя на метаболизм на уровне организма (Рис.6).

Рис.6. Метаболическая адаптация к стимулам окружающей среды [из 2]
В ответ на экзогенные стимулы Mfns вовлечены в трансдукцию метаболического сигналинга в разных органах, что обеспечивает поддержание гомеостаза энергии всего организма. В частности, в ответ на потребление пищи, изменения температуры, стресс или физические упражнения, бурая жировая ткань, мозг, сердце или скелетные мышцы адаптируют свой метаболизм для контроля питания, веса тела, сократительных функций, антиоксидантного ответа или чувствительности к инсулину.
Как повлиять на динамику митохондрий?
1. Питание и физические упражнения
Циклы питания Избыток пищи и высокожировая диета (HFD) ингибирует слияние митохондрий в клетках (в некоторых нейронах мозга механизм иной). Незавершенный цикл деления-слияния митохондрий нарушает процессы аутофагии → увеличивается внутриклеточная гетерогенность митохондрий → не происходит селективного удаления митохондрий → накапливаются митохондрии с дисфункцией.
Calorie restriction (fed/fasting cycle) стимулирует биоэнргетическую адаптацию, обеспечивая работу механизмов качества митохондрий.
2. Здоровые мембраны: стеариновая кислота, кардиолипин, фосфатидная кислота
От «здоровья» мембран митохондрий зависят все ключевые процессы, — аутофагия, митофагия, апоптоз, связь митохондрий с эндоплазматической сетью, динамика митохондрий. Мембраны клеточных органелл состоят из липидов и из белков. Ремоделирование этих мембран контролируется взаимодействиями между специфическими липидами и белками.
К насыщенным жирным кислотам относится пальмитиновая (С16) и стеариновая (С18). Показано, что употребление стеариновой кислоты (C18:0) стимулирует процесс слияния митохондрий. Действие ее связано с влиянием на митофузины. У мышей диетические добавки стеариновой кислоты могут частично восстанавливать митохондриальную дисфункцию, вызванную мутациями в генах Pink1 или parkin. В нейтрофилах людей, находящихся 2 дня на low-С18:0 диете, митохондрии находятся во фрагментированном состоянии (50% клеток имели фрагментированные МХ, 10 % соединенные МХ). Употребление стеариновой кислоты приводило у них к слиянию митохондрий через 3 часа [8]. Таким образом., стериновая кислота важна для поддержания циклов динамики митохондрий. Больше всего стеариновой кислоты находится в какао-бобах (31-34 %).
Фосфолипиды – основные компоненты мембран органелл. Они также регулируют динамику митохондрий, при этом их влияние различно [9].
Кардиолипин (СL) стимулирует деление митохондрий и слияние внутренних мембран.
Кардиолипин необходим для работы комплекса IV (цитрохром С оксидазы) электронтранспортной цепи. Кардиолипин находится практически исключительно во внутренней мембране митохондрий. С возрастом происходит снижение количества кардиолипина. Есть теория, что потеря функции кардиолипина связана с заменой насыщенных жирных кислот в его молекуле полиненасыщенными жирными кислотами. Для решения этого вопроса необходимо вводить в рацион насыщенные жиры, богатые, в первую очередь, стеариновой жирной кислотой.
Для повышения эффективности доставки насыщенных жирных кислот в мембрану возможно использование переносчиков. Например, – использование насыщенного фосфатидилхолина (дипальмитофосфатидилхолин и дисероилфосфатидилхолин), который, потенциально, сможет доставить насыщенные ЖК прямо в кардиолипин [10]. Холин, как переносчик, легко проходит через цитозоль и поступает в митохондрии.
Фосфатидная кислота (РА) ингибирует митохондриальное деление и стимулирует слияние внешних мембран (рис.7).
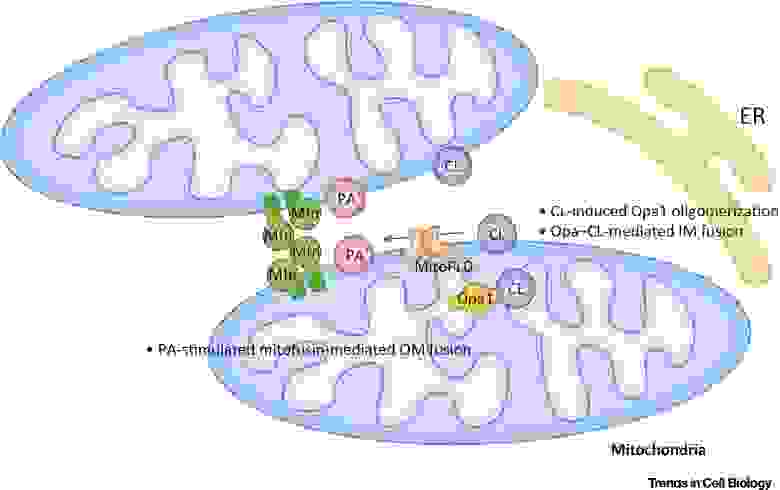
Рис.7 Регулирование слияния митохондрий фосфатидной кислотой (PA) и кардиолипином (CL) [из 9].
Во внешней мембране (ОМ) РА стимулирует митофузин-опосредованное (Mfn) слияние. Во внутренней мембране (IM) CL стимулирует Opa1-опосредованное слияние. Сокращения: ER — эндоплазматический ретикулум; MitoPLD,- митохондрия-локализованная фосфолипаза D.
3. Регуляция экспрессии митофузинов (белков, отвечающих за динамику митохондрий)
Все, о чем мы говорили выше (сalorie restriction, стеариновая кислота, фосфолипиды) действуют, влияя на экспрессию митофузинов.
Помимо этого, есть ряд препаратов, которые опосредованно могут влиять на динамику митохондрий. К ним можно отнести использование метформина.
Наиболее интересным является использование веществ, которые способны напрямую влиять на экспрессию митофузинов. Одним из потенциальных препаратов назван лефлюномид (leflunomide), который был одобрен FDA [5,11]. Он является индуктором экспрессии Mfn1 и Mfn2, а зарегистрирован был как препарат для лечения ревматоидного артрита.
Генная терапия митохондрий
Нарушение динамики митохондрий может быть связано с нарушением экспрессии белков, отвечающих за слияние и деление митохондрий. Помимо этого, нарушение функции этих белков может быть связано (и это и происходит чаще всего) с их мутациями. Тут есть два подхода к рассмотрению причинно-следственных взаимодействий нарушения функции митохондрий.
Ранее считалось, что образ жизни, в том числе переедание, приводит к образованию свободных радикалов, окислительному стрессу, мутациям митохондриального генома и, последовательно, нарушениям функциии митохондрий. Однако, в последнее время есть убедительные доказательства того, что мутации митохондриальной ДНК неизбежны, есть у всех (heteroplasmic DNA point mutations) и связаны с ошибками репликации, а не с оксидативными повреждениями, к которым митохондриальная ДНК довольно устойчива [12]. Уже на этапе оплодотворенной яйцеклетки часть наших митохондрий несут мутации. Со временем они делятся, мутантных митохондрий становится больше, они не могут нормально выполнять свою функцию.

Рис. 8 Клональное экспансия мутированных молекул мтДНК может приводить к митохондриальной дисфункции или может быть «спасено» компенсационным биогенезом [из 12].
Тут очень кстати можно было бы использовать редактирование генома митохондрий in vivo. Было показано, что для heteroplasmic DNA point mutations у мышей уже был достигнут значительный успех при помощи targeted zinc-finger nucleases (mtZFN) с доставкой при помощи аденовирусного вектора [13].
Перенос митохондрий
Другой многообещающий метод устранения дисфункции митохондрий – это трансплантация митохондрий. Суть этого подхода сводится к «замене» поврежденных митохондрий здоровыми экзогенными митохондриями. Впервые данный подход был использован клинически у детей с ишемией миокарда. Для трансплантации использовали аутологичные изолированные митохондрии, которые изолировали при прямой мышцы живота (делали биопсию, а затем готовили препарат), а затем вводили путем прямой инъекции [14]. Прорабатываются различные подходы введния митохондрий: прямое инъецирование изолированных митохондрий (локальное введение) и системное введение в кровоток, когда митохондрия сама «ищет» в какую клетку ей отправиться. Группы исследователей изучают возможность трансплантации митохондрий при болезни Паркинсона, ишемии печени, инсульте, митохондриальных заболеваниях [15].
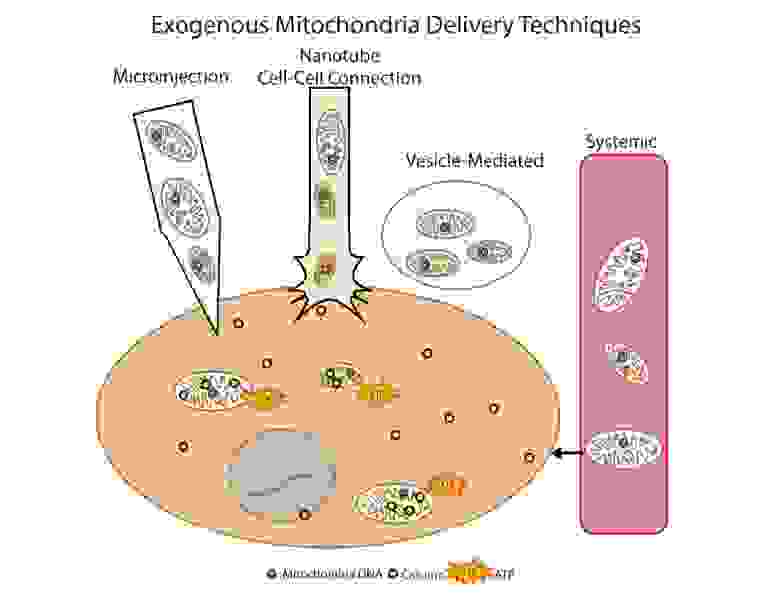
Рис.9 Способы доставки экзогенных митохондрий в клетку