Для чего нужна среда эндо
ЭНДО СРЕДА
ЭНДО СРЕДА (S. Endo, японский бактериолог, 1869—1937) — дифференциально-селективная среда для выделения бактерий кишечной группы.
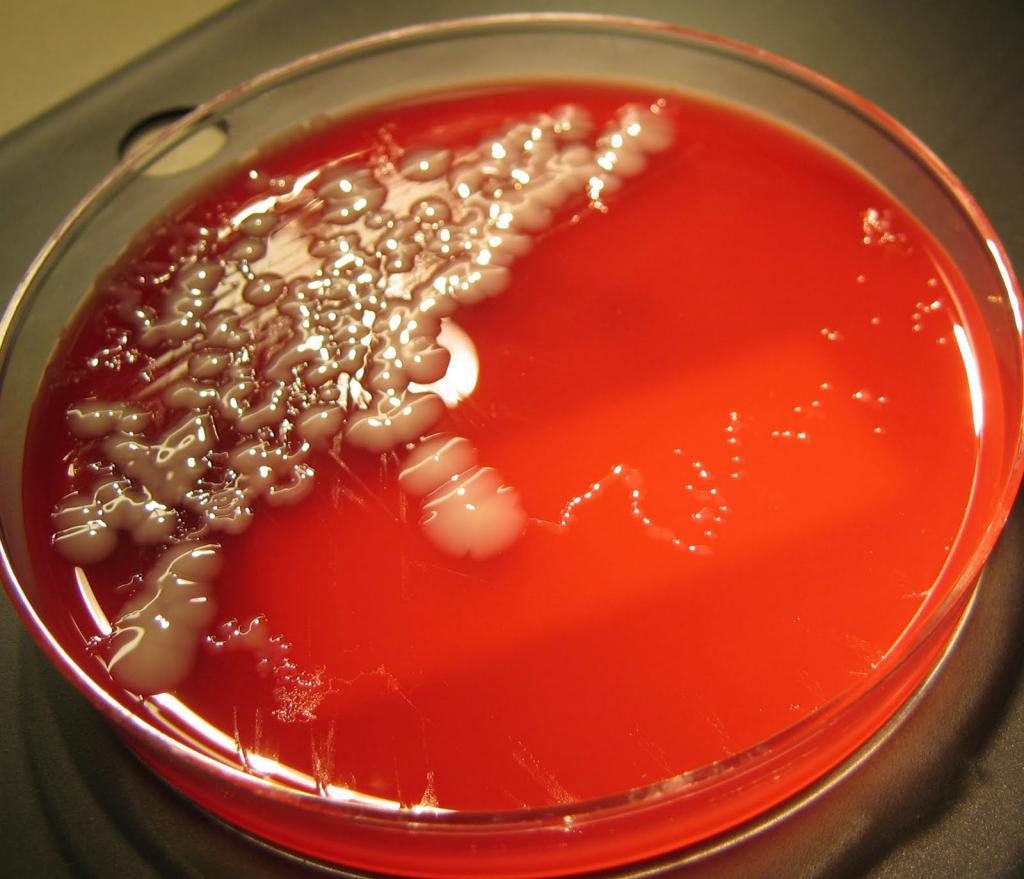
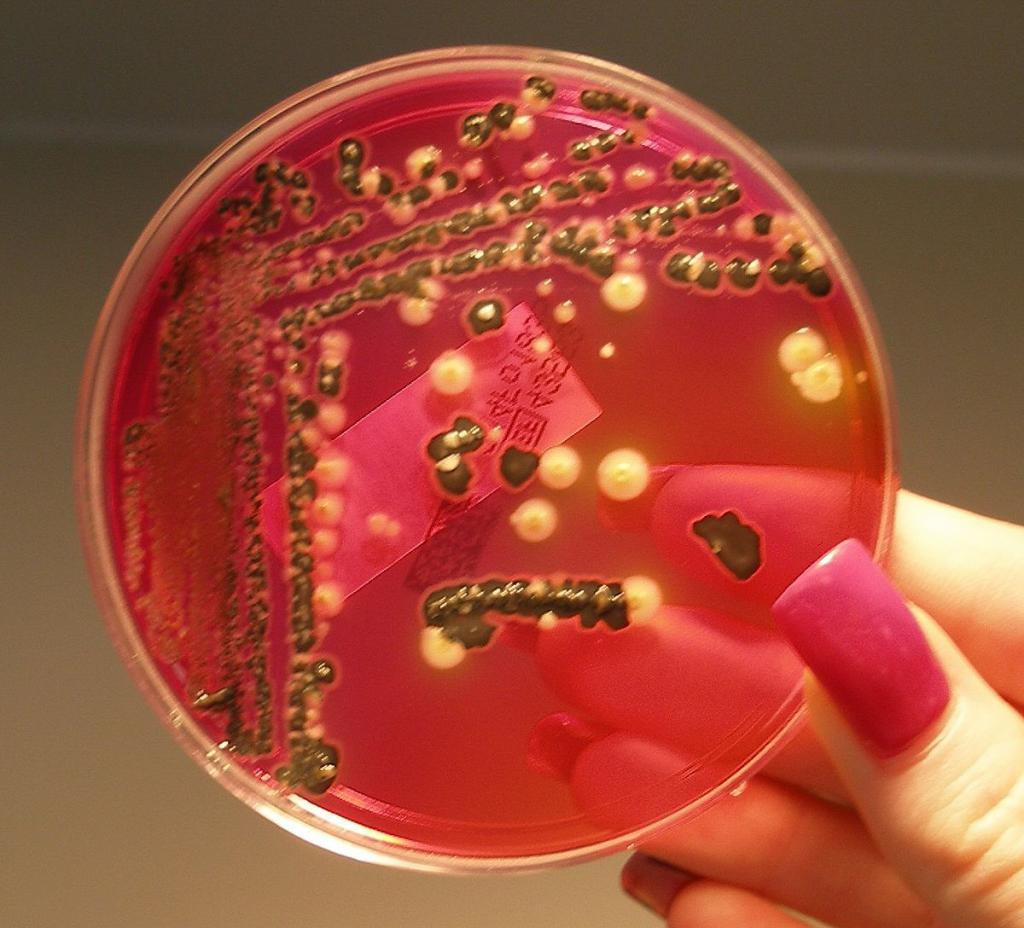
Предложена в 1904 году японским бактериологом Эндо. Эндо среда применяется при бактериологических исследованиях материала (преимущественно испражнений), взятого у обследуемых лиц, и санитарно-бактериологических исследованиях объектов окружающей среды — воды, пищевых продуктов, сточных жидкостей, смывов с предметов больничной обстановки и предприятий общественного питания. Эндо среда позволяет отличать грамотрицательные бактерии, разлагающие лактозу, от других бактерий, не разлагающих этот углевод. При расщеплении лактозы бактериями образуются продукты промежуточного распада — альдегиды, которые восстанавливают основной фуксин, ранее обесцвеченный сульфитом натрия. В результате данного процесса колонии бактерий, разлагающих лактозу, окрашиваются в красный цвет, часто с металлическим оттенком. Фуксин действует бактериостатически на грамположительные бактерии, но некоторые, например, энтерококки, развиваются на Эндо среде в виде мелких розовых колоний. Для устранения роения протеев (распространения бактерий по всей поверхности среды) к Эндо среде прибавляют кристаллический фиолетовый, бриллиантовый зеленый, в ряде случаев — этиловый спирт в небольших концентрациях или увеличивают концентрацию фуксина.
В качестве питательной основы Эндо среду используют различные сорта пептона или обычный мясопептонный 2% агар. В 100 мл растопленного стерильного агара вносят 1 мл 3% спиртового раствора фуксина, 5 мл 2,5% водного раствора безводного сульфита натрия и 1 г лактозы, растворенной в небольшом количестве воды. Приготовленную среду размешивают и разливают в чашки. Существуют также другие способы приготовления Эндо среды, однако многие из них утратили значение. В настоящее время широко применяют сухой порошковый препарат Эндо среды.
Библиогр.: Корш Л. Е. и Артемова Т. Е. Ускоренные методы санитарнобактериологического исследования воды, М., 1978; Методы санитарно-микробиологического исследования объектов окружающей среды, под ред. Г. И. Сидоренко, М., 1978; Санитарная микробиология, под ред. Г. П. Калины и Г. Н. Чистовича, М., 1969; Endo S. tjber ein Verfahren zum Nach-weis der Typhusbacillen, Zbl. Bakt., I. Abt. Orig., Bd 35, S. 109, 1904.
Среда Эндо
Среда Эндо — дифференциально-диагностическая питательная среда, предназначенная для выделения Esherichia coli. Названа по имени предложившего её японского бактериолога Сигеру Эндо (1869—1937). Обладает слабыми селективными свойствами, компоненты среды подавляют рост грамположительных бактерий.
Содержание
Состав
Принцип действия
Фуксин обесцвечивается сульфитом натрия (образуется бесцветная фуксинсернистая кислота — реактив Шиффа [1] ). Энтеробактерии, сбраживающие лактозу, в процессе брожения выделяют муравьиную кислоту, которая даёт цветную реакцию с реактивами на альдегиды, в том числе и с фуксинсернистой кислотой с образованием свободного фуксина, в результате чего их колонии окрашиваются в малиново-красный цвет с металлическим блеском или без него. Колонии бактерий, не сбраживающих лактозу, имеют белый или слабо-розовый цвет (цвет питательной среды).
См. также
Примечания
Ссылки
Полезное
Смотреть что такое «Среда Эндо» в других словарях:
Среда эндо — … Википедия
питательная среда Эндо — см. Эндо среда … Большой медицинский словарь
Эндо агар — плотная дифференциально диагностическая среда, используемая для выделения и первичной идентификации энтеро бактерий. Выпускается в готовом виде. Состоит из питательного агара, лактозы, основного фуксина, натрия сульфита и натрия фосфата. Э.а.… … Словарь микробиологии
Эндо среда — (S. Endo, 1869 1937, японский бактериолог) плотная дифференциально диагностическая питательная среда для выделения патогенных энтеробактерий, содержащая мясопептонный агар, лактозу и насыщенный основной фуксин, обесцвеченный сульфитом натрия … Большой медицинский словарь
Пита́тельная среда́ — ( ые) ( ы) искусственный субстрат, представляющий собой сбалансированную смесь питательных веществ в концентрациях и сочетаниях, необходимых для роста и деления микроорганизмов или клеток высших организмов. Питательная среда Адамса см. Адамса… … Медицинская энциклопедия
Рапопорт среда — среда обогащения, применяемая для выделения сальмонелл из крови. Для ее изготовления к 10% желчному бульону с рН 7,2 добавляют 2% глюкозы (предварительно разведенной в 5 мл дистил. воды) и 1% индикатора Андраде (или 0,1% бром крезолового… … Словарь микробиологии
ПИТАТЕЛЬНЫЕ СРЕДЫ — ПИТАТЕЛЬНЫЕ СРЕДЫ, искусственные среды того или иного состава, предназначенные для культивирования микробов и простейших в лабораторных условиях. Впервые были введены для изолирования отдельных видов бактерий Р. Кохом в 1881 году, что создало… … Большая медицинская энциклопедия
Анаэробные организмы — Аэробные и анаэробные бактерии предварительно идентифицируются в жидкой питательной среде по градиенту концентрации O2: 1. Облигатные аэробные (нуждающиеся в кислороде) бактерии в основном собираются в верхней части пробирки, чтобы поглощать… … Википедия
Посев (микробиология) — У этого термина существуют и другие значения, см. Посев. Культура микобактерий на яичной среде Левенштейна Йенсена … Википедия
САХАР — САХАР, углевод сладкого вкуса, имеющий широкое распространение в качестве питательного и вкусового вещества. Из различных видов С. наибольшее пищевое значение имеют: тростниковый (сахароза, свекловичный), виноградный (глюкоза, декстроза),… … Большая медицинская энциклопедия
Среда Эндо. Состав и приготовление питательной среды
Любой любитель микробиологии знает, что для культивирования какой-либо колонии необходима соответствующая питательная среда. При этом у каждой питательной среды есть свои особенности как в приготовлении, так и в использовании. Если же вы решили вырастить колонию энтеробактерий, тогда вам нужна будет среда Эндо. Вот именно этой среде и посвящена статья.
Что же это за питательная среда?
В чем же особенность данной среды?
Ни для кого не секрет, что в микробиологии существует понятие грамположительных и грамотрицательных бактерий. Так вот, если вы решили вырастить колонию грамотрицательных бактерий, для этого вам потребуется среда, которая будет ингибировать рост грамположительных бактерий. С этой функцией легко справится среда Эндо. Благодаря своим селективным свойствам она препятствует развитию грамположительных колоний.
Состав среды
Особенности любой среды зависят в первую очередь от ингредиентов. В состав среды Эндо входят:
Благодаря своей дешевизне в приготовлении среда Эндо пользуется широким спросом среди микробиологов-любителей.
Какой же принцип действия среды?
Сульфид натрия и фуксин, присутствующие в ее составе, способствует образованию реактива Шиффа. То есть сульфид натрия будет обесцвечивать фуксин. В результате этой реакции образуется фуксинсернистая кислота.
Всем известно, что колонии энтеробактерий способны сбраживать лактозу, в ходе этой реакции образуется муравьиная кислота. Из курса химии известно, что муравьиная кислота взаимодействует с альдегидами и дает качественную реакцию. Благодаря этому колонии энтеробактерий будут окрашиваться в розовато-малиновый цвет. Другие грамположительные бактерии (кроме энтеробактерий) не могут сбраживать лактозу, поэтому и окрашиваться они не будут.
В итоге на чашке Петри со средой Эндо, которая имеет розоватый цвет, будут выделяться лишь энтеробактерии в виде палочек малинового цвета. Все остальные колонии будут либо уничтожены, либо не будут выделяться на фоне питательной среды.
Приготовление питательного субстрата
В микробиологии среда Эндо одна из самых главных питательных сред. Чтобы приготовить самостоятельно такой субстрат, вам достаточно следовать нижеприведенный инструкции.
1. Приготовление бульона. Подойдет любое мясо или кости с остатками мяса, необходимо максимально удалить жир и сухожилия. Варим мясо примерно 20-25 минут при 100 градусах. После охлаждаем бульон до застывания капель жира.
2. Фильтруем полученный бульон через плотный ватный фильтр до абсолютной прозрачности. Следует отметить, что фильтрование через марлю нежелательно, так как есть риск попадания маленьких кусочков мяса.
3. Взвешиваем остальные ингредиенты. Нам необходимо составить сухую среду и приготовить реактив Шиффа. Для этого необходимо отвесить:
4. Добавляем фуксин в 30 мл воды, перемешиваем фуксин с водой. После чего добавляем концентрированный раствор сульфита натрия до исчезновения фуксинового цвета.
5. Выпадает осадок избытка фуксинсернистой кислоты, удаляем этот осадок фильтрованием.
6. В горячий бульон добавляем сухую среду.
7. Дожидаемся растворения и добавляем реактив Шиффа.
8. Полученный субстрат стерилизуем около 30 минут при температуре около 125 градусов.
Результаты посевов нужно держать около 5 дней, однако чем дольше вы их подержите, тем будет нагляднее результат колоний бактерий.
Эндоскопическое ультразвуковое исследование
На отделении эндоскопии НМИЦ онкологии им. Н.Н. Петрова исследования проводится с помощью современного ультразвукового комплекса Hitachi-Pentax. Среди дополнительных возможностей этого прибора есть такие как эластография (технология оценки эластичности тканей), цветовой и энергетический допплер (позволяют проследить кровоток в органе). Отделение оснащено ультразвуковыми эндоскопами с датчиками 2-х разных типов: радиальным (используется в целях диагностики) и конвексным (применяется для лечебных процедур).
Показания для выполнения ЭУС:


Эндосонография позволяет визуализировать опухоли поджелудочной железы небольших размеров (менее 3 см), недоступные для стандартного УЗИ и методов компьютерной диагностики, и более точно, чем ангиография, определить инвазию опухоли в сосудистые структуры, что крайне важно для определения возможности хирургического лечения.
Специалисты нашего отделения выполняют эндоУЗИ панкреато-билиарной области не только при доброкачественных или злокачественных новообразованиях, но также и кистах (с целью дифференциальной диагностики с кистозными неоплазиями), остром и хроническом панкреатите (при неясной клинической ситуации и невозможности с помощью прочих методов отличить воспалительные изменения от опухолевых).
Речь идет о дифференциальной диагностике образований желчного пузыря (полипы, аденомиоз, билиарный сладж, конкременты, воспалительные изменения стенки желчного пузыря) и выявлении патологии внепеченочных желчных протоков (опухоли, доброкачественные сужения, конкременты). Метод особенно важен для диагностики поражений терминальных отделов желчного и панкреатического протоков и Фатерова сосочка. Эти зоны малодоступны для других методов диагностики, а новообразования этой области (как доброкачественные, так и злокачественные) встречаются не редко.
Противопоказания для выполнения ЭУС:
Крайне тяжелое общее состояние пациента, которое не дает возможности проводить эндоскопическое исследование верхних отделов пищеварительного тракта без угрозы угнетения дыхания и сердечной деятельности.
Выраженные изменения свертывающей системы крови (если планируются оперативные манипуляции).
Технические ограничения для выполнения ЭУС
Если Вам выполнялись оперативные вмешательства на органах желудочно-кишечного тракта, а также имеются анатомические особенности строения пищевода или желудка, сообщите об этом доктору заранее и покажите выписные справки.
Как осуществляется исследование
Специалисты нашего отделения рекомендуют выполнять процедуру эндоУЗИ под общей анестезией, препараты для которой вводятся внутривенно, т.к. беспокойное поведение пациента может значительно затруднить работу врача и отрицательным образом повлиять на результат обследования.
После процедуры, выполняемой под наркозом, в течение одного часа у Вас может ощущаться сонливость, вялость. Когда вы полностью восстановитесь, врач обсудит с Вами результаты процедуры.
Оперативные вмешательства под эндоУЗИ-контролем
Как и другие эндоскопические процедуры, эндоУЗИ является безопасным исследованием и хорошо переносится. Однако, как и при других медицинских процедурах иногда возникают осложнения. Частота осложнений при эндоУЗИ без проведения тонкоигольной биопсии составляет около 1 случая из 2000 исследований, что сравнимо с частотой осложнений при ФГС.
Основными серьезными осложнениями могут быть:
Специалисты отделения эндоскопии настоятельно рекомендуют выполнять диагностическое исследование под внутривенной анестезией. Оперативные вмешательства под эндоУЗИ-контролем выполняются под наркозом в обязательном порядке. Для выполнения некоторых лечебных вмешательств может потребоваться госпитализация в стационар.
Для решения вопроса о выполнении оперативного вмешательства под эндоУЗИ-контролем необходима консультация заведующего отделением эндоскопии Ткаченко О.Б.
М-Агар Эндо
Эту среду используют для подсчета колиформных бактерий в воде двухэтапным мембранным методом.
Метод мембранных фильтров.
Рост на среде M-Endo Agar LES (M1106)
Escherichia coli
Состав**:
** Состав выверен и доведен до соответствия необходимым параметрам
Приготовление:
Размешать 51,0 г порошка в 980 мл дистиллированной воды. Прокипятить для полного растворения частиц. НЕ АВТОКЛАВИРОВАТЬ СРЕДУ. Остудить до 45°С и асептично добавить 20 мл 95%-ного этанола. Перемешать и разлить по 4 мл в чашки Петри диаметром 60 мм. При использовании больших чашек наливать такое количестве среды, чтобы образовался слой толщиной 1,5 мм. НЕ ДЕРЖАТЬ ЧАШКИ СО СРЕДОЙ НА СВЕТУ.
Предупреждение: основной фуксин является потенциальным канцерогеном, поэтому при обращении с ним следует избегать вдыхания порошка и попадания его на кожу.
Принцип и оценка результата:
Эта среда дана в прописи McCarthy, Delaney и Grasso (1) и используется для подсчета колиформных бактерий в воде (2).Метод мембранных фильтров для подсчета колиформных бактерий более достоверен и ценен, по сравнению с методом бродильных проб. Указанные выше авторы предложили использовать двухэтапный метод обогащения для уменьшения токсического воздействия окружающей среды на колиформные бактерии и повышения их выживания. Пропись данной среды основана на прописи Эндо, предложенной для дифференциации бактерий по способности ферментировать лактозу (3).
Гидролизат казеина, триптоза, пептический перевар животной ткани и дрожжевой экстракт служат источником необходимых питательных веществ (особенно, азотистых) для роста колиформных бактерий. Лактоза является ферментируемым субстратом. Натрия дезоксихолат, сульфит натрия и основной фуксин подавляют рост грамположительных микроорганизмов. Фосфаты придают среде буферные свойства. Колиформные бактерии ферментируют лактозу, формируют красные колонии и окрашивают в тот же цвет среду вокруг них. Микроорганизмы, не ферментирующие лактозу, образуют бесцветные колонии.
На первом этапе обогащения подложку смачивают Лаурил-триптозным бульоном ( М080 ). Мембранный фильтр, через который пропущена исследуемая вода, асептично накладывают на подложку и без переворачивания инкубируют 2 ч при 35°С во влажной камере. Затем фильтр асептично переносят на М-Агар Эндо в чашке и инкубируют при той же температуре в течение 24 ч. В другом варианте подложку для мембранного фильтра помещают на внутреннюю поверхность крышки чашки с М-Агаром Эндо, смачивают 2 мл Лаурил-трпитозного бульона ( М080 ) и инкубируют 1-1,5 ч при 35°С. На втором этапе подготовленный фильтр перекладывают прямо на поверхность агара и инкубируют, как описано выше. Через 24 инкубирования предположительно колиформные бактерии формируют золотисто-зеленые колонии с металлическим блеском.
Определение концентрации колиформных бактерий: отмечают общее количество колиформных бактерий на 100 мл исследуемой воды. При обнаружении на фильтре 20-80 колоний (но не более 200) можно экстраполировать результат исследования по следующей формуле.
Количество колиформных в 100 мл = кол-во колоний колиформ х 100 : кол-во профильтрованной воды.
Контроль качества:
Внешний вид порошка:
Гомогенный сыпучий розовый порошок.
Плотность готовой среды:
Образуется среда, соответствующая по плотности 1,5%-ному агаровому гелю.
Цвет и прозрачность готовой среды:
Среда имеет красную окраску, слегка опалесцирует, если в чашках Петри формируется гель.
Кислотность среды:
При 25°С водный раствор (5,1% вес/об с 2% об/об этанола) имеет рН 7,2 ± 0,2.
Культуральные свойства:
Ростовые характеристики референс-штаммов через 20-24 ч при 35°С.