Для чего нужно фосфорилирование
Фосфорилирование
Фосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента- донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию эфиров фосфорной кислоты [1] :
АТФ + R-OH 
В живых клетках фосфорилирование — один из наиболее распространённых видов посттрансляционной модификации белка. Процессы фосфорилирования и дефосфорилирования различных субстратов являются одними из важнейших биохимических реакций. Они катализируются особыми ферментами, выделяемыми в особый класс киназ, или иначе фосфотрансфераз.
Так, например, фосфорилирование или дефосфорилирование того или иного белка часто регулирует функциональную активность данного белка (усиливает ее или наоборот «выключает» данный белок функционально).
Фосфорилирование также необходимо для получения активных коферментных форм многих витаминов группы B. Например, при двойном фосфорилировании тиамина образуется кокарбоксилаза (кофермент фермента карбоксилазы), при фосфорилировании пиридоксаля (альдегидной формы витамина B6) — пиридоксаль-6-фосфат, являющийся коферментом многих ферментов обмена аминокислот, при фосфорилировании никотинамида (витамина PP) — никотинамиддинуклеотидфосфат (НАДФ), являющийся коферментом во многих важнейших окислительно-восстановительных реакциях и т. д.
Также с фосфорилирования гексоз начинается процесс гликолиза. Фосфорилирование АДФ обеспечивает запасание энергии в форме АТФ для ее последующего расходования. И это лишь малая часть реакций фосфорилирования, протекающих в живых клетках.
Фосфорилирование белков
Обратимое фосфорилирование боковых цепей аминокислот — широко распространённый способ регуляции активности ключевых белков клетки, в том числе ферментов и белков сигнальных путей. Считается, что фосфорилированию подвержено около трети всех белков эукариот.
Введение в молекулу белка остатка фосфорной кислоты, как правило, меняет её свойства. Это связано с химической природой фосфатной группы, которая может формировать водородные связи и электростатические взаимодействия с компонентами белковой молекулы. В результате может изменяться пространственная структура белка и, как результат, его активность и способность связываться с другими молекулами.
Фосфорилирование
Из Википедии — свободной энциклопедии
Фосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию сложных эфиров фосфорной кислоты [1] :
В живых клетках фосфорилирование — один из наиболее распространённых видов посттрансляционной модификации белка. Процессы фосфорилирования и дефосфорилирования различных субстратов являются одними из важнейших биохимических реакций. Они катализируются особыми ферментами, выделяемыми в особый класс киназ, или иначе фосфотрансфераз.
Так, например, фосфорилирование или дефосфорилирование того или иного белка часто регулирует функциональную активность данного белка (усиливает её или наоборот «выключает» данный белок функционально).
Фосфорилирование также необходимо для получения активных коферментных форм многих витаминов группы B. Например, при двойном фосфорилировании тиамина образуется кокарбоксилаза (кофермент фермента карбоксилазы), при фосфорилировании пиридоксаля (альдегидной формы витамина B6) — пиридоксаль-6-фосфат, являющийся коферментом многих ферментов обмена аминокислот, при фосфорилировании никотинамида (витамина PP) — никотинамидадениндинуклеотидфосфат (НАДФ), являющийся коферментом во многих важнейших окислительно-восстановительных реакциях и т. д.
Также с фосфорилирования гексоз начинается процесс гликолиза. Фосфорилирование АДФ обеспечивает запасание энергии в форме АТФ для её последующего расходования. И это лишь малая часть реакций фосфорилирования, протекающих в живых клетках.
Фосфорилирование
АТФ + R-OH → АДФ + R-OPO3H2В живых клетках фосфорилирование — один из наиболее распространённых видов посттрансляционной модификации белка. Процессы фосфорилирования и дефосфорилирования различных субстратов являются одними из важнейших биохимических реакций. Они катализируются особыми ферментами, выделяемыми в особый класс киназ, или иначе фосфотрансфераз.
Так, например, фосфорилирование или дефосфорилирование того или иного белка часто регулирует функциональную активность данного белка (усиливает её или наоборот «выключает» данный белок функционально).
Фосфорилирование также необходимо для получения активных коферментных форм многих витаминов группы B. Например, при двойном фосфорилировании тиамина образуется кокарбоксилаза (кофермент фермента карбоксилазы), при фосфорилировании пиридоксаля (альдегидной формы витамина B6) — пиридоксаль-6-фосфат, являющийся коферментом многих ферментов обмена аминокислот, при фосфорилировании никотинамида (витамина PP) — никотинамидадениндинуклеотидфосфат (НАДФ), являющийся коферментом во многих важнейших окислительно-восстановительных реакциях и т. д.
Также с фосфорилирования гексоз начинается процесс гликолиза. Фосфорилирование АДФ обеспечивает запасание энергии в форме АТФ для её последующего расходования. И это лишь малая часть реакций фосфорилирования, протекающих в живых клетках.
Связанные понятия
Упоминания в литературе
Связанные понятия (продолжение)
ГТФазы (англ. GTPases) — большое семейство ферментов гидролаз, которые связывают и гидролизуют гуанозинтрифосфат (GTP). Связывание и гидролиз GTP осуществляются в консервативном G-домене, сходном для всех ГТФаз.
Шаперо́н (англ. chaperones) — класс белка, главная функция которого состоит в восстановлении правильной нативной третичной или четвертичной структуры белка, а также образование и диссоциация белковых комплексов.
К мембранным белкам относятся белки, которые встроены в клеточную мембрану или мембрану клеточной органеллы или ассоциированы с таковой. Около 25 % всех белков являются мембранными.
Протеа́зы, протеиназы, протеолитические ферменты — ферменты из класса гидролаз, которые расщепляют пептидную связь между аминокислотами в белках. Кроме них, пептидную связь расщепляют также протеасомы.
Нуклеазы — большая группа ферментов, гидролизующих фосфодиэфирную связь между субъединицами нуклеиновых кислот. Различают несколько типов нуклеаз в зависимости от их специфичности: экзонуклеазы и эндонуклеазы, рибонуклеазы и дезоксирибонуклеазы, рестриктазы и некоторые другие. Рестриктазы занимают важное положение в прикладной молекулярной биологии.
Что такое фосфорилирование и как оно работает?
Фосфорилирование — это химическое присоединение фосфорильной группы (PO3 — ) к органической молекуле. Удаление фосфорильной группы называется дефосфорилированием. И фосфорилирование, и дефосфорилирование осуществляются ферментами (например, киназами, фосфотрансферазами). Фосфорилирование важно в областях биохимии и молекулярной биологии, потому что это ключевая реакция в функции белков и ферментов, метаболизме сахара, а также хранении и высвобождении энергии.
Цели фосфорилирования
Фосфорилирование играет важную регулирующую роль в клетках. В его функции входят:
Типы фосфорилирования
Многие типы молекул могут подвергаться фосфорилированию и дефосфорилированию. Три наиболее важных типа фосфорилирования — это фосфорилирование глюкозы, фосфорилирование белков и окислительное фосфорилирование.
Фосфорилирование глюкозы
Глюкоза и другие сахара часто фосфорилируются на первом этапе их катаболизма. Например, первая стадия гликолиза D-глюкозы — ее превращение в D-глюкозо-6-фосфат. Глюкоза — это небольшая молекула, которая легко проникает в клетки. Фосфорилирование образует более крупную молекулу, которая не может легко проникнуть в ткань. Итак, фосфорилирование имеет решающее значение для регулирования концентрации глюкозы в крови. Концентрация глюкозы, в свою очередь, напрямую связана с образованием гликогена. Фосфорилирование глюкозы также связано с сердечным ростом.
Фосфорилирование белков
Фебус Левен из Института медицинских исследований Рокфеллера был первым, кто идентифицировал фосфорилированный белок (фосвитин) в 1906 году, но ферментативное фосфорилирование белков не было описано до 1930-х годов.
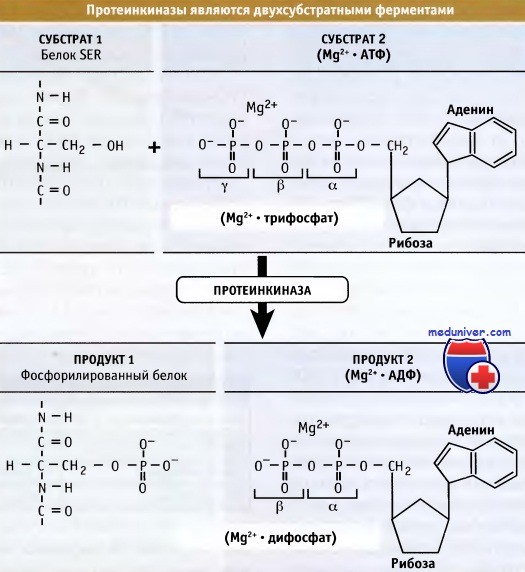
Фосфорилирование белка происходит, когда фосфорильная группа добавляется к аминокислоте. Обычно аминокислота представляет собой серин, хотя фосфорилирование также происходит по треонину и тирозину у эукариот и гистидину у прокариот. Это реакция этерификации, когда фосфатная группа взаимодействует с гидроксильной (-ОН) группой боковой цепи серина, треонина или тирозина. Фермент протеинкиназа ковалентно связывает фосфатную группу с аминокислотой. Точный механизм несколько отличается у прокариот и эукариот. Наиболее изученными формами фосфорилирования являются посттрансляционные модификации (PTM), что означает, что белки фосфорилируются после трансляции с матрицы РНК. Обратная реакция, дефосфорилирование, катализируется протеинфосфатазами.
Важным примером фосфорилирования белков является фосфорилирование гистонов. У эукариот ДНК связана с гистоновыми белками с образованием хроматина. Фосфорилирование гистонов изменяет структуру хроматина и изменяет его белок-белок и ДНК-белок взаимодействия. Обычно фосфорилирование происходит при повреждении ДНК, открывая пространство вокруг поврежденной ДНК, чтобы механизмы восстановления могли выполнять свою работу.
Помимо важности для репарации ДНК, фосфорилирование белков играет ключевую роль в метаболизме и сигнальных путях.
Окислительное фосфорилирование
Окислительное фосфорилирование — это то, как клетка накапливает и выделяет химическую энергию. В эукариотической клетке реакции происходят внутри митохондрий. Окислительное фосфорилирование состоит из реакций цепи переноса электронов и хемиосмоса. Таким образом, окислительно-восстановительная реакция передает электроны от белков и других молекул по цепи переноса электронов во внутренней мембране митохондрий, высвобождая энергию, которая используется для производства аденозинтрифосфата (АТФ) при хемиосмосе.
В этом процессе NADH и FADH 2 доставляют электроны в цепь переноса электронов. Электроны переходят от более высокой энергии к более низкой по мере продвижения по цепочке, высвобождая при этом энергию. Часть этой энергии идет на перекачку ионов водорода (H + ) для образования электрохимического градиента. В конце цепочки электроны передаются кислороду, который связывается с H + с образованием воды. Ионы H + поставляют энергию АТФ-синтазе для синтеза АТФ. Когда АТФ дефосфорилируется, отщепление фосфатной группы высвобождает энергию в той форме, которую клетка может использовать.
Аденозин — не единственное основание, которое подвергается фосфорилированию с образованием АМФ, АДФ и АТФ. Например, гуанозин может также образовывать GMP, GDP и GTP.
Обнаружение фосфорилирования
Фосфорилирована ли молекула, можно определить с помощью антител, электрофореза или масс-спектрометрии. Однако идентифицировать и охарактеризовать сайты фосфорилирования сложно. Мечение изотопов часто используется в сочетании с флуоресценцией, электрофорезом и иммуноанализами.
Для чего нужно фосфорилирование
• Протеинкиназы представляют собой большое семейство белков
• Протеинкиназы фосфорилируют Ser и Thr либо Tyr или же все три аминокислотных остатка
• Протеинкиназы узнают последовательность аминокислот, окружающую сайт фосфорилирования
• Протеинкиназы преимущественно узнают сайты фосфорилирования, расположенные в скрученных доменах
Фосфорилирование белков представляет собой наиболее распространенную форму их регуляторной посттрансляционной модификации. Оно происходит у всех организмов, и показано, что примерно 1/3 всех белков в клетке млекопитающих в определенные моменты времени подвергается фосфорилированию. Фосфорилирование может стимулировать или ингибировать каталитическую активность ферментов, сродство, с которым белок связывается с другими молекулами, его внутриклеточную локализацию и способность к дальнейшим ковалентным модификациям, или изменять его стабильность. При фосфорилировании одного остатка активность белка может измениться в 500 и более раз, и часто белки фосфорилируются по нескольким сайтам сложными и взаимозависимыми путями.
Большинство белков клеток эукариот и практически все в клетках животных фосфорилируются с участием протеинкиназ; их дефосфорилирование катализируется фосфопротеинфосфатазами. Оба класса ферментов находятся под контролем различных механизмов. Часто, наряду с этим, белки фосфорилируются несколькими протеинкиназами, что приводит к возникновению фосфорилированных форм, обладающих различной активностью. Это позволяет интегрироваться различным входным сигналам, обеспечивая активацию белков-мишеней.
У бактерий, растений и грибов важную роль играет еще одна система фосфорилирования белков, которая называется двухкомпонентной сигнальной системой. Участвующие в этой системе протеинкиназы отличаются от соответствующих ферментов эукариот и фосфорилируют остатки аспарагиновой кислоты, а не серина, треонина или тирозина.
Протеинкиназы переносят фосфатную группу с АТФ на остатки Ser, Thr и Tyr в белковых субстратах, образуя химически устойчивые фосфорные эфиры.
У животных фосфатные группы неравномерно распределяются среди трех остатков аминокислот: 90-95% приходится на остатки Ser, 5-8% на Thr, и менее 1% — на Tyr. В геноме человека содержится примерно 500 генов, кодирующих протеинкиназы, и для многих их мРНК характерен альтернативный сплайсинг. Это делает семейство генов протеинкиназ одним из наиболее представительных. Количество протеинкиназ и их разнообразие служат подтверждением широкого участия этих ферментов в регуляции клеточных функций. Хотя некоторые протеинкиназы характеризуются ограниченным тканевым распределением и участвуют не во всех процессах развития, многие из них распространены достаточно широко.
Классификация протеинкиназ основывается на их специфичности по отношению к остаткам аминокислот. Киназы, которые фосфорилируют остатки Ser, обычно также узнают остатки Thr; отсюда их название Ser/Thr киназы. У многоклеточных организмов Tyr киназы специфичны только по отношению к остаткам Tyr. Протеинкиназы, обладающие двойной специфичностью, могут фосфорилировать Ser, Thr и Tyr при строго определенной конформации субстрата и обычно являются наиболее селективными из протеинкиназ.
Анализ киномов нескольких организмов привел к более подробной классификации киназ, основанной на степени гомологии их первичной структуры. В какой-то степени эта классификация также отражает специфику регуляторных механизмов и субстратную специфичность киназ. Например, группа AGC называется в соответствии с входящими в нее цАМФ-зависимой протеинкиназой (РКА), циклоГМФзависимой протеинкиназой (PKG), Са2+ и фосфолипидзависимой проотеинкиназой (РКС). Эти протеинкиназы регулируются с участием вторичных мессенджеров и предпочитают субстраты, которые содержат остатки основных аминокислот, расположенные рядом с сайтом фосфорилирования.
Наряду со специфичностью по отношению к остаткам аминокислот, большинство протеинкиназ проявляет селективность в отношении локальных последовательностей, окружающих субстратный сайт. Разработаны методы скрининга, позволяющие выяснить, содержат ли белки в субстратном сайте консенсусную последовательность для широкого набора протеинкиназ. Для идентификации и общей оценки степени фосфорилирования белков в специфических сайтах можно использовать антитела. Наряду с узнаванием отдельных белков, протеинкиназы могут обнаруживать заметную субстратную специфичность среди родственных белков, например основанную на их общей трехмерной структуре, или среди белков, которые были дифференциально ковалентно модифицированы, например фосфорилированы или убиквитинилированы.
Некоторые протеинкиназы клеток млекопитающих представляют собой гормональные рецепторы, проходящие через плазматическую мембрану. Рецепторы некоторых протеинкиназ представляют собой такие серин/треонин киназы, как рецептор трансформирующего фактора роста-b (TGF-b). Однако в большинстве случаев они являются протеин-тирозинкиназами, включая инсулиновые рецепторы, эпидермальный ростовой фактор (PDGF), и другие регуляторы роста и дифференцировки клеток. Прочие протеинкиназы представляют собой растворимые внутриклеточные ферменты, хотя они могут связываться с мембраной одной или нескольких органелл.
В результате рентгеноструктурного исследования кристаллической структуры протеинкиназ было получено мнгого информации относительно механизма их активации. Минимальный размер консервативного каталитического ядра протеинкиназ составляет около 270 аминокислот, что соответствует минимальной молекулярной массе примерно 30 000 Да. В этом ядре находятся скрученные домены, образующие на границе раздела активный сайт. Один или несколько остатков лизина (Lys) или аспарагиновой кислоты (Asp), которые необходимы для фосфорилирования, часто мутируют, что приводит к потере активности киназой. Последовательность, расположенная рядом с активным сайтом, называется петлей активации и часто изменяет свою конформацию, образуя активные формы протеинкиназы. Эта последовательность в семействе протеинкиназ представляет собой наиболее частый сайт регуляторного фосфорилирования. На поверхности молекул протеинкиназ находятся уникальные участки, которые определяют специфичность локализации ферментов, их взаимодействие с другими регуляторными молекулами, и узнавание субстратов. Эти участки обеспечивают возможность классификации протеинкиназ и проведения с ними генетических процедур.
В дополнение к разнообразию и полифункциональности киназ, у этих ферментов выработалось множество разнообразных регуляторных механизмов. Эти механизмы включают аллостерическую активацию и ингибирование липидами, небольшими растворимыми молекулами и белками, фосфорилирование, оказывающее активирующее и ингибирующее действие, и другие ковалентные модификации, включая протеолиз, а также связывание с каркасными и адаптерными структурами, приводящее к увеличению их активности или ограничивающее неспецифическую активность. Многие из этих факторов могут регулировать одну протеинкиназу в составе сложного комплекса. Более того, многие протеинкиназы действуют в цепи процессов, как в протеинкиназном каскаде (см. рис. 14.38), и могут создавать уникальный комплекс процессов передачи сигналов.
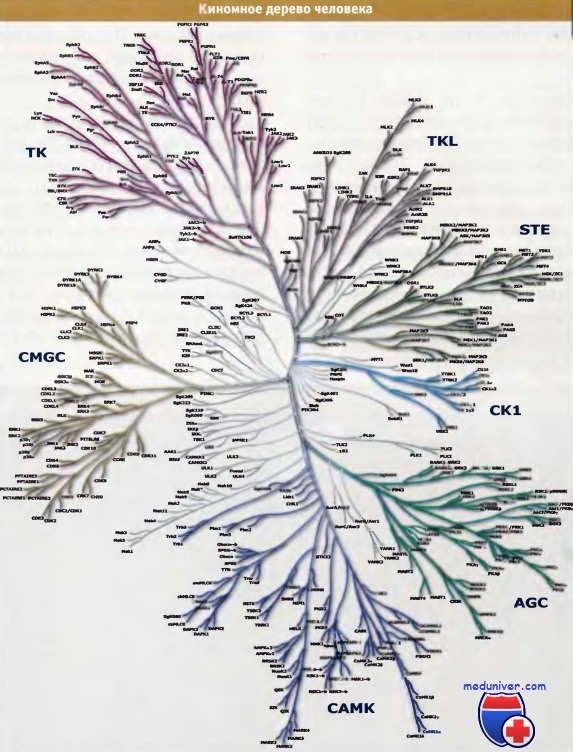
Одна большая группа содержит тирозинкиназы. Остальные группы специфичны к Ser/Thr, или проявляют двойную специфичность, и называются в соответствии с наиболее известными их представителями.
Группа AGC называется по РКА, PKG, и РКС.
САМК — по кальций, калмодулин-зависимым киназам,
CMGC — по CDK, МАРК, GSK3, Glks,
СК1 — по казеинкиназе-1;
STE — по Ste20, Ste11 и Ste7;
МАРК4К, МАРКЗК и МАРК2К участвуют в спаривании дрожжей;
и TKL — ферменты, напоминающие Tyr киназу. 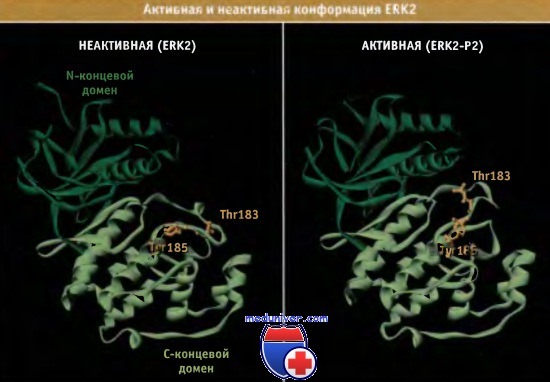
ERK2 обладает типичной структурой протеинкиназы. Меньший, N-концевой домен состоит в основном из b-листов, а более крупный С-концевой домен имеет структуру а-спирали.
Активный сайт формируется на границе двух доменов.
Петля активации выходит из активного сайта и после фосфорилирования остатков Tyr и Thr повторно скручивается,
что изменяет положение аминокислотных остатков в активном сайте. АТФ (не показан) связывается с внутренней частью активного сайта;
связывание белковых субстратов с поверхностью С-концевого домена облегчается реорганизацией петли активации.
Структуры построены по данным Protein Data Bank files 1ERK и 2ERK.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
