Для чего нужны катионы
Какую функцию в клетках выполняют катионы и анионы
Ключевую роль в жизнедеятельности организмов играет совсем незначительное их количество. Это главным образом ионы металлов.
Катионы К +, Na +, Са2 + обеспечивают универсальное свойство живой материи – раздражимость, поддерживают осмотическое давление в клетке, у животных они участвуют в передаче нервных импульсов. Кроме того, К + и Na + участвуют в специальном механизме транспортировки различных соединений в клетку и их выводе за ее пределы. Преимущественно ионы Na + находятся за пределами клетки, а К + – внутри клетки. Ионы Са2 + обусловливают мышечные сокращения.
Какую функцию в клетках выполняют катионы и анионы
Катион Mg2 + входит в состав молекулы хлорофилла, содержится в костях и зубах, активизирует химические реакции, протекающие в клетках всех без исключения существ, a Fe2 + входит в состав гемоглобина, миоглобина, дыхательных пигментов.
Особа функция катиона NH4, участвующий в поддержании устойчивого pH в клетке. Он является важным компонентом синтеза белков, но его избыток, вызванный нарушением обмена веществ, может приводить к значительным функциональным расстройствам.
Где встречаются нерастворимые минеральные соединения
Особое значение приобретают нерастворимые в воде минеральные соли – неотъемлемый компонент всех опорных структур животных. При этом ключевым веществом является кальций ортофосфат Са3 (Р04) 2 – составляющая межклеточного «цемента», что обеспечивает соединение клеток в ткани. Кроме того, он непременно содержится в скелете, в частности в костях позвоночных животных или в раковине моллюсков.
Явление ионной асимметрии живого
В современной биологии считается вполне доказанным, что всем живым организмам присуще явление ионной асимметрии. Оно заключается в неравномерном распределении ионов одного и того же заряда как внутри, так и за пределами клетки. Типичным примером является разница в концентрации ионов Na + и К + в клетке и за ее пределами.
Несмотря на незначительное содержание, минеральные вещества и ионы являются важными составляющими каждого организма. Именно эти соединения, содержащиеся в клетках и за их пределами в виде ионов, ответственные за важнейшие функции – раздражительность и скорость обмена веществ – входят в состав многих важных веществ. У животных они ответственны за проведение нервного импульса и сокращение мышечных клеток, объединение клеток в ткани и межклеточное взаимодействие.
Нерастворимые соли участвуют в образовании скелета, ответственные за соединение клеток.
Катионы и анионы в химии, таблица растворимости
Показатели растворимости в воде
Она помогает при решении химических уравнений, где участвуют ионные реакции. Если результатом будет получение нерастворимого вещества, то реакция возможна. Существует несколько вариантов:
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Электролиты
Это растворы или сплавы, проводящие электрический ток. Электропроводность их объясняется мобильностью ионов. Электролиты можно поделить на 2 группы:
Теория электролитической растворимости
Одновременно с диссоциацией проходит противоположный процесс – соединение ионов в молекулы. Кислоты – это такие электролиты, при распаде которых образуется катион – ион водорода. Основания – анионы – это гидроксид ионы. Щелочи – это основания, которые растворяются в воде. Электролиты, которые способны образовывать и катионы и анионы, называются амфотерными.
Это такая частица, в которой больше протонов или электронов, он будет называться анион или катион, в зависимости от того, чего больше: протонов или электронов. В качестве самостоятельных частиц они встречаются во многих агрегатных состояниях: газах, жидкостях, кристаллах и в плазме. Понятие и название ввёл в обиход Майкл Фарадей в 1834 году. Он изучал воздействие электричества на растворы кислот, щелочей и солей.
Простые ионы несут на себе ядро и электроны. Ядро составляет почти всю атомную массу и состоит из протонов и нейтронов. Количество протонов совпадает с порядковым номером атома в периодической системе и зарядом ядра. Ион не имеет определённых границ из-за волнового движения электронов, поэтому невозможно измерить их размеры.
Отрыв электрона от атома требует, в свою очередь, затрат энергии. Она называется энергия ионизации. Когда присоединяется электрон, происходит выделение энергии.
Катионы
Это частицы, носящие положительный заряд. Могут иметь разную величину заряда, например: Са2+ — двузарядный катион, Na+ — однозарядный катион. Мигрируют к отрицательному катоду в электрическом поле.
Анионы
Это элементы, имеющие отрицательный заряд. А также обладает различным количеством величины зарядов, например, CL- — однозарядный ион, SO42- — двухзарядный ион. Такие элементы входят в состав веществ, обладающих ионной кристаллической решёткой, в поваренной соли и многих органических соединениях.
Химия – наука, где возможно творить практически любые чудеса. Катион вы можете узнать по ссылке.
Для чего нужны катионы
Вещество и его строение, модель атома
Сколько электронов в атоме и где их искать?
3. Ион
А.е.м., моль, концентрация
Молекулы, химические соединения
Степень окисления. Окислитель. Восстановитель. Редокс
Электрохимия. Электролиз. Гальванические элементы
Химическая термодинамика, система, энтальпия
Сколько времени займёт реакция? Что влияет на скорость реакции?
Равновесие обратимых реакций. Принцип Ле Шателье. Влияние внешних факторов на равновесие
Мера беспорядка, энергия вселенной, свободная энергия Гиббса
Основные классы химических соединений. Классификация
Неорганическая химия
Органическая химия
Прикладная химия
Участников: 371
Присоединиться
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr) 24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье «электронная конфигурация атома», каждый электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный заряд), схема для запоминания:
Аналогично при присоединении электрона:
Энергия ионизации
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные | |||
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона также выделит 13 эВ.
Катионы и анионы
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Пример
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять окислительно-восстановительные реакции!
Что такое катионы и анионы?
Справочные таблицы, в которых дана сероводородная аналитическая классификация анионов 1-3 групп, качественные реакции и групповые реагенты, а также аналитические сигналы на анионы.
Данная аналитическая классификация анионов основана на растворимости солей бария Ba2+ и серебра Ag+, и включает в себя 3 аналитические группы анионов.
Таблица аналитическая классификация анионов
Таблица аналитические сигналы на анионы первой группы
Таблица аналитические сигналы на анионы второй группы
| № | Реагенты | Анионы | ||
| Cl- | Br- | I- | ||
| 1. | AgNO3 в присутствии HNO3 | AgCl белый творожистый растворим в избытке NH4ОН | AgBr желто-белый, частично растворим в избытке NH4ОН, хорошо растворим в Na2S2O3 | AgI светложелтый, растворим в Na2S2O3 и в большом иодида калия |
| 2. | Хлорная вода в кислой среде | — | Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет | Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет |
| 3. | диоксид марганца MnO2 в кислой среде | Свободный хлор, практически не окрашивает бензол-толуол | Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет | Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет |
Таблица аналитические сигналы на анионы третьей группы
| № | Реагенты | Анионы | |
| NO3- | NO2- | ||
| 1. | металлический алюминий или цинк (Al,Zn) в щелочной среде | выделяется аммиак NH3 | — |
| 2. | металлическая медь (Cu) | выделяются буро-желтые пары диоксида азота (NO2) | — |
| 3. | дифениламин | раствор окрашивается в синий цвет | раствор окрашивается в синий цвет |
| 4. | сильные кислоты (HCl, H2SO4) | — | выделяются желто- бурые пары окислов азота |
| 5. | перманганат калия(KMnO4) | — | раствор перманганата калия обесцвечивается |
Таблица аналитическая классификация анионов на окислительно-восстановительных свойствах
Эта аналитическая классификация анионов основана на их окислительно-восстановительных свойствах. Она также включает три аналитические группы анионов.
| № группы | Анионы | Групповой реагент | Результат действия реагента |
| 1. Анионы-окислители | BrO3-, AsO43-, NO3-, NO2- | KI в сернокислой среде | Выделение иода I2 |
| 2. Анионы-восстановители | S2-, SO32-, S2O32-, AsO33- | I2 | |
| S2-, SO32-, S2O32-, AsO33-, NO2-, C2O42-, Cl-, Br-, I-, CN-, NCS- | KMnO4 в сернокислой среде | Обесцвечивание раствора KMnO4 | |
| 3. Индифферентные анионы | SO42-, CO32-, PO43-, CH3COO-, B4O72- (BO2-) | Нет реагента | — |
Качественные реакции на неорганические вещества и ионы
Представим себе такую ситуацию: Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку.
При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет. В этих случаях придется отличать вещества с применением других реагентов. В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют: NaOH + HCl = NaCl + H2O
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок: 2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
Качественные реакции на катионы
Качественные реакции на анионы
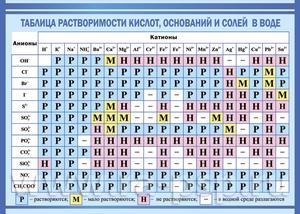
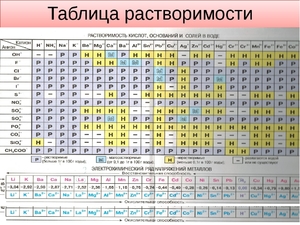
Таблица растворимости
Растворимостью называется способность одного или нескольких веществ вступать в реакцию с другими веществами таким образом, чтобы в результате получалась однородная система. При этом оба вещества распадаются на молекулы, атомы или ионы.
Наравне с таблицей периодической системы Д. И. Менделеева, таблица растворимости является основным теоретическим пособием при изучении химии. Не все вещества взаимодействуют между собой одинаково.
Начинающие химики, учащиеся школ, колледжей и вузов не всегда могут запомнить степень растворимости в воде тех или иных веществ. Именно поэтому таблицу периодической системы Менделеева и таблицу растворимости можно увидеть в каждом кабинете или классе химии, каждой лаборатории.
То или иное сочетание веществ из таблицы может вступать в семь различных реакций с водой:
Чаще всего таблица растворимости применяется при решении уравнений с участием ионных реакций. Реакция возможна только в том случае, если конечный продукт малорастворим или нерастворим вообще.
Условные обозначения в таблице растворимости:
| Р | Вещество хорошо растворимо в воде |
| М | Малорастворимо |
| Н | Практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах |
| РК | Нерастворимо в воде и растворяется только в сильных неорганических кислотах |
| НК | нерастворимо ни в воде, ни в кислотах |
| Г | полностью гидролизуется при растворении и не существует в контакте с водой |
| – | вещество вообще не существует |
| Катионы | Анионы | ||||||||||
| OH– | F– | Cl– | Br– | I– | S2- | NO3– | CO32- | SiO32- | SO42- | PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | – | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | – | – | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | – | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Что означает слово Катионы и анионы?
Катионы и анионы — это типы ионов, то есть атомы, которые приобрели или потеряли электроны через химические связи.
Атом, имеющий одинаковое количество протонов (положительный заряд) и электронов (отрицательный заряд), считается электрически нейтральным. Когда этот атом принимает или передает электроны, он называется ионом, который, в свою очередь, может быть:
Катион
Катион — это атом, который имеет положительный заряд, потому что в нем больше протонов, чем электронов.
Щелочные металлы (литий, натрий, калий, рубидий, цезий и францио), как правило, образуют катионы, поскольку в их валентном слое имеется только 1 электрон. Это означает, что энергия, необходимая для удаления этого электрона, очень мала, что делает эти элементы очень реактивными.
Катион представлен символом +, следующим за именем элемента. Количество потерянных электронов указывает на тип катиона:
Типы катионов также можно определить по количеству знаков +. Таким образом, элемент, представленный только +, является одновалентным катионом, в то время как другой элемент, представленный +++, является трехвалентным катионом.
Примеры катионов
Анион
Анион — это атом с отрицательным зарядом, потому что в нем больше электронов, чем протонов. Элементы семейства азота, калькогенов и галогенов имеют тенденцию образовывать анионы, потому что они легко принимают электроны.
Анион представлен символом — после имени элемента. Количество полученных электронов указывает на тип аниона:
Примеры анионов
Ионные Связи
Ионные или электровалентные связи представляют собой связи, которые возникают между катионами и анионами.
Элементы могут принимать, давать или делить электроны таким образом, чтобы их последний энергетический слой имел 8 электронов. Это известно как теория октетов.
Согласно теории октетов, атомы имеют тенденцию стабилизироваться, когда в валентном слое (последнем электронном слое) находится 8 электронов. Таким образом, будучи положительно заряженными, катионы связываются с отрицательно заряженными анионами. Таким образом, атомы дают или принимают электроны для достижения равновесия.
Связи, образованные между катионами и анионами, очень прочны и имеют тенденцию иметь следующие признаки:
Ионные связи образуют ионные соединения, такие как хлорид натрия (поваренная соль), образованный связью Na + (катион натрия) + Cl- (хлорид-анион) → NaCl.
Примеры ионных соединений
Некоторые примеры ионных соединений:
Катионный стол
Li +Fe + 2Na +Со + 2К +Ni + 2Rb +Sn + 2Cs +Pb + 2(NH 4 ) +Mn + 2Ag +Pt + 2Cu +Би + 3Hg +Al + 3Au +Cr + 3Mg + 2Au + 3Ca + 2Fe + 3Sr + 2Со + 3Ба + 2Ni + 3Zn + 2Sn + 4CD + 2Pb + 4Cu + 2Мн + 4Hg + 2Pt + 4
| литий | железистый |
| натрий | cobaltoso |
| калий | Niqueloso |
| рубидий | содержащий двухвалентное олово |
| цезий | Plumboso |
| аммоний | марганцевых |
| серебро | относящийся к платине |
| медь | висмут |
| Ртути | Нержавеющая сталь |
| Auroso | хром |
| магний | золотоносный |
| кальций | трехвалентного железа |
| стронций | кобальтовые |
| барий | Niquélico |
| цинк | оловянный |
| кадмий | свинцовый |
| двухвалентной | марганца |
| содержащий двухвалентную ртуть | платина |