Для чего вирусу нужна ревертаза вич
Обратная транскриптаза ВИЧ
Обратная транскрипция — это процесс образования двуцепочечной ДНК на матрице одноцепочечной РНК. Данный процесс называется обратной транскрипцией, так передача генетической информации при этом происходит в «обратном» направлении, относительно транскрипции.
Идея обратной транскрипции вначале была очень непопулярна, так как противоречила центральной догме молекулярной биологии, которая предполагала, что ДНК транскрибируется в РНК и далее транслируется в белки.
Однако в 1970 году Howard Temin и David Baltimore независимо друг от друга открыли фермент, названный обратной транскриптазой (ревертазой), и возможность обратной транскрипции была окончательно подтверждена.
См. также
Смотреть что такое «Обратная транскриптаза ВИЧ» в других словарях:
ВИЧ ИНФЕКЦИЯ И СПИД — мед. ВИЧ инфекция инфекция, вызываемая ретровирусами, обусловленная инфицированием лимфоцитов, макрофагов и нервных клеток; проявляется медленно прогрессирующим иммунодефицитом: от бессимптомного носительства до тяжёлых и смертельных заболеваний … Справочник по болезням
ВИЧ — У этого термина существуют и другие значения, см. Вич. Вирус иммунодефицита человека … Википедия
Клинические стадии ВИЧ/СПИДа по В.И. Покровскому — Запрос «СПИД» перенаправляется сюда. Cм. также другие значения. Синдром приобретённого иммунного дефицита Красная ленточка символ солидарности с ВИЧ положительными и пациентами, у которых развился СПИД МКБ 10 B … Википедия
Лентивирусы — Лентивирусы … Википедия
Ретровирусы — Ретровирусы … Википедия
Синдром приобретённого иммунного дефицита — Красная ленточка символ солидарности с … Википедия
СПИД — Запрос «СПИД» перенаправляется сюда. Cм. также другие значения. Синдром приобретённого иммунного дефицита Красная ленточка символ солидарности с ВИЧ положительными и пациентами, у которых развился СПИД МКБ 10 B … Википедия
«Швейцарский нож» вирусной армии: разгадан секрет обратной транскриптазы
Схема эксперимента, основанного на измерении резонансного переноса энергии флуоресценции (FRET) и позволяющего определить ориентацию одиночной молекулы обратной транскриптазы (ОТ). Субстраты ОТ, представляющие собой различные гетеродуплексы РНК и ДНК, ковалентно присоединены к кварцевой подложке и помечены флуоресцентным красителем Cy5 (красные звезда и круги); РНКазный домен ОТ (H-домен) помечен красителем Cy3 (зелёные звезда и круги). В такой схеме, измерение флуоресценции полного внутреннего отражения (ФПВО) позволяет следить за ориентацией молекулы ОТ в пространстве. Звёзды означают излучающую молекулу флуорофора, круги — неизлучающую.
Автор
Редакторы
Обратная транскриптаза — фермент, представляющий самую сущность ретровирусов, таких как ВИЧ. Он обладает двумя различными каталитическими активностями и имеет сродство к нескольким формам нуклеиновых кислот, — гетеродуплексам из ДНК и РНК. С помощью оригинальной методики, позволяющей следить за ориентацией одной-единственной молекулы этого фермента, учёные описали поведение обратной транскриптазы и «засекли» его переключение между разными формами.
Для саморепликации в клетке-«хозяине» ретровирусы, такие как ВИЧ, должны создать двуцепочечную ДНК-копию своего одноцепочечного РНК-генома. В результате этого элегантного, хотя зачастую и смертельно опасного процесса, один из важнейших ретровирусных ферментов — обратная транскриптаза (ОТ), или ревертаза, — синтезирует цепочку длиной ≈20 000 нуклеотидных пар, а поток генетической информации при этом противоположен «общепринятому» (ДНК→РНК). ОТ является излюбленной мишенью для разработчиков противовирусных препаратов — как минимум половина выпускаемых средств, нацеленных на излечение СПИДа, направлена именно на этот белок. Процесс обратной транскрипции весьма сложен — ведь ферменту приходится работать с несколькими различными формами одно- и двуцепочечных РНК и/или ДНК, различать их между собой и «переключаться» в нужный режим — дело непростое. И вот в журнале Nature за авторством Аббонданзиери (Abbondanzieri) и его коллег вышла работа, описывающая, как обратной транскриптазе удаётся различить между собой различные субстраты на промежуточных этапах обратной транскрипции [1].
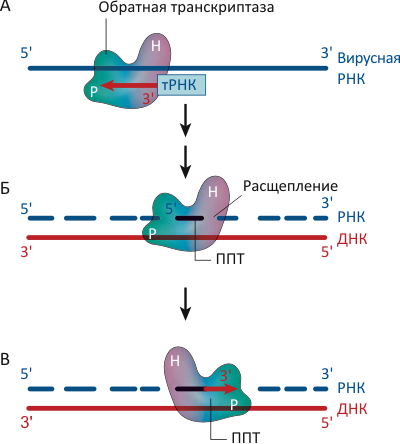
Рисунок 1. Обратная транскриптаза (ОТ) вируса иммунодефицита человека (ВИЧ) преобразует одноцепочечный РНК-геном вируса в двуцепочечную молекулу ДНК. А. Для синтеза первой («минусовой») цепи ДНК фермент использует в качестве праймера молекулу транспортной РНК (тРНК) из клетки «хозяина», присоединяясь к 3′-концу тРНК полимеразным (P) доменом. Б. После того, как «минусовая» цепь ДНК уже синтезирована, ОТ расщепляет РНК-«матрицу», связываясь с дуплексом РНКазным (H, от термина RNase H) доменом, оставляя тем не менее не тронутыми полипуриновые тракты (ППТ). В. Для синтеза второй («плюсовой») цепи ДНК ОТ использует оставшиеся ППТ в качестве праймеров, опять соединяясь с дуплексом в полимеразном режиме.
Обратная транскриптаза обладает двумя различными ферментативными активностями: ДНК-полимеразной, «копируя» РНК- или ДНК-шаблон в комплементарную ДНК-цепь, и активностью РНКазы H, катализируя расщепление цепи РНК в составе РНК/ДНК дуплекса на маленькие фрагменты — после того, как она уже послужила матрицей для синтеза первой («минусовой») цепи ДНК (см. рис. 1). Однако некоторые фрагменты РНК — называемые полипуриновыми трактами (ППТ) — фермент «пропускает», не допуская их деградации. Последовательность и структура этих участков довольно необычна, что, видимо, и позволяет им остаться незамеченными белками семейства РНКаз H [2].
Как и другие ДНК-полимеразы, ОТ начинает синтез ДНК с праймеров — коротких фрагментов нуклеиновых кислот, которые образуют как бы «затравку» для синтеза парной цепи. Для синтеза «минусовой» цепи ДНК ОТ использует в качестве праймера присутствующие в заражённых клетках молекулы транспортной РНК (тРНК). Для образования второй («плюсовой»), комплементарной первой, цепи фермент использует ППТ-фрагменты, оставшиеся от расщепления РНК-«матрицы» после работы ОТ в РНКазном режиме (рис. 1б).
Детали взаимодействий обратной транскриптазы ВИЧа с различными субстратами на молекулярном уровне были выяснены ранее путём анализа структур ОТ в комплексе с различными дуплексами нуклеиновых кислот — ДНК/ДНК и РНК/ДНК [2], [3]. Также было изучено поведение фермента, связывающегося с комплексом ДНК/ДНК в присутствии дезоксирибонуклеотидов — «строительных блоков» ДНК, выстраиваемых ДНК-полимеразой в комплементарную цепочку и сшиваемых между собой [4]. В результате этих структурных и биохимических экспериментов удалось показать, что ОТ взаимодействует как с обеими молекулами нуклеиновой кислоты в составе дуплекса, так и со «свободными» нуклеотидами; при этом её полимеразный (P) сайт связывает 3′-конец праймера. В режиме же расщепления РНК фермент взаимодействует с комплексом РНК/ДНК, и его H-каталитический домен связывается с цепью РНК [2] (рис. 1). Однако невыясненным оставалось то, как обратная транскриптаза отличает ППТ-фрагменты цепи РНК в качестве праймера для синтеза «плюсовой» ДНК-цепочки от остальной последовательности РНК, уже использованной в качестве матрицы, и расщепляемой в РНКазном режиме.
В статье Аббонданзиери [1] приведены удивительные данные о механизмах взаимодействия обратной транскриптазы с различными нуклеиновыми кислотами и их дуплексами. Для определения ориентации одиночной (!) молекулы ОТ по отношению к связанному РНК/ДНК гибриду, учёные использовали измерения резонансного переноса энергии флуоресценции (FRET) между различными молекулами-флуорофорами, которыми помечали как фермент, так и субстрат (см. картинку в заглавии). В отличие от типичных биохимических экспериментов, изучающих популяции молекул и их комплексов, спектроскопические методики вроде FRET позволяют непосредственно наблюдать за одиночными молекулярными событиями в реальном времени. Для анализа FRET две интересующие исследователей молекулы — в данном случае, обратную транскриптазу и нуклеиновую кислоту, — помечают флуоресцирующими химическими группами, миграция флуоресцентной энергии между которыми зависит от расстояния и может использоваться для оценки межмолекулярных взаимодействий.
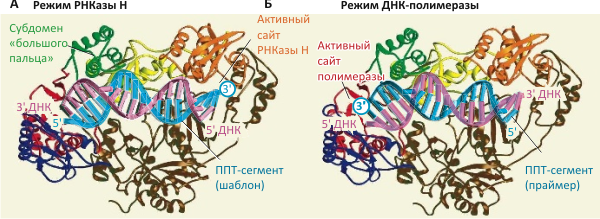
Исследователи обнаружили, что если обратная транскриптаза связывается с дуплексом, состоящим из сравнительно длинной (≈50 нуклеотидов) цепи ДНК (соответствующей «минусовой» цепи), и довольно короткого сегмента РНК (соответствующего остатку «матрицы»), фермент переходит в РНКазный режим. При этом полимеразный домен остаётся не задействованным, не связывая свободный 3′-конец РНК-сегмента. Однако если молекула РНК представляет собой полипуриновый тракт (ППТ), Р-домен активизируется и связывается с 3′-концом ППТ-сегмента в готовности удлинять его, синтезируя «плюсовую» цепь ДНК (рис. 2).
Рисунок 2. Будучи частью РНК вирусного генома, полипуриновый тракт (ППТ) служит шаблоном для синтеза «минусовой» цепи ДНК. А. До расщепления РНК ППТ-сегментов обратная транскриптаза связывается с последовательностью ППТ (синим цветом) в режиме РНКазы H (т.е. H-домен ОТ находится в непосредственной близи 3′-конца ППТ, показанного кругом), предотвращая связывание P-домена и преждевременный синтез ДНК. Б. Когда вся РНК по соседству с ППТ «выщеплена», позволяя ППТ-последовательности выступать в роли праймера, ОТ связывается с дуплексом в полимеразном режиме (когда P-домен оказывается вблизи 3′-конца ППТ), чтобы запустить синтез «плюсовой» цепи. Видимо, обратная транскриптаза ВИЧа спонтанно «переключается» между этими режимами связывания и, соответственно, функциями.
В работе также показано, что в присутствии свободных нуклеотидов доля молекул ОТ, связанных с ППТ-праймером в полимеразном режиме, возрастает. Более того, если в качестве праймера для «плюсовой» цепи выступает ДНК-последовательность, подавляющая доля молекул обратной транскриптазы «переключается» в режим полимеразы. Эти результаты наглядно показывают, что специфическое строение ППТ-сегментов не столько защищает их от расщепления, сколько образует эффективный праймер для полимеризации второй цепочки ДНК.
Что особенно интересно, обратная транскриптаза может, по видимому, «перескакивать» из одной ориентации по отношению к дуплексу в другую — и это без необходимости диссоциации комплекса. Этот переход оказался довольно неожиданным, особенно если учитывать сложную картину межмолекулярных взаимодействий фермент–субстрат. Кроме того, учёным удалось выяснить, что свободные нуклеотиды могут связываться с ОТ в комплексе с дуплексом, где праймер замещен химически-модифицированным «терминирующим» олигонуклеотидом, не способным к элонгации, стабилизируя «полимеразную» ориентацию фермента в составе комплекса. Образование таких «тупиковых» комплексов уже описывалось ранее [5] в контексте затруднения разблокировки терминирующих олигонуклеотидов и превращения их в обычные праймеры.
В работе было сделано и ещё одно важное наблюдение: невирапин (nevirapine) — противовирусный препарат, связывающийся в основании субдомена «большого пальца» обратной транскриптазы ВИЧа (рис. 2а) и ингибирующий фермент, — увеличивает частоту переходов ОТ между «полимеразной» и «РНКазной» ориентациями фермента в составе комплекса с гетеродуплексом РНК/ДНК. Это взаимодействие, меняющее сродство разных форм фермента к субстрату, может лежать в основе механизма действия подобных препаратов, — что уже, впрочем, обсуждалось и ранее [6], [7].
Работа Аббонданзиери наглядно показывает необходимость понимания того, как ориентационная динамика обратной транскриптазы связана с активностью этого белкá. Их открытие, кроме того, ставит вопрос, не возникает ли примеров подобной «молекулярной акробатики» на более ранних этапах работы ОТ — при связывании тРНК в качестве праймера для синтеза «минусовой» ДНК-цепи? Другой вопрос — для всех ли ферментов, обладающих более чем одной функцией, характерно такое ориентационное поведение? В качестве примеров подобных белков можно привести ДНК-полимеразу, которая, помимо своей основной функции, имеет и неполимеразную активность, или другие ферменты, «должности» которых связаны с нуклеиновыми кислотами, — хеликазы, лигазы, топоизомеразы, интегразы и эндонуклеазы рестрикции. Какими бы не были ответы на эти вопросы, относительно обратной транскриптазы уже понятно, что этот фермент оказался намного более «гибким» в работе с нуклеиновыми кислотами, чем можно было предположить ранее.
Для чего вирусу нужна ревертаза вич
На сегодняшний день ВИЧ-инфекция полностью не излечивается, но своевременная и грамотно подобранная высокоактивная антиретровирусная терапия (ВААРТ), успешно сдерживает прогрессирование заболевания и его переход в стадию СПИД. Прием терапии позволяет ВИЧ-инфицированному пациенту жить полноценной жизнью – учится, работать, создавать семью, заниматься любимым делом и даже иметь здоровых детей. При своевременном выявлении ВИЧ, на время приема терапии вирус в крови не обнаруживается, человек безопасен для окружающих, инфекция не влияет на продолжительность жизни.
Что такое антиретровирусная терапия?
Высокоактивная антиретровирусная терапия – это современный метод терапии ВИЧ-инфекции. Она подразумевает прием 3-4 препаратов, действие которых направлено на подавление вируса иммунодефицита. Проводимая терапия преследует сразу 3 жизненно важных цели.
Отказ от терапии неизбежно приводит к осложнениям и развитию СПИДа. Люди, живущие без терапии, сталкиваются с онкологическими патологиями и оппортунистическими инфекциями, вызывающими развитие туберкулеза, менингита, энцефалита, пневмонии и других заболеваний. Продолжительность жизни на стадии СПИД без лечения не превышает 6-9 месяцев.
Принцип действия терапии анти-ВИЧ
В основе ВААРТ лежит комбинация 3-4 препаратов, действие которых подавляет ВИЧ на всех стадиях развития, в том числе и его мутации. Проблема в том, что помимо способности создавать собственные копии (репликации), вирус иммунодефицита характеризуется высокой мутагенностью – он способен подстраиваться под любые неблагоприятные условия, продолжая создавать свои репликации и мутации.
«Самосовершенствование» позволяет ему выработать устойчивость (резистентность) к какому-либо препарату, особенно если пациент игнорирует назначения врача или по незнанию пропустил терапию. В этом случае эффективность лечения резко снижается и не дает никакого результата. К тому же, высокая резистентность вируса приводит к появлению новых штаммов, которые уже изначально устойчивы к ВААРТ.
Мутагенность, резистентность, появление новых штаммов, способность к репликации – вирионы ВИЧ пытаются «выжить любой ценой». Поэтому прием всего 1 препарата не может подавлять их активность и сдерживать развитие инфекции. Для решения этой проблемы специалисты постоянно разрабатывают эффективные схемы ВААРТ, которые необходимо принимать с соблюдением четкого графика.
Как принимать АРВТ?
Антиретровирусная терапия проводится с соблюдением следующих принципов.
В процессе лечения состав АРВТ может корректироваться, что позволяет добиться максимальной эффективности проводимого лечения.
Важно понимать, что вопросы по типу, “принимать ли мне сегодня лекарства или не принимать?”, в данном случае не уместны. Конечно, соблюдать столь строгий режим, по понятным причинам, по силу не каждому пациенту. Но жить с ВИЧ без терапии – это равносильно собственноручно подписанному смертному приговору, когда у человека есть выбор и возможности для спасения.
Где выписать лекарства от ВИЧ?
Лечением ВИЧ-инфекции занимается только врач-инфекционист. Самолечение не допустимо!
Большая часть лекарств от ВИЧ находятся в списке жизненно необходимых и важнейших лекарственных препаратов. Поэтому расходы на лечение пациентов оплачиваются государством – за счет федерального и регионального бюджета. Препараты выдаются ВИЧ-позитивным пациентам в Центрах СПИД при наличии рецепта от лечащего врача. Для их получения, пациента в обязательном порядке ставят на диспансерный учет.
Какие лекарства лечат ВИЧ?
Для общего ознакомления перечислим классы лекарств, принцип их действия и препараты с помощью наглядной таблицы.
Нуклеозидные ингибиторы* обратной транскриптазы
Подавляют обратную транскриптазу — фермент ВИЧ, который отвечает за создание ДНК репликаций
Абакавир, Зальцитабин, Ламивудин, Ставудин и др.
Ненуклеозидные ингибиторы обратной транскриптазы
Воздействуют на обратную транскриптазу
Невирапин, Рилпивирин, Эфавиренз, Элсульфавирин и др.
Блокируют фермент-протеазу вируса, в результате чего образуются вирионы, не способные заражать новые клетки организма
Ампренавир, Индинавир, Нелфинавир, Ритонавир и др.
Блокируют фермент вируса, который участвует в процессе встраивания вирусной ДНК в геном клетки-мишени
Ралтегравир, Долутегравир, Элвитегравир.
Препятствуют проникновению вирионов ВИЧ в клетку-мишень
Блокируют последний этап проникновения вирионов ВИЧ в клетку-мишень
*Ингибиторы – вещества, подавляющие течение физиологических процессов.
Несмотря на важность и жизненную необходимость лечения, в некоторых случаях, пациенты могут не выдерживать график приема лекарств, что затрудняет проведение терапии и снижает ее эффективность. Поэтому сегодня специалисты активно разрабатывают новые схемы ВААРТ, предполагающие однократный прием препарата — 1 раз в сутки. Для однократного приема уже одобрены такие лекарства, как Атазанавир, Абакавир, Диданозин, Тенофовир, Ламивудин, Эмтрицитабин, Эфавиренз и другие самые современные антиретровирусные средства.
Популярные вопросы и проблемы ВААРТ
Несмотря на то, что ВИЧ достаточно хорошо изучен, для большинства людей он остается полной «загадкой». Зачастую, ни сами ВИЧ-инфицированные, ни их окружение не располагают достоверной, понятной информацией о вирусе, течении болезни, лечении инфекции и возможных последствиях. Пытаясь заполнить пробелы знаний, они читают сомнительные интернет публикации, прислушиваются к советам «чудом излечившихся» людей, обращаются за помощью к адептам народной медицины и т.д. Подобные действия не только не решают возникшей проблемы, но и подвергают опасности здоровье и жизнь людей. Мы попытаемся хоть немного решить проблему и ответим на самые распространенные вопросы пациентов и их окружения.
Можно ли заразиться, если партнер принимает терапию?
Грамотно проводимая ВААРТ угнетает активность вируса, поэтому риск заражения минимальный. Но только в том случае, если у ВИЧ-позитивного пациента зафиксированы низкие или неопределяемые показатели вирусной нагрузки на организм. Если же вирусная нагрузка высокая, то риск инфицирования возрастает.
Половые партнеры должны быть информированы о ВИЧ-статусе друг друга. Наличие сопутствующих инфекций, передающихся половым путем, а также гепатита, увеличивает вероятность передачи инфекции в 3-5 раз. Даже при условии, что уровень вирусной нагрузки снижается до 3500 копий РНК ВИЧ и ниже в 1 мл крови, все равно риск передачи инфекции сохраняется. Поэтому половым партнерам необходимо использовать презервативы при любой форме полового акта.
Можно ли пить алкоголь во время терапии?
Препараты антиретровирусной терапии не совместимы с алкоголем. Более того! Прием алкоголя угнетает функции и без того ослабленной иммунной системы, создает повышенную нагрузку на организм и усиливает токсическое влияние ингибиторов – принимаемые в ходе ВААРТ препараты.
Можно ли родить здорового ребенка, если принимать ВИЧ терапию?
Применение грамотной ВААРТ позволяет снизить риск передачи инфекции до 2% и ниже. Поэтому у новорожденных от ВИЧ-инфицированной матери есть все шансы не унаследовать заболевание. Подтвердить или опровергнуть ранний диагноз позволяет своевременная диагностика методом ПЦР (полимеразной цепной реакции). Для этого кровь малыша исследуют два раза — в возрасте 1-4 месяцев, и в возрасте старше 4 месяцев. Если оба раза результаты ПЦР отрицательные, то можно говорить о том, что ребенок родился здоровым.
Мне назначили ВААРТ, но мне от нее хуже, что делать?
Антиретровирусные препараты для лечения ВИЧ обладают побочным действием, собственно, как и любые лекарства. Часть побочных эффектов проявляется практически сразу. Например, у пациента повышается температура, появляются проблемы с желудочно-кишечным трактом, кожные высыпания, увеличивается уровень инсулина в крови. ВИЧ-позитивный пациент может заметно худеть или набирать вес. Возникающие побочные эффекты создают дополнительную нагрузку на организм. Чтобы избежать этого, необходимо регулярно проходить обследование и при необходимости корректировать схему проводимой ВААРТ. Именно корректировать, а не отказываться от лечения!
Можно ли заразиться ВИЧ, если принять терапию после вероятного заражения?
Прием антиретровирусных препаратов сразу же после факта возможного заражения значительно снижает риск передачи инфекции. Очень важно принять лекарство в течение первых 2 часов после «аварийной ситуации». Более поздний прием снижает эффективность профилактики. А назначение лекарства спустя 72 часа после факта инфицирования вообще не имеет смысла. При этом необходимо понимать, что назначить прием препарата ВААРТ в целях профилактики имеет право только специалист, поскольку самолечение может навредить здоровью.
У моего полового партнера ВИЧ, нужно ли мне проходить терапию, чтобы не заразиться?
Проходить ВААРТ здоровому человеку с целью профилактики ВИЧ не нужно. Достаточно использовать презерватив во время каждого полового контакта в любой форме.
Важно знать! Продолжительность жизни ВИЧ-инфицированного пациента зависит не только от эффективности ВААРТ, но и общего состояние здоровья и иммунитета. Организм людей с крепким иммунитетом, которые не имеют в своем анамнезе хронических заболеваний и врожденных патологий, лучше противостоит развитию ВИЧ-инфекции. И наоборот, ослабленный организм не в состоянии бороться с вирусом. Поэтому помимо антиретровирусной терапии, всем ВИЧ-положительным пациентам рекомендован здоровый образ жизни и правильное питание. Они должны беречь себя от инфекционных и простудных заболеваний. Укреплять свой иммунитет и в обязательном порядке проходить регулярное обследование организма.
Все интересующие вопросы лучше задавать специалистам СПИД-центра или лечащему врачу по месту жительства.
Как устроены ВИЧ и АРВТ? Объясняем на пальцах
Андрей Смирнов СПИД.ЦЕНТР
Мы каждый день рассказываем о вирусе иммунодефицита человека, антиретровирусной терапии, последних медицинских исследованиях и жизни людей с ВИЧ. Но при этом на русском языке практически нет доступных объяснений, как устроен сам вирус ВИЧ и как работают таблетки. Есть только зубодробительная медицинская литература и невнятные описания, из которых совершенно ничего нельзя понять. Мы исправляем этот недостаток и объясняем буквально на пальцах, как это все устроено.
Вирусы довольно трудно «убить» в обычном понимании этого слова, потому что они обладают лишь немногими признаками живого, важнейший из которых — способность размножаться. За пределами организма вирусную частицу можно разрушить с помощью агрессивных химических веществ — дезинфицирующих средств или антисептиков. Но после того как вирус проник в организм, остается только один вариант «убить» его — заблокировать размножение.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.
На первом этапе (цифра 1 на схеме) вирус проникает в клетку. Чтобы попасть внутрь, вирусной частице сначала необходимо «прилипнуть» к поверхности клетки. Для ВИЧ таким «клеем» является специальный белок gp120, который находится на поверхности вирусной частицы. Этот белок «приклеивается» к рецепторам CD4, расположенным на поверхности Т-лимфоцитов (Т-хелперов) и некоторых других клеток. Если у клетки нет рецептора CD4, то частица ВИЧ не может удержаться на ее поверхности и проникнуть внутрь, поэтому ВИЧ поражает только определенные типы клеток, имеющие этот рецептор. Например, некоторые Т-лимфоциты.
На этом самом первом этапе инфицирования клетки заблокировать процесс может ибализумаб — недавно зарегистрированный в США новый препарат против ВИЧ. Ибализумаб связывается с рецептором CD4 и мешает нормальному взаимодействию вирусного белка gp120 с ним. Из-за этого вирус не «прилипает» к клеткам-мишеням и не может в них проникнуть.
по теме
Лечение
Лучшие научпоп-статьи 2018 года
После «прилипания» к рецептору CD4 клетки-хозяина вирусная частица взаимодействует еще с одним рецептором — CCR5 (или с CXCR4 — в зависимости от типа вируса), чтобы лучше закрепиться на поверхности клетки. На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина. Однако у ВИЧ все гены хранятся не в ДНК, как у людей, а в РНК. Поэтому вирус с помощью специального фермента — обратной транскриптазы — сначала должен переписать свои гены из собственной РНК в понятную нашим клеткам ДНК. Обратная транскриптаза работает как конвейер: захватывает отдельные нуклеозиды — строительные «кирпичики», из которых складывается ДНК, — и собирает их в готовую цепочку. А нужная (для воспроизводства вируса) последовательность кирпичиков-нуклеозидов при этом записана в исходной вирусной РНК.
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
Разница между НИОТ и ННИОТ заключается в структуре молекул лекарств. Вещества первой группы по структуре похожи на нуклеозиды — те самые кирпичики, из которых строятся молекулы ДНК и РНК. Когда такой «неправильный кирпичик» попадает в «конвейер» обратной транскриптазы вируса, ее механизм «заклинивает», и она больше не может собирать вирусную ДНК. ННИОТ имеют другую структуру, непохожую на нормальные нуклеозиды, и блокируют обратную транскриптазу, связываясь с ее молекулой в других точках.
С этой особенностью строения связано и большее число побочных эффектов при приеме НИОТ по сравнению с ННИОТ: молекулы первого класса ингибиторов могут нарушать процессы синтеза РНК и ДНК и в наших собственных клетках, так как они похожи на «нормальные» нуклеозиды и тоже «заклинивают» наши собственные ферменты, но в гораздо меньшей степени, чем вирусные. НИОТ исторически были первым классом препаратов, которые начали использовать для лечения ВИЧ-инфекции.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме
Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Мутации помогают не только ВИЧ, но и некоторым людям. Например, мутация, изменяющая форму рецептора CCR5, который ВИЧ использует на первом этапе проникновения в клетку, делает человека полностью невосприимчивым к некоторым подтипам ВИЧ. Вирус не может «приклеиться» к такому рецептору и проникнуть в клетку. В разных популяциях людей распространенность этой мутации колеблется от 0,1 % до 1 %.
Несмотря на большое количество разных групп препаратов, используемых для торможения ВИЧ-инфекции, вылечить ее полностью пока невозможно. Проблема заключается в том, что все имеющиеся на сегодняшний день лекарства тормозят размножение вирусов в организме на разных этапах, но неспособны полностью удалить вирус из организма. Он всегда будет присутствовать в каком-то количестве клеток в «спящем режиме», встроившись в ДНК, и сразу же продолжит размножение, как только человек прекратит прием антиретровирусных препаратов.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.