Для раковых клеток характерна большая нестабильность генома чем для нормальных
Библиотека
Основные свойства неопластической клетки и базовые механизмы их возникновения
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
1.1. Характерные признаки опухолевой клетки
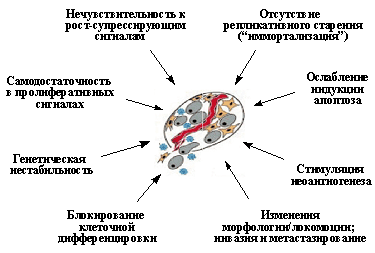
Важнейшие свойства неопластической клетки, приобретаемые в ходе опухолевой прогрессии и обеспечивающие злокачественный рост. (Объяснения в тексте).
Вторым важнейшим приобретенным свойством неопластических клеток является их пониженная чувствительность к рост-ингибирующим сигналам. Как известно, в организме существует множество антипролиферативных сигналов, поддерживающих определенное число клеток в каждой из тканей. Такие сигналы генерируются как секретируемыми растворимыми факторами (цитокинами), так и взаимодействиями клеток с внеклеточным матриксом и друг с другом. Классическим примером здесь является так называемое контактное торможение размножения клеток в культурах in vitro. (Рис. 2В).
Нормальные клетки, например фибробласты, размножаются до тех пор, пока не возникнет плотный монослой и не установятся межклеточные контакты. В отличие от этого, трансформированные клетки при возникновении межклеточных контактов не останавливают свою пролиферацию, а продолжают делиться, наползать друг на друга и образовывать очаги многослойного роста.
А) Пониженная зависимость от факторов роста 
Б) Способность размножаться без прикрепления к внеклеточному матриксу 
В) Отсутствие контактного торможения размножения 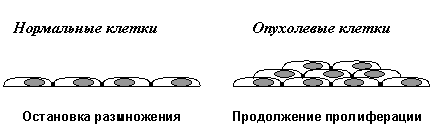
Рис.2. Характерные признаки неопластических клеток in vitro (объяснения в тексте)
Еще одним важнейшим свойством опухолевых клеток является отсутствие репликативного старения, или приобретение бессмертия (иммортализация). Как известно, существует механизм, ограничивающий число делений большинства типов зрелых клеток человека. Так, в культурах человеческих фибробластов in vitro после 60-80 делений (так называемое число Хейфлика) наблюдается необратимая остановка размножения клеток и их постепенная гибель. Между тем, чтобы образовать из одной клетки-родоначальницы сначала опухоль, а затем и метастазы, в условиях жесткого давления со стороны организма, когда многие опухолевые клетки погибают, может потребоваться большее число делений. И, действительно, в опухолевых клетках наблюдается нарушение работы такого «счетно-ограничительного» механизма контроля репликации.
Следующим важным свойством неопластических клеток является ослабление индукции в них апоптоза. Апоптоз представляет собой активный механизм клеточного самоубийства, поддерживающий в организме определенное число клеток и, кроме того, защищающий его от накопления аномальных клеточных вариантов. Он вызывается как физиологическими сигналами (связыванием специфических киллерных цитокинов со своими рецепторами), так и различными внутриклеточными повреждениями или неблагоприятными условиями, в частности нарушениями структуры ДНК, нехваткой ростовых факторов, гипоксией и т.д. Уход от апоптоза резко повышает жизнеспособность неопластической клетки, делает ее менее чувствительной к факторам противоопухолевого иммунитета и терапевтическим воздействиям.
К важнейшим приобретенным свойствам опухолевых клеток принадлежит и их способность стимулировать неоангиогенез, т.е. формировать новые кровеносные и лимфатические сосуды из эндотелиальных клеток предсуществующих окружающих мелких сосудов. Это необходимое условие для дальнейшего роста опухолевого узелка, достигшего в диаметре 2-4 мм. В ином случае клетки в центре опухоли, не получая кислород и питательные вещества, будут погибать.
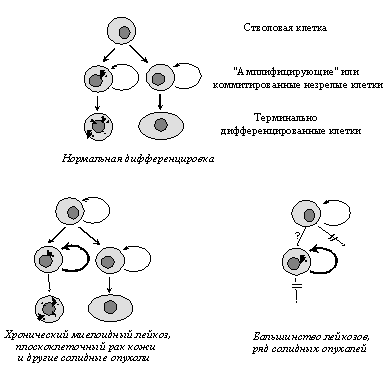
Для многих опухолевых клеток характерны и нарушения клеточной дифференцировки, т.е. образования специализированных типов клеток, синтезирующих специфические белки. Особенно ярко это проявляется в гемобластозах, новообразованиях из кроветворных тканей, при которых их клетки оказываются как бы замороженными на той или иной стадии созревания. Общепринятым является представление, согласно которому меньшая зрелость лейкозных клеток является не следствием дедифференцировки зрелых клеток, претерпевших неопластическую трансформацию, а отражает их происхождение из незрелых клеток, в которых блокированы процессы дальнейшей дифференцировки. Следует заметить, однако, что это свойство не является универсальным: во многих типах опухолей наблюдается сохранение способности к дифференцировке, причем в отличие от лейкозов созревание клеток не препятствует приобретению злокачественного фенотипа. Примерами этого могут служить плоскоклеточный ороговевающий рак кожи и высокодифференцированные аденокарциномы толстой кишки, происходящие из незрелых клеток, которые сначала несколько раз делятся, а затем дифференцируются (Рис. 3).
Происхождение из незрелых клеток не противоречит представлению о том, что опухолевые клетки в ходе прогрессии могут претерпевать определенную дедифференцировку, утрачивая в первую очередь те дифференцировочные белки, отсутствие которых придает клеткам селективные преимущества (например, рецепторы стероидных гормонов в раках молочной железы и т.д.).
Рис.3. Модели, объясняющие происхождение новообразований из незрелых клеток определенной стадии дифференцировки, в которых либо сохранена (внизу слева), либо блокирована (внизу справа) способность к дальнейшему созреванию.
Для раковых клеток характерна большая нестабильность генома чем для нормальных
Последствиями влияния радиационного воздействия на живые клетки являются различные типы повреждений ДНК: образование перекрестных связей в белках ДНК, перекрестных связей между цепями ДНК, оксидация и разрушение оснований, разрушение углеводно-фосфатных цепей, разрыв одной и двух цепей ДНК. В выживших клетках могут наблюдаться отсроченные эффекты ионизирующего излучения: мутации, хромосомные абберации, генетическая нестабильность. Эти генетически поврежденные клетки могут стать основой возникновения злокачественных опухолей. Похожие изменения ещё в большей степени могут наблюдаться в раковых клетках, в частности, после радиационного воздействия в процессе лучевой терапии. Ген ТР53 и кодируемый им белок р53 вовлечен в регуляцию клеточного ответа на стрессорные воздействия путем остановки клеточного цикла в контрольных точках для осуществления репарации ДНК либо индукции апоптоза в случае невозможности устранения ее повреждений [2, 4, 7]. Утрата функции гена р53 наблюдается практически в каждом случае злокачественных заболеваний, а его недостаточность приводит к развитию опухолей [1].
Белок р53 обладает исключительно коротким временем жизни, что достигается за счет регулируемого активного убиквитин-зависимого и убиквитин-независимого разрушения [3, 5]. Инициаторами разрушения р53 служат несколько убиквитиновых лигаз типа Е3 [1]. Наиболее изученной среди них является убиквитиновая лигаза Mdm2, которая сама является продуктом гена, активируемого р53 [8, 13, 14]. Процесс взаимодействия р53 с белком Mdm2 тонко регулируется за счет множества механизмов [9]. Одни механизмы направлены на регуляцию активности Mdm2, в то время как другие нацелены на модификации его мишени – самого белка р53 [12]. Через белки р53 и Mdm2 многоклеточный организм может элиминировать мутантные клетки. Комплекс р53:Mdm2 является одним из ключевых механизмов регуляции репарации ДНК. Клетки содержат ряд различных сигнальных путей и эффекторов, которые опосредуют репарацию различных типов повреждений ДНК. Эти пути включают эксцизионную репарацию оснований (BER), репарацию двунитевых разрывов ДНК, зависимую от гомологической рекомбинации (HRR), негомологичное соединение концов (NHEJ), эксцизионную репарацию нуклеотидов (NER) и репарацию неправильно спаренных оснований (MMR) [6]. Нарушение эффективной репарации в раковых клетках способствует возникновению химио- и радиорезистентных раковых опухолей и метастазированию здоровых органов и тканей. Исследование особенностей функционирования ДНК-репарирующих механизмах в различных типах раковых опухолей, в частности, в ТР53-мутантых опухолях поможет выяснить причины радио- и химиорезистентности.
Целью настоящей работы явилось изучение особенностей экспрессии генов ДНК-репарирующих механизмов в раковых клетках с нормальным и мутантным геном ТР53.
Материал и методы исследования
Использовали клеточную линию рака прямой кишки человека HCT-116 с нормальным геном ТР53 – НСТ116 р53 +/+ и изогенную клеточную линию HCТ-116 с мутантным геном ТР53 – НСТ116 р53 –/–. Клетки облучали рентгеновским излучением, генерируемым терапевтическим акселератором Cliniac 600 при комнатной температуре в дозах 4 Грэй одноразово. Клетки облучались в 24-луночных планшетах (объём лунки 2,5 мл.). Профили экспрессии генов в клетках НСТ116 р53 +/+ и НСТ116 р53–/– облученных в дозе 4 Гр изучали через 1, 12 и 24 часа после облучения с использованием микроматрицы Affymetrix серии HGU133А.
РНК выделяли из 3∙106 клеток с использованием набора для выделения РНК в соответствии с инструкцией производителя. Целостность выделенной РНК проверяли с использованием биоанализатора Agilent 2100 по целостности 18S и 28S рибосомальной РНК с помощью электрофореза в 1 % агарозном геле. Библиотеку клонированных ДНК готовили с использованием набора GeneChipExpression 3’-Amplification One-CyclecDNASynthesisKit. Мечение биотином анти-смысловых библиотек клонированных РНК и очистка были проведены с использованием набора GeneChipExpression 3’-Amplification Reagentsfor IVT Labeling в соответствии с протоколом производителя. Количество полученной РНК и ДНК оценивалось спектрофотометрически с использованием спектрофотометра NanoDrop. Фрагментацию кРНК проводили при 94 °C в термоциклере в течение 35 минут. Синтезированные биотинилированные кРНК вначале гибридизировали с контрольной матрицей «Test-3» с целью оценки качества полученных кРНК. Если качество биотинилированных кРНК соответствовало расчётному, то тогда проводили гибридизацию с матрицей HGU133А. Матрицу окрашивали стрептовидин-фикоэритрином. Окрашенную матрицу отмывали от несвязавшегося белка и сканировали на сканере GeneArray G2500A.
Для обработки материала использовали программы GeneCards и GeneAnnot. Для построения дендрограмм использовали программы Cluster 3.0 и TreeView. Принадлежность генов к тому или иному механизму репарации ДНК определяли по базе данных KEGG.
Для сравнения экспрессии генов ДНК-репарирующих механизмов между клеточными линиями с нормальным и мутантным геном ТР53 использовали балльную шкалу. Динамика экспрессии гена в двух клеточных линиях на протяжении 1, 12 и 24 часов оценивалась в 3 балла, если она была идентична на протяжении всего эксперимента; в 2 балла – если динамика экспрессии совпадала по двум временным точкам; в 1 балл – при совпадении по 1 временной точке и в 0 баллов, если она полностью различалась в двух клеточных линиях. Сумму баллов делили на общее число генов одного из ДНК-репарирующих механизмов и получали среднее значение, по которому производили сравнение сходства экспрессии генов в двух клеточных линиях между основными путями репарации ДНК.
Результаты исследования и их обсуждение
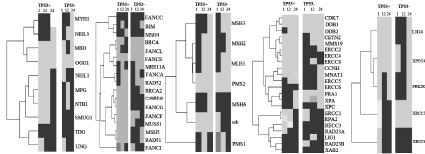
На рис. 1, а показан путь эксцизионной репарации оснований BER, который устраняет однонитевые разрывы ДНК и участки отсутствия нескольких оснований, а также удаляет специфические поврежденные основания [11].
Такие компоненты пути эксцизионной репарации оснований, как OGG1 (8-оксогуанидин ДНК гликозилаза), TDG (тимин–ДНК гликозилаза) и UNG (урацил–ДНК гликозилаза) демонстрируют одинаковую экспрессию в течение всего эксперимента в двух клеточных линиях. Гены NEIL3 (эндонуклеазы NEIL VIII–3), MBD4 (домен 4 метил-CpG-связывающего белка), NEIL1 (эндонуклеазы NEIL VIII–1), MPG (N-метилпурин-ДНК гликозилаза) и NTHL1 (nth эндонуклеазы III–1) имеют схожую динамику экспрессии на 1 и 24 часах, а ген MYH 1 (гомолог MutY) на 1 и 12 часах после облучения. Схожая активность экспрессии гена SMUG1 (однонитевая селективная монофункциональная урацил-ДНК-гликозилаза 1) фиксируется только на 12 часе эксперимента в клеточных линиях с нормальным и мутантным геном ТР53. Все гены после 24 часов с момента воздействия на них рентгеновского излучения одинаково экспрессируются в двух клеточных линиях.
Рис. 1. Экспрессия генов основных путей репарации ДНК в клеточных линиях рака прямой кишки человека HCT-116 с нормальным геном ТР53 – НСТ116 р53 +/+ и изогенная клеточная линия HCТ-116 с мутантным геном ТР53 – НСТ116 р53:а – механизм эксцизионной репарации оснований BER; б – механизм репарации двунитевых разрывов ДНК, зависимый от гомологической рекомбинации HRR; в – механизм эксцизионной репарации неправильно спаренных оснований MMR; г – механизм эксцизионной репарации нуклеотидов NER; д –механизм репарации двунитевых разрывов ДНК, негомологичное соединение концов NHEJ. Черным цветом обозначены гены, экспрессия которых возрастает по отношению к контрольной группе. Серым цветом обозначены гены, экспрессия которых снижается по отношению к контрольной группе. ТР53 (+) – раковая клеточная линия НСТ116 с нормальным геном TP53. ТР53 (–) – раковая клеточная линия НСТ116 с мутантным геном TP53
На рис. 1, б показан путь репарации двунитевых разрывов ДНК, зависимой от HRR, устраняет двунитевые разрывы в ДНК посредством гомологичного механизма восстановления непрерывной спирали ДНК [11].
Компоненты пути HRR – FANCC (белок, ассоциирующийся с анемией Фанкони, комплементарная группа C), FANCE (белок, ассоциирующийся с анемией Фанкони, комплементарная группа E) и RAD52 (гомолог белка RAD52) после 1, 12 и 24 часов имеют одинаковую динамику экспрессии в двух клеточных линиях. Аналогичный результат у генов MSH4 (гомолог белка MUTS), BRCA1 (белок ассоциирующийся с раком молочной железы 1), FANCA (белок, ассоциирующийся с анемией Фанкони, комплементарная группа А) и FANCF (белок, ассоциирующийся с анемией Фанкони, комплементарная группа F), экспрессия которых различна лишь после 24 часов с момента воздействия на них рентгеновского облучения. Гены BIM (белок BCL2), FANCL (белок, ассоциирующийся с анемией Фанкони, комплементарная группа L) и MUS81 (гомолог эндонуклеазы MUS81) одинаково экспрессируются только после 1 часа, а BRCA2 (белок, ассоциирующийся с раком молочной железы 2), MSH5 (небелковое кодирование), RAD51 (гомолог белка RAD51) и FANCI (белок, ассоциирующийся с анемией Фанкони, комплементарная группа I) после 24 часов. Активность экспрессии гена C190RF40 и FANCG (белок, ассоциирующийся с анемией Фанкони, комплементарная группа G) в двух клеточных линиях на протяжении всего эксперимента не имеет сходства.
На рис. 1, в показан путь репарации неправильно спаренных оснований ДНК (MMR).У генов MLH1 (белок, ассоциирующий сраком толстой кишки, неполипозныйтип 2), PMS2 (белок пост-мейотической сегрегации 2) и PMS1(белок пост-мейотической сегрегации) прослеживается схожая динамика экспрессии в двух клеточных линиях в течение всего эксперимента. Такие компоненты репарационного пути, как MSH3 (гомолог 3 белка MUTS), MSH2 (гомолог 2 белка MUTS) экспрессируются одинаково после 1 и 24 часов, а MSH6 (гомолог 6 белка MUTS) после 1 и 12 часов. Активность экспрессии гена ssb (белок, ассоциирующий с синдромом Шегрена антиген B) в двух клеточных линиях имеет сходство лишь спустя 1 час.
На рис. 1, г показан путь эксцизионной репарации нуклеотидов (NER). В двух клеточных линиях с нормальным и мутантным геном ТР53 на протяжении всего эксперимента наблюдается одинаковая активность экспрессии у генов CDK7 (циклин-зависимая киназа 7), DDB1 (белок, связывающийся со специфическими повреждениями ДНК, тип 1), XPC (белок, ассоциированный с пигментной ксенодермой тип C) и XAB2 (белок, связывающий XAB, тип 2). Одинаковая динамика экспрессии прослеживается у генов DDB2 (белок, связывающийся со специфическими повреждениями ДНК, тип 2), CETN2 (центрин), MMS19 (нуклеотидный гомолог репарации MMS19), RAD23A (гомолог А белка Rad23) и RAD23B (гомолог B белка Rad23), но лишь в точках 12 и 24 часов, а у генов ERCC5 (белок ERCC5), ERCC6 (белок ERCC6), ERCC1 (белок ERCC1), RPA2 (РНК полимераза Iполипептидов B) и LIG1 (АТФ-зависимая ДНК лигаза I) через 1 и 12 часов после облучения. Такие компоненты пути NER, как ERCC8 (белок ERCC8) и XPA (белок, ассоциированный с пигментной ксеродермой, комплиментарная группа A) имеют схожую экспрессию после 12 часов, а ERCC2 (белок ERCC2), CCNH (циклин H), MNAT1 (menage a troishomolog 1, cyclin H assembly factor (Xenopuslaevis), RPA1 (репликация белка A1) и ERCC3 (белок ERCC3) после 24 часов. Активность экспрессии гена ERCC4 (белок ERCC4) в двух клеточных линиях на протяжении всего эксперимента не имеет сходства.
В пути NHEJ (рис. 1, д) нет генов, которые показывали бы схожую динамику экспрессии в двух клеточных линиях на протяжении всего эксперимента. Ген XRCC4 (X-ray repair complementing defective repairin Chinese hamster cells 4) имеют схожую активность экспрессии в клеточных линиях в точке 1 и 12 час, а PRKDC (протеинкиназы, ДНК-активация, каталитических полипептидов) и XRCC6 на 12 и 24 часах. Одинаково экспрессируется ген XRCC5 в точке 1 час, а LIG4 (лигаза IV, ДНК, АТФ-зависимых) в точке 24 часа в клеточных линиях после воздействия на них рентгеновского облучения.
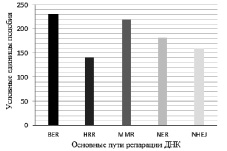
Путь MMR (рис. 2) в двух клеточных линиях имеет наибольшее сходство динамики экспрессии генов, которая равна 2,28 баллам. Похожие результаты показывает путь BER, который на 0,08 баллов уступает MMR. Средние результаты у пути NER ‒ 1,81 баллов. В путях NHEJ и HRR экспрессия генов является наиболее разобщенной и сходство экспрессии генов в двух клеточных линиях составило лишь 1,6 и 1,47 баллов.
Рис. 2. Сравнение соответствия экспрессии генов ДНК-репарирующих механизмов между клеточными линиями с нормальным и мутантным геном ТР53. BER – механизм эксцизионной репарации оснований; HRR – механизм репарации двунитевых разрывов ДНК, зависимый от гомологической рекомбинации; MMR – механизм эксцизионной репарации неправильно спаренных оснований; NER – механизм эксцизионной репарации нуклеотидов; NHEJ –механизм репарации двунитевых разрывов ДНК, негомологичное соединение концов
В норме двунитевые разрывы ДНК возникают с невысокой частотой в период репликации генома, но их число увеличивается при воздействии внеклеточных агентов. В качестве такого агента может выступать ионизирующее излучение, которое способствует большому количеству двунитевых разрывов в ДНК клетки. За восстановление двунитевых разрывов отвечают два механизма репарации ДНК – HRR и NHEJ. HRR воссоединяет концы ДНК без потери информации с помощью матрицы сестринской хроматиды [10]. В противоположность этому при NHEJ концы ДНК часто укорачиваются, и этот вариант является потенциально мутагенным [15].
В эксперименте установлено, что под воздействием ионизирующего излучения экспрессия генов клеточной линии с мутантным геном ТР53 существенно отличается от клеточной линии с геном дикого типа. Изменение экспрессии генов механизма репарации NHEJ в клеточной линии с мутантным геном ТР53 оказывает влияние на эффективность репарации двунитевых разрывов ДНК. Неисправность этих механизмов может привести к аберрациям хромосом и возникновению генетической нестабильности, что в итоге можно связать с высокой радиорезистентностью ТР53-мутантных опухолей.
Таким образом, сравнительный анализ динамики экспрессии генов, продукты которых являются участниками ДНК-репарирующих механизмов в клетках линий HCT-116 p53 –/– и HCT-116 p53 +/+ через 1,12 и 24 часа после радиационного воздействия в дозе 4 Гр позволил сделать следующие выводы:
1. Радиационная индуцированная динамика экспрессии генов механизмов репарации гомологичных рекомбинаций и репарации соединений негомологичных концов отличаются в клеточных линиях с нормальным и мутантным геном ТР53.
2. Мутация гена ТР53 не оказывает влияние на радиационно-индуцированную динамику экспрессии генов механизмов репарации ошибочно спаренных нуклеотидов и эксцизионной репарации удалений поврежденных оснований.
Работа выполнена при поддержке федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» грант № 14.B37.21.0558.
Рецензенты:
Балыкин М.В., д.б.н., профессор, заведующий кафедрой адаптивной физической культуры Института медицины, экологии и физической культуры, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Слесарев С.М., д.б.н., доцент, заведующий кафедрой биологии и биоэкологии Института медицины, экологии и физической культуры, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Генетическое тестирование в онкологии
Онкологические заболевания ежегодно уносят миллионы жизней. Среди причин смерти рак занимает второе место после сердечно-сосудистых заболеваний, а по сопровождающему его страху — определённо первое. Такая ситуация сложилась из-за представления, что рак сложно диагностировать и практически невозможно предотвратить.
Однако каждый десятый случай заболеваемости раком — это проявление мутаций, заложенных в наших генах с самого рождения. Современная наука позволяет их отловить и значительно уменьшить риск возникновения заболевания.
Эксперты в области онкологии рассказывают, что такое рак, как сильно на нас влияет наследственность, кому показано генетическое тестирование в качестве меры профилактики и как оно может помочь, если рак уже обнаружен.
Илья Фоминцев. Исполнительный директор
Фонда профилактики рака «Не напрасно»
Рак — это, по сути, генетическое заболевание. Мутации, вызывающие онкологические заболевания, либо наследуются, и тогда они есть во всех клетках организма, либо появляются в какой-то ткани или конкретной клетке. Человек может унаследовать от родителей определённую мутацию в гене, который защищает от рака, или мутацию которая сама по себе может привести к раку.
Ненаследственные мутации возникают в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения.
В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет. Этот путь люди проходят гораздо быстрее, если уже при рождении они унаследовали поломку. Поэтому при опухолевых синдромах рак возникает в гораздо более молодом возрасте.
Прошлой весной вышла замечательная статья в Science — о случайных ошибках, которые возникают в ходе удвоения молекул ДНК и являются основным источником появления онкогенных мутаций. При таких видах рака, как рак простаты, их вклад может достигать 95%.
Чаще всего причиной возникновения рака являются именно ненаследственные мутации: когда никаких генетических поломок человек не унаследовал, но в течение жизни в клетках накапливаются ошибки, которые рано или поздно приводят к возникновению опухоли. Дальнейшее накопление этих поломок уже внутри опухоли может сделать её более злокачественной или привести к возникновению новых свойств.
Несмотря на то, что в большинстве случаев онкологические заболевания возникают из-за случайных мутаций, надо очень серьёзно относиться к наследственному фактору. Если человек знает об имеющихся у него унаследованных мутациях, он сможет предотвратить развитие конкретного заболевания, риск возникновения которого у него очень велик.
Влияние генов BRCA1 и BRCA1 на рак молочной железы
(источник: images.nature.com)
Есть опухоли с ярко выраженным наследственным фактором. Это, например, рак молочной железы и рак яичников. До 10% случаев заболеваемости этими видами рака связаны с мутациями в генах BRCA1 и BRCA2. Самый распространенный среди нашего мужского населения вид рака — рак лёгкого — в основной массе вызывается внешними факторами, а конкретнее — курением. Но если предположить, что внешние причины исчезли, то роль наследственности стала бы примерно такой же, как и у рака молочной железы. То есть, в относительном соотношении для рака лёгкого наследственные мутации видны довольно слабо, но в абсолютных числах это всё же вполне существенно.
Кроме того, наследственный компонент довольно значительно проявляет себя в раке желудка и поджелудочной железы, колоректальном раке, опухолях головного мозга.
Антон Тихонов
научный директор биотехнологической компании yRisk
Большая часть онкологических заболеваний возникает за счёт сочетания случайных событий на клеточном уровне и внешних факторов. Однако в 5-10% случаев предопределяющую роль в возникновении рака играет наследственность.
Представим себе, что одна из онкогенных мутаций появилась в половой клетке, которой повезло стать человеком. Каждая из примерно 40 триллионов клеток этого человека (а также его потомков) будет содержать мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой, а риск заболеть определённым видом рака у носителя мутации будет существенно выше.
Повышенный риск развития рака передаётся из поколения в поколение вместе с мутацией и называется наследственным опухолевым синдромом. Опухолевые синдромы встречаются достаточно часто — у 2-4% людей, и вызывают 5-10% случаев рака.
Анджелина Джоли сделала профилактические операции, поскольку три её близких родственницы умерли от рака молочных желез и яичников (источник: fs.kinomania.ru)
Благодаря Анджелине Джоли самым известным опухолевым синдромом стал наследственный рак молочной железы и яичников, который вызывается мутациями в генах BRCA1 и BRCA2. У женщин с этим синдромом риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания гораздо ниже — 5,6%. Увеличивается вероятность развития рака и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин еще и предстательной железе.
Наследственные формы есть практически у любого онкологического заболевания. Известны опухолевые синдромы, которые вызывают рак желудка, кишечника, мозга, кожи, щитовидной железы, матки и другие, менее распространённые типы опухолей.
Знать о том, что у вас или и у ваших родственников есть наследственный опухолевый синдром, может быть очень полезно для того, чтобы снизить риск развития рака, диагностировать его на ранней стадии, и эффективнее лечить заболевание.
Носительство синдрома можно определить с помощью генетического теста, а на то, что вам стоит сдать тест, укажут следующие особенности семейной истории.
Если для вашей семьи характерно что-либо из вышеперечисленного, вам следует проконсультироваться у врача-генетика, который определит, есть ли медицинские показания для того, чтобы сдавать генетический тест. Носителям наследственных опухолевых синдромов следует проходить тщательный скрининг на онкологические заболевания для того, чтобы обнаружить рак на ранней стадии. А в некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
Несмотря на то, что наследственные опухолевые синдромы встречаются очень часто, западные национальные системы здравоохранения пока не ввели генетическое тестирование на носительство мутаций в широкую практику. Тесты рекомендуется сдавать лишь при наличии определённой семейной истории, указывающей на определённый синдром, и только в том случае, если известно, что тестирование может принести человеку пользу.
К сожалению, такой консервативный подход пропускает множество носителей синдромов: слишком мало людей и врачей подозревает о существовании наследственных форм рака; высокий риск заболевания далеко не всегда проявляется в семейной истории; многие пациенты не знают о заболеваниях своих родственников, даже когда есть, кого спросить.
Всё это — проявление современной медицинской этики, которая гласит, что знать человеку стоит только то, что принесет ему больше пользы, чем вреда.
Причём право судить о том, что такое польза, что такое вред, и как они соотносятся друг с другом, врачи оставляют исключительно себе. Медицинское знание — такое же вмешательство в мирскую жизнь, как таблетки и операции, и поэтому меру знания должны определять профессионалы в светлых одеждах, а то как бы чего не вышло.
Я, как и мои коллеги, считаю, что право на знание о собственном здоровье принадлежит людям, а не врачебному сообществу. Мы делаем генетический тест на наследственные опухолевые синдромы, чтобы те, кто хочет узнать о своих рисках развития рака, могли реализовать это право, и взять на себя ответственность за собственную жизнь и здоровье.
Владислав Милейко
директор Atlas Oncology Diagnostics
В процессе развития рака клетки изменяются и теряют свой первоначальный генетический «вид», унаследованный от родителей. Поэтому, чтобы использовать молекулярные особенности рака для лечения, недостаточно исследовать только наследственные мутации. Чтобы узнать слабые места опухоли, нужно провести молекулярное тестирование образцов, полученных в результате биопсии или операции.
Нестабильность генома позволяет опухоли копить генетические нарушения, которые могут быть выгодными для самой опухоли. К ним относятся мутации в онкогенах — генах, которые регулируют деление клеток. Такие мутации могут многократно повышать активность белков, делать их нечувствительными к тормозящим сигналам или вызывать повышенную выработку ферментов. Это приводит к неконтролируемому делению клеток, а впоследствии и к метастазированию.
Что такое таргетная терапия
Некоторые мутации имеют известные эффекты: мы знаем, как именно они меняют структуру белков. Это даёт возможность разработать лекарственные молекулы, которые будут действовать только на опухолевые клетки, и при этом не будут уничтожать нормальные клетки организма. Такие препараты называют таргетными. Чтобы современная таргетная терапия работала, нужно до назначения лечения знать, какие мутации есть в опухоли.
Эти мутации могут различаться даже в пределах одного типа рака (нозологии) у разных пациентов, и даже в опухоли одного пациента. Поэтому для некоторых лекарств молекулярно-генетическое тестирование рекомендовано в инструкции к препарату.
Определение молекулярных изменений опухоли (молекулярное профилирование) — важное звено в цепочке принятия клинических решений, а его значимость будет только расти со временем.
На сегодняшний день в мире проводится более 30 000 исследований противоопухолевой терапии. По разным данным, до половины из них используют молекулярные биомаркеры для включения больных в исследование или для наблюдения в ходе лечения.
Но что даст пациенту молекулярное профилирование? Где его место в клинической практике сегодня? Хотя для ряда лекарств тестирование является обязательным, это всего лишь «надводная часть айсберга» современных возможностей молекулярного тестирования. Результаты исследований подтверждают влияние различных мутаций на эффективность лекарств, а некоторые из них можно встретить в рекомендациях международных клинических сообществ.
Однако известно ещё не менее 50 дополнительных генов и биомаркеров, анализ которых может быть полезным в выборе лекарственной терапии (Chakravarty et al., JCO PO 2017). Их определение требует использования современных методов генетического анализа, таких как высокопроизводительное секвенирование (NGS). Секвенирование позволяет обнаружить не только распространенные мутации, но «прочитать» полную последовательность клинически значимых генов. Это позволяет выявить все возможные генетические изменения.
На этапе анализа результатов используются специальные биоинформатические методы, которые помогают выявить отклонения от нормального генома даже если важное изменение встречается в небольшом проценте клеток. Интерпретация полученного результата должна опираться на принципы доказательной медицины, так как не всегда ожидаемый биологический эффект подтверждается в клинических исследованиях.
Высокопроизводительное секвенирование позволяет анализировать огромные объёмы данных
(источник: biology.reachingfordreams.com)
Из-за сложности процесса проведения исследований и интерпретации результатов молекулярное профилирование пока не стало «золотым стандартом» в клинической онкологии. Однако есть ситуации, в которых этот анализ может существенно повлиять на выбор лечения:
Исчерпаны возможности стандартной терапии
К сожалению, даже на фоне правильно подобранного лечения заболевание может прогрессировать, и не всегда есть выбор альтернативной терапии в рамках стандартов для данного онкологического заболевания. В этом случае молекулярное профилирование может выявить «мишени» для экспериментальной терапии, в том числе в рамках клинических исследований (например TAPUR).
Спектр потенциально значимых мутаций широк
Некоторые виды рака, например, немелкоклеточный рак лёгкого или меланома, известны множеством генетических изменений, многие из которых могут быть мишенями для таргетной терапии. В таком случае молекулярное профилирование может не только расширить выбор возможных вариантов лечения, но и помочь расставить приоритеты при выборе препаратов.
Редкие виды опухолей или опухоли с изначально плохим прогнозом
Молекулярное исследование в таких случаях помогает на начальном этапе определить более полный спектр возможных вариантов лечения.
Молекулярное профилирование и персонализация лечения требуют сотрудничества специалистов из нескольких областей: молекулярной биологии, биоинформатики и клинической онкологии. Поэтому такое исследование, как правило, стоит дороже обычных лабораторных тестов, а его ценность в каждом конкретном случае может определить только специалист.
Оригинал статьи опубликован на сайте Newtonew.