До чего распадаются белки
До чего распадаются белки
В норме у новорожденных при голодании количество высвобождающихся в результате протеолиза аминокислот примерно в 2-3 раза превышает подобные показатели натощак у взрослых.
Не ясны причины более высоких темпов обновления тела и разрушения мышечного белка у недоношенных новорожденных, но более высокий темп протеолиза у незрелых новорожденных может значительно влиять на нормальный рост, чтобы обеспечить достаточное количество аминокислот для ремоделирования ткани, аккреции белка и гомеостаза глюкозы.
Мало информации относительно молекулярной регуляции распада белка у новорожденных. Были проведены несколько исследований недоношенных детей с целью выяснить, какие из систем распада белка являются активными и как они функционируют. Статьи на нашем сайте дадут общие представления о катаболизме белков.
Как только белок образовался, он сразу же становится объектом распада. Некоторые белки, такие как коллаген и гемоглобин, сравнительно устойчивы к деградации, и, следовательно, их оборот происходит медленно. Другие белки распадаются легко, особенно те, которые выполняют важную регулирующую функцию либо в той или иной степени повреждены, или те, которые имеют погрешность в аминокислотной последовательности, вызванную погрешностями в транскрипции.
Детали молекулярных основ распада белка, или протеолиза, описаны не столь подробно, как система синтеза белка. Однако подобно синтезу регулирование распада белка включает компонент, направленный на специфические белки, и компонент, который регулирует общий уровень распада белка в тканях и способствует изменениям в содержании белка. Примером того, как распад отдельного белка может вызвать заболевание, является муковисцидоз (кистозный фиброз).
Удаление фенилаланина в позиции 508 из CFTR приводит к дефектам сворачивания, чувствительным к температуре и преждевременному распаду в клетке, предотвращая перемещение фенилаланина к поверхности клетки. Отсутствие CFTR в эпителиальных клетках дыхательных путей нарушает гидратацию в их просвете и увеличивает восприимчивость к инфекции. Примером согласованного увеличения скорости деградации всех белков ткани, которое позволяет всей ткани адаптироваться к изменениям окружающей среды, является усиленный протеолиз белков мышечной ткани в ответ на ряд стрессовых состояний, в том числе на голодание, ацидоз и термическую травму.
В эукариотических клетках расщепление белка осуществляется большим количеством специфических и неспецифических протеаз. Большинство этих ферментов деградации может быть связано с одной из трех основных составляющих клеточного ращепления белка: убиквитин-протеасомным путем, аутофагально-лизосомальной системой, а также кальций- или кальпаин-зависимой системой.
Убиквитин-протеасомная система в основном разрушает внутриклеточные белки, в то время как аутофагально-лизосомальная система — белки мембраны и эндоцитозные белки. Кальций-зависимые тиоловые протеазы, известные как кальпаины, широко экспрессированы и вовлечены в ряд основных клеточных процессов, хотя их физиологическая функция в развитии организма человека недостаточно понятна.
Другой класс протеолитических веществ — это семейство каспаз, или ферментов, вызывающих распад белка. Каспазы являются основными участниками апоптоза, который удаляет старые, поврежденные или потенциально опасные клетки. Исследования сигнальных путей, регулирующих распад белка, доказали, что эти процессы сложны и являются столь же тщательно контролируемыми, как и процессы синтеза белка.
До чего распадаются белки
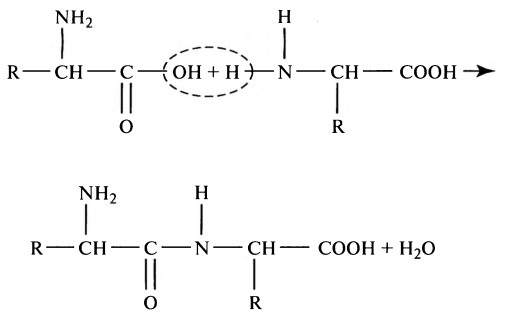
а) Пищевые белки. Пищевые белки химически представляют собой длинные цепи аминокислот, соединенных друг с другом пептидными связями. Далее представлена типичная связь:
Характеристика каждого белка определяется типом аминокислот в молекуле белка и последовательностью расположения этих аминокислот. Физические и химические характеристики различных белков, важных для человека, изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше).
б) Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Как объяснено в отдельной статье на сайте (просим вас пользоваться формой поиска выше), железы желудка секретируют большое количество соляной кислоты. Эта кислота секретируется париетальными (кислотопродуцирующими) клетками желез при рН, равным приблизительно 0,8. К моменту, когда кислота смешивается с желудочным содержимым и секретом из некислотопродуцирующих железистых клеток желудка, рН уже составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина.
Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. В связи с этим у индивида, у которого отмечается недостаток пепсина в желудочном соке, съеденное мясо хуже подвергается обработке другими пищеварительными ферментами и, следовательно, может хуже перевариваться.
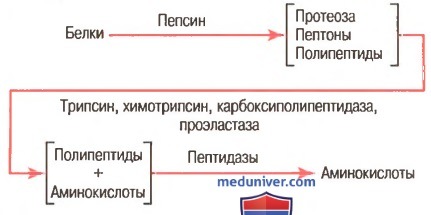
Как показано на рисунке выше, пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы, пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами.
в) Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы (для облегчения понимания просим вас изучить рисунок выше).
Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов.
г) Переваривание белков пептидазами энтероцитов, встроенных в ворсинки тонкого кишечника. Заключительный этап переваривания белков в просвете кишечника обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью.
Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дйпептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита.
Наконец, внутри цитозоля энтероцитов находятся другие многочисленные пептидазы, которые специфичны для оставшихся связей между аминокислотами. В течение нескольких минут практически все оставшиеся дипептиды и трипептиды перевариваются до конечной стадии в форме отдельных аминокислот; далее они выходят через другую сторону энтероцита, а отсюда — в кровь.
Более 99% конечных продуктов переваривания белков, которые всасываются, являются одиночными аминокислотами. Очень редко происходит всасывание пептидов и чрезвычайно редко всасывается целая молекула белка. Даже крайне малое число всосавшихся молекул цельного белка может иногда вызывать серьезные аллергические или иммунологические нарушения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Обмен белков все, что нужно знать об этом процессе
На основе чего стояться практически все планы питания? На белке! Хочешь похудеть – ешь больше белка. Хочешь набрать мышечную массу – ешь больше белка. Как работает этот универсальный нутриент? Давайте попробуем разобраться в таком вопросе, как обмен белков в организме человека.
Общие сведения
Как и в случае с другими нутриентами, процесс белкового обмена осложнен тем, что это – не конечный продукт метаболизма, а, значит, он должен пройти первичную трансформацию, благодаря которой приобретет нормальный вид для организма. Все дело в структуре молекулы белка. В первую очередь – это сложная структура с большим количеством внутренних связей. Как ни странно, но практически все органические соединения состоят из белковых тканей, или связаны теми или иными видами аминокислот.
Аминокислота – это базовая единица. Для простейшего сравнения мы можем проводить аналогии с глюкозой или ненасыщенными жирными кислотами, до которых распадается наша пища. Если все углеводы распадаются на одинаковые элементы, как и жиры, то, на какие аминокислоты распадется белок, зависит от его изначального состава и способа приготовления.
Так, изначально белок находиться в своей завершенной сложной структуре. И в этом виде, наш организм не способен его усваивать вовсе. Пробовали ли вы есть сырое мясо или яйца? Сколько всего вы можете съесть такого продукта в граммах, чтобы вам не стало плохо? Обычно, для нормального человека – это ограничивается 100-150 граммами, а то и меньше. Поэтому традиционно белок готовят на огне. В этот момент, под воздействием температуры, происходит его денатурация. Разрушение связей, которые удерживают молекулу в стабильном состоянии, называют денатурацией. Только в сильно денатурированном виде, наш организм способен справиться с дальнейшим разложением белка на аминокислоты. И даже в этом случае он прилагает значительные усилия для разрыва связей, чтобы не повредить сами аминокислоты, так как в случае повреждения, аминокислоты пережигаются до уровня простых углеводов.
Этапы распада белков в организме
Естественно, что первичный процесс переваривания, как и синтез новых тканей, происходит не одномоментно. Есть определенные ограничения, как в скоростном, так и в объемном метаболизме белков в клетках организма. Постараемся рассмотреть подробнее.
В первую очередь, идет процесс первичного переваривания. В отличие от метаболизма жиров или карбогидратов. Даже этот этап можно разделить на 2: первичное денатурирование белков до более простых кислот и дальнейшее всасывание в кишечнике.
Запомните: именно кишечник, а не желудок, отвечают за преобразование белков в аминокислоты и их дальнейшее всасывание.
Дальше у белка есть 2 пути. Первый путь – это когда в организме имеется недостаток в калориях. В этом случае, все аминокислоты, попавшие в кровь, закрывают дыры в разрушенных тканях, а оставшиеся пережигаются на энергию. В случае, если баланс калорийности и трат положительный, или организм имеет достаточно разогнанный метаболизм, то здесь ситуация другая. В этом случае аминокислоты проделают сложный путь и трансформируются во все необходимые для поддержание нормального функционирования сегменты, а из остатка будет синтезирован избыток мышечной ткани.
Факторы, влияющие на скорость и объем синтеза белка из внешних аминокислот
Рассматривая белковый обмен, как комплексный процесс, нужно учесть все факторы, которые влияют на синтез новых белковых структур из стандартных аминокислот. Так как при нарушении любого из них, все полученные путем сложной ферментации и денатурации аминокислоты просто уйдут в качестве энергии.
Виды белков
Несмотря на кажущуюся простоту, структура белковой ткани настолько сложна, что характеризуют их исключительно по аминокислотному составу. В то же время, существуют упрощенные классификации:
Рассмотрим полную классификацию белковых продуктов для того, чтобы понять, как те или
иные изделия метаболизируются в нашем организме.
| Тип белка | Источник белковой ткани | Скорость усвоения | Аминокислотный состав | Входящие аминокислоты |
| Сывороточный | Сыворотка, и классический сывороточный протеин. | Относительно высокая | Полный | Изолейцин, лейцин, валин, гистидин, аргинин, фенилаланин, триптофан, лизин. |
| Молочный | Любые молочные продукты. Начиная от молока и заканчивая сыром. | Относительно высокая | Полный | Изолейцин, лейцин, валин, гистидин, аргинин, фенилаланин, триптофан, лизин. |
| Мясной | Мышечные ткани животного происхождения. | Относительно высокая | Полный | Изолейцин, лейцин, валин,триптофан, лизин. |
| Яичный | Яйца различных животный. | Относительно невысокая | Полный | Изолейцин, лейцин, валин. |
| Соевый | Синтезируется или добывается из растительной сои. | Относительно невысокая | Неполный | Изолейцин, лейцин, валин, триптофан, лизин. |
| Растительный | В основном, это тот белок, который мы получаем с крупами, макаронами и выпечкой. | Предельно низкая | Неполный | Изолейцин, гистидин, аргинин, лейцин, валин. |
| Другие источники белка | В основном, это орехи или продукты синтезированного белка. | Вариативно | Зависит от самого источника белка | Изолейцин, лейцин, валин. Остальное зависит от самого источника белка. |
Белок и спорт
Для поддержания нормального уровня белкового метаболизма обычному человеку нужно употреблять порядка 1-го грамма чистого белка полного аминокислотным составом на килограмм тела. В то же время, спортсменам белок более важен. Поэтому они не только употребляют значительно большее количество белка, но и делят его на разные типы и употребляют в разное время. Так, в частности из-за возможности белковых тканей полностью останавливать катаболизм в мышечных тканях, очень часто быстрым источником белка является сыворотка или синтетический белок с предельной скоростью усваивания. В то же время, для замедления ночного катаболизма, спортсмены используют белок с низкой скоростью усваивания, которая помогает в ночное время поддерживать нормальный аминокислотный баланс в организме. Традиционно для этого используют творог или его субстраты.
Однако для чего спортсменам белок? Все очень просто. Для спортсмена обмен белков – это:
Нарушение обмена белковых тканей
Очень часто, рассматривая хронические и клинические нарушения обмена метаболизма у человека, люди не затрагивают процессы нарушения обмена белков. А ведь его намного легче получить, чем нарушение метаболизма в целом. Нарушение обмена белков получается в виду следующих причин:
В зависимости от причины, нарушение обмена белков может привести к разным последствиям. Однако в отличие от нарушения жирового обмена, он приведет не только к тому, что вы наберете лишние килограммы, но и может полностью вывести ваш организм из строя. Некоторые болезни, связанные с нарушением белкового обмена – панкреатит и панкреонекроз, могут и вовсе привести к смертельному исходу. Поэтому не стоит пренебрегать качественной белковой пищей в вашем рационе.
До чего распадаются белки
а) Обязательный распад белков. При отсутствии белков в пище некоторое количество собственных белков организма распадается до аминокислот и подвергается дезаминированию и окислению. Это количество составляет около 20-30 г/сут, его называют обязательной потерей белка. Чтобы предупредить распад собственного белка, необходимо ежедневно потреблять в пищу не менее 20-30 г белка; надежную гарантию от потерь такого рода дает ежедневное употребление 60-75 г белка.
Соотношение различных аминокислот в белках, входящих в пищевой рацион, должно быть приблизительно таким, как их соотношение в белках тканей организма для того, чтобы все они использовались для образования новых белков тканей практически полностью. Если один конкретный вид аминокислот не присутствует в нужной концентрации, то и все прочие перестают использоваться, т.к. клетки либо полностью синтезируют молекулу белка, либо не синтезируют его вовсе, о чем говорилось в главе 3 в связи с синтезом белка. Неиспользованные аминокислоты подвергаются дезаминированию и окислению. Белки, в которых соотношение аминокислот отличается от обычного, называют неполноценными. Такие белки менее пригодны в качестве питательных веществ, чем полноценные.
б) Влияние голодания на распад белков. Ежесуточные потери белка составляют 20-30 г. Для энергетических целей в организме используются только углеводы и жиры (пока они есть в наличии). Однако после нескольких недель полного голодания, когда запасы углеводов и жиров начинают истощаться, аминокислоты, присутствующие в крови, начинают быстро дезаминироваться и окисляться для получения энергии. С этого момента начинается быстрый распад белков — более 125 г/сут, в результате резко ухудшается функционирование клеток. Поскольку в качестве источников энергии используются в основном углеводы и жиры, а не белки, можно говорить об их сберегающей роли по отношению к белкам.
Гормональная регуляция метаболизма белка
а) Гормон роста стимулирует синтез белков в клетках. Гормон роста вызывает увеличение количества белков в тканях. Точный механизм этого влияния не известен, но предполагают, что он главным образом опосредован увеличением транспорта аминокислот через клеточные мембраны или ускорением процессов транскрипции ДНК и РНК наряду с процессами трансляции, направленными на синтез белка.
б) Инсулин необходим для синтеза белка. Полное отсутствие инсулина приводит к снижению синтеза белка практически до нуля. Механизм этого влияния также не известен, но доказано, что инсулин ускоряет транспорт некоторых аминокислот в клетки, что может являться стимулом для синтеза белка. Кроме того, инсулин увеличивает количество глюкозы в клетках, что приводит к соответствующему снижению использования аминокислот на энергетические нужды.
в) Глюкокортикоиды увеличивают распад большинства тканевых белков. Глюкокортикоиды, секретируемые корой надпочечников, снижают количество белка в большинстве тканей при одновременном увеличении концентрации аминокислот в плазме и увеличении количества белков как в печени, так и в плазме крови. Это дает основание предполагать, что глюкокортикоиды увеличивают скорость распада внепеченочных белков, увеличивая таким образом количество аминокислоты в жидких средах организма, что позволяет печени синтезировать большое количество белка в клетках печени и, соответственно, большое количество белков плазмы крови.
г) Тестостерон увеличивает депонирование белков в тканях. Тестостерон (мужской половой гормон) увеличивает отложение белков, в особенности мышечных сократительных белков (от 30 до 50%). Механизм такого влияния не известен, но он отличается от влияния гормона роста: гормон роста вызывает продолжительный рост тканей почти независимо от их типа и местоположения, в то время как тестостерон на протяжении всего нескольких месяцев стимулирует увеличение именно мышечной массы и в гораздо меньшей степени — количества белков в других тканях. Как только мышцы и другие белковые компоненты тканей достигают максимально возможной величины, дальнейшее накопление белка прекращается, несмотря на продолжающееся введение тестостерона.
д) Эстроген. Эстроген (главный женский половой гормон) также вызывает некоторое накопление белка в тканях, но его влияние по сравнению с влиянием тестостерона выражено незначительно.
е) Тироксин. Тироксин увеличивает скорость обменных процессов во всех клетках организма и в результате непрямым путем влияет на метаболизм белка. В случае дефицита углеводов и жиров, которые могли бы обеспечить энергетические потребности организма, тироксин вызывает быстрый распад белков и их использование в качестве источника энергии. Напротив, при наличии адекватного количества углеводов и жиров на фоне избытка аминокислот во внеклеточной жидкости тироксин может даже увеличивать скорость синтеза белков. У растущих животных или детей дефицит тироксина заметно замедляет рост в связи с прекращением синтеза белка. Можно предположить, что тироксин в целом не обладает специфическим влиянием на метаболизм белка, но вызывает общие стимулирующие эффекты применительно к скорости как катаболических, так и анаболических процессов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Немного о протеинах или белках
Исключительная познавательная информация о белках:
Большинство белков после переваривания всасываются в форме дипептидов, трипептидов и незначительное количество — в виде свободных аминокислот через мембрану эпителиальных клеток кишечника. Энергия для этого транспорта доставляется в основном механизмом натриевого котранспорта, аналогичного котранспорту глюкозы.
Аминокислоты, всасываемые из желудочно-кишечного тракта. Продукты переваривания и всасывания белков в желудочно-кишечном тракте представлены в основном аминокислотами. Очень редко полипептиды и целые молекулы белка поступают из желудочно-кишечного тракта в кровь. Сразу после еды концентрация аминокислот в крови повышается, но это увеличение в норме составляет всего несколько миллиграммов на децилитр, что объясняется двумя причинами: (I) для переваривания и всасывания аминокислот требуется 2-3 ч, поэтому только небольшое количество аминокислот может всасываться из кишечника сразу после еды; (2) сразу после появления в крови избытка аминокислот в течение 5-10 мин они абсорбируются всеми клетками организма, особенно клетками печени.
Запасание аминокислот в виде белков в клетках
Практически сразу после поступления в клетки тканей аминокислоты связываются друг с другом пептидными связями благодаря непосредственному влиянию матричной РНК и рибосомальных систем и образуют белки, поэтому концентрация аминокислот в клетках остается низкой. Кроме этого, свободные аминокислоты никогда не запасаются в клетках, их хранение возможно только в виде белков. Многие из этих внутриклеточных белков могут вновь быстро преобразовываться в аминокислоты под влиянием внутриклеточных лизосомальных пищеварительных ферментов. Появляющиеся при этом аминокислоты поступают в кровь. Исключение составляют только белки, присутствующие в ядре клетки и на хромосомах, и некоторые структурные белки (например, белки коллагеновых волокон и сократительные белки мышц ). Эти белки не принимают участия в процессах, приводящих к выходу из клеток аминокислот, составляющих белки, после их переваривания.
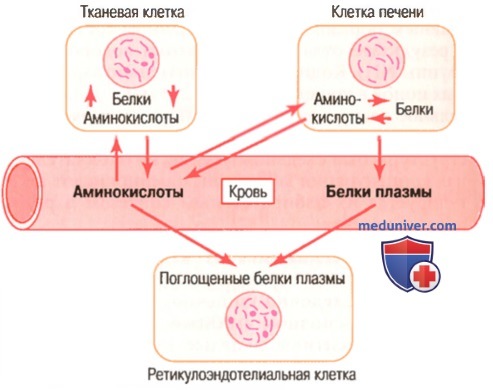
Динамическое равновесие между белками крови и белками тканей.
Между белками плазмы, аминокислотами плазмы и белками тканей постоянно существует состояние равновесия. В исследованиях с использованием радиоактивно меченных атомов было установлено, что в норме ежедневно синтезируются и распадаются около 400 г белка.
Даже во время голодания или тяжелых истощающих заболеваний отношение общего количества белков тканей к общему количеству белков плазмы в организме остается относительно постоянным, составляя приблизительно 33: I.
Использование белков на энергетические нужды
После дезаминирования аминокислот образующиеся кетокислоты в большинстве случаев могут окисляться с выделением энергии для метаболических нужд организма.
Превращение аминокислот в глюкозу или гликоген называют глюконеогенезом, а превращение в кето- или жирные кислоты — кетогенезом. Из 20 аминокислот 18 имеют химическую структуру, позволяющую им превращаться в глюкозу, а 19 из них могут превращаться в жирные кислоты.
При отсутствии белков в пище некоторое количество собственных белков организма распадается до аминокислот и подвергается дезаминированию и окислению. Это количество составляет около 20-30 г/сут, его называют обязательной потерей белка. Чтобы предупредить распад собственного белка, необходимо ежедневно потреблять в пищу не менее 20-30 г белка; надежную гарантию от потерь такого рода дает ежедневное употребление 60-75 г белка.
Влияние голодания на распад белков.
Ежесуточные потери белка составляют 20-30 г. Для энергетических целей в организме используются только углеводы и жиры ( пока они есть в наличии ). Однако после нескольких недель полного голодания, когда запасы углеводов и жиров начинают истощаться, аминокислоты, присутствующие в крови, начинают быстро дезаминироваться и окисляться для получения энергии. С этого момента начинается быстрый распад белков — более 125 г/сут, в результате резко ухудшается функционирование клеток. Поскольку в качестве источников энергии используются в основном углеводы и жиры, а не белки, можно говорить об их сберегающей роли по отношению к белкам.
Источник: Гайтон А.К., Холл Дж.Э., Медицинская физиология, 2008.