Двухростковая цитопения что это такое
Цитопения
Клиническая картина цитопении определяется степенью поражения различных ростков кроветворения и, соответственно, глубиной тромбоцитопении (петехиальная и синячковая кровоточивость, кровотечение со слизистых оболочек), лейкопении (частая инфекция, стоматит, ангина, некротическая энтеропатия, фурункулез) и анемии в различных сочетаниях. Анемические жалобы в дебюте заболевания обычно достаточно редки в связи с медленным снижением гемоглобина и постепенной адаптацией пациента, кроме случаев цитопении, вызванных гемолизом, когда анемия развивается быстро.
Уменьшение содержания форменных элементов в крови связано с их интенсивным разрушением в кровеносном русле и/или подавлением костномозгового кроветворения.
Причиной разрушения клеток крови может быть:
Цитопения чаще всего является симптомом гематологических заболеваний и практически никогда не бывает случайной находкой при скрининговом обследовании.
В связи с тем, что клиническая картина цитопении при всем многообразии ее причин однотипна, а основной причиной цитопении служит неэффективность гемопоэза, говорить о дифференциальной диагностике по клиническим проявлениям заболеваний невозможно. Исключение представляет цитопения, связанная с разрушением клеток крови в кровеносном русле, т.е. заболевания, протекающие со спленомегалией, и случаи острого иммунного гемолиза, для которого характерны лихорадка, резкая слабость, бледность и желтушность кожных покровов.
При системной красной волчанке цитопения достаточно редко является единственным признаком. Чаще она развивается уже на фоне артралгии, васкулита, нефрита, фотосенсибилизации, полисерозита.
Цитопения, обнаруженная при обследовании, проводимом в связи с прогрессирующей слабостью, потливостью, лихорадкой, лимфаденопатией, скорее всего связана с лимфопролиферативным заболеванием (лимфогранулематоз, лимфосаркома). Но в этих случаях только на основании жалоб пациента и данных осмотра невозможно исключить острый лимфобластный или острый миеломонобластный лейкоз.
В основном дифференциальная диагностика цитопении базируется на исследовании костномозгового кроветворения. Гипоплазию и аплазию кроветворения, так же как и метастатическое поражение костного мозга, можно диагностировать только после гистологического исследования трепанобиоптата, в котором жировой костный мозг преобладает над деятельным или обнаруживаются пласты атипичных клеток. Предположения об уменьшении клеточности костного мозга на основании исследования пунктата костного мозга недоказательны в связи с возможным разведением пунктата периферической кровью.
Трехростковая цитопения (анемия, грануло- и тромбоцитопения) и аплазия кроветворения (преобладание жирового костного мозга над деятельным в трепанобиоптате) являются основными критериями диагностики апластической анемии.
Двухростковая цитопения что это такое
Слово «цитопения» на медицинском языке означает снижение гемоглобина, лейкоцитов или тромбоцитов в крови, а «рефрактерная», или устойчивая, означает, что никакими витаминами, препаратами железа, диетой исправить ситуацию нельзя. В кроветворении выделяют 3 основных ветви, или ростка: красный росток (эритроидный), белый росток (лейкоцитарный) и тромбоцитный (тромбоцитарный). Слово «мультилинейная» говорит о том, что произошло нарушение взросления (созревания) двух или всех трех ростков крови.
Рефрактерная цитопения с мультилинейной дисплазией (РЦМД) – один из видов миелодиспластического синдрома, при котором из-за нарушения созревания ростков крови у пациента снижены два или все три основных составляющих элемента крови: гемоглобин, лейкоциты и тромбоциты. РЦМД – одна из самых частых видов миелодиспластического синдрома. Около 30% всех пациентов с МДС – это больные с таким заболеванием. Чаще всего заболевают люди в возрасте 70-79 лет.
Диагноз:
Диагноз «рефрактерная цитопения с мультилинейной дисплазией» ставят, если у пациента нет других причин для ухудшения состава крови и обнаружены типичные изменения в костном мозге. Причин изменений в анализах крови может быть много, поэтому РЦМД – это диагноз исключения, то есть его ставят тогда, когда все другие причины таких неблагоприятных изменений в крови исключены. Чтобы поставить диагноз РЦМД пациента всесторонне обследуют: делают цитологическое, цитогенетическое и гистологическое исследование костного мозга, другие специальные анализы. Это заболевание опасно тем, что оно постепенно может перейти (трансформироваться) в острый лейкоз, поэтому тщательное обследование нужно еще и для того, чтобы понять, как быстро произойдет эта трансформация и каковы в настоящий момент лечебные возможности для данного пациента.
Лечение
Если кровь обратившегося к врачу человека изменена незначительно и пациент чувствует себя в целом нормально, то с лечением можно повременить. Потом по необходимости делают переливания крови или ее компонентов. Если со временем у пациента появились предвестники перехода РЦМД в острый лейкоз, то лечение проводят по схемам рефрактерной анемии с избытком бластов. Если болезнь уже перешла в острый лейкоз (таких пациентов около 10%), то больного лечат от острого лейкоза. Молодых пациентов можно полностью вылечить с помощью пересадки стволовых (материнских) клеток крови. По данным мировой статистики, больные рефрактерной цитопенией с мультилинейной дисплазией живут в среднем около трех лет после того, как болезнь обнаружили и начали лечение.
Миелодиспластические синдромы (МДС)
Миелодиспластические синдромы (МДС) – разнородная группа хронических заболеваний крови, при которых происходит нарушение созревания клеток крови, с возможным переходом в лейкоз.
Ранее МДС имел различные названия (малопроцентный острый лейкоз, предлейкоз, тлеющая лейкемия и др.).
Заболеваемость МДС составляет 3-5 случаев на 100 тысяч населения в год. Более 85% пациентов старше 60 лет, причем риск развития заболевания с возрастом увеличивается. В 2/3 случаев МДС носит вторичный характер и развивается на фоне других заболеваний крови (множественная миелома, лимфогранулематоз, неходжкинские лимфомы, хронический лимфолейкоз) и после цитостатической терапии при ревматоидном артрите, системной красной волчанке, хроническом гломерулонефрите.
Причина заболевания окончательно не выяснена, определенную роль играют ионизирующее излучение, прием цитостатические препараты, производные бензола.
ДИАГНОСТИКА
Клинический анализ крови позволяет выявить анемию (малокровие), которая является самым частым симптомом МДС и обнаруживается в 85-90% случаев, лейкопению (снижение числа лейкоцитов), выявляемую у 50% больных и тромбоцитопению (снижение количества тромбоцитов), проводящую к кровотечениям.
Цитогенетический анализ позволяет определить изменения в хромосомном аппарате клеток крови и является ключевым методом диагностики и определения прогноза заболевания.
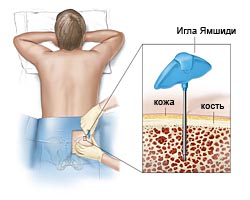
Аспирация (пункция костного мозга) и биопсия (трепанобиопсия) костного мозга – получение небольшого количества (0,2-0,5 мл) аспирата костного мозга и небольшого фрагмент кости. Процедура абсолютно безопасна и выполняется под местной анестезии в течение 2-5 мин. Может также проводиться амбулаторно. Исследования материала биопсий позволяют выявить изменения в костном мозге характерные для МДС.
У 20% пациентов можно выявить увеличение размеров селезенки, печени.
Выбор лечения определяется вариантом заболевания, прогнозом а также наличием сопутствующих заболеваний, которые могут существенно повлиять на терапию.
При благоприятном прогнозе и минимальных проявлениях заболевания можно ограничиться наблюдением за больным, пока показатели крови и костного мозга остаются стабильными.
При выраженном малокровии (анемии) показано переливание эритроцитарной массы, а при повышенной кровоточивости переливание тромбомассы. В ряде случаев возможно применение ростовых факторов (колониестимулирующие факторы).
Единственным методом лечения, позволяющим существенно увеличить продолжительность жизни больных МДС, является аллогенная трансплантация костного мозга/периферических стволовых клеток, Однако применение аллогенной трансплантации не всегда возможно в связи с пожилым возрастом большинства больных и отсутствием идентичного родственного донора.
До настоящего времени результаты лечения больных МДС остаются неудовлетворительными, в связи с этим не существует общепринятых стандартов лечения, а определены лишь общие подходы к терапии для разных групп больных при разных вариантах заболевания. Поэтому сохранение качества жизни пациентов с МДС в большинстве случаев, выходит на первый план при проведении лечения.
ЦИТОПЕНИЯ
ЦИТОПЕНИЯ (cytopenia; греческий kytos вместилище, здесь — клетка + penia бедность) — пониженное содержание форменных элементов в крови.
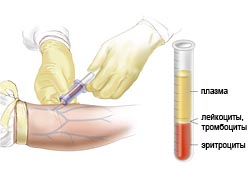
Различают эритроцитопению (у взрослых уменьшение количества эритроцитов менее 4 ООО ООО в 1 мкл), тромбоцитопению (у взрослых снижение количества тромбоцитов менее 150 000 в 1 мкл), лейкопению (у взрослых уменьшение количества лейкоцитов менее 4000 в 1 мкл) и панцитопению (снижение числа всех форменных элементов крови). Эти виды цитопении могут встречаться изолированно или в различных комбинациях (в последнем случае говорят о двухростковых или трехростковых цитопениях). Лейкопения (см.) чаще всего связана с уменьшением в крови абсолютного количества нейтрофилов (у взрослых менее 2000 в 1 мкл), то есть с нейтропенией, реже с лимфопенией (у взрослых количество лимфоцитов менее 1200 в 1 мкл), еще реже с моноцитопенией (у взрослых количество моноцитов менее 90 в 1 мкл); пониженное содержание эозинофильных и базофильных лейкоцитов в крови практически не отражается на общем количестве лейкоцитов.
Механизмы возникновения цитопении различны. Так, выделяют цитопению, развившиеся в результате уменьшения продукции кроветворных клеток в красном костном мозге, что наблюдается при гипопластической анемии (см.), некоторых формах врожденных цитопений, при цитостатической болезни (см. Лейкозы) и лейкозной инфильтрации красного костного мозга, метастазах рака в костный мозг, дефиците различных гемопоэтических факторов и др. Цитопении могут быть обусловлены замедленным выходом клеток крови из красного костного мозга, что происходит при синдроме ленивых лейкоцитов (резкое торможение их двигательной активности), при ряде наследственных нейтропений (см. Нейтропении наследственные), при поражении клеточных мембран некоторыми химиопрепаратами. Цитопении возникают в результате уменьшения времени циркуляции клеток в кровеносном русле, что отмечается при аутоиммунных и изоиммунных формах гемолитической анемии (см.), тромбоцитопениях (см.), агранулоцитозе (см.), спленогенных цитопениях (см. Селезенка), мегалобластной анемии (см. Пернициозная анемия), некоторых тромбоцитопатиях (см.), различных формах неиммунных гемолитических анемий (см. Гемолитическая анемия) и цитопений, обусловленных различными тяжелыми инфекционными и обширными воспалительными процессами. Цитопении могут быть связаны с перераспределением клеток крови внутри сосудистого русла и (или) поглощением их при внутрисосудистом свертывании крови, например, при стрессовых и шоковых состояниях, гиперволемии, массивных гемотрансфузиях (см. Переливание крови), синдроме диссеминированного внутрисосудистого свертывания (см. Геморрагические диатезы) и др.
При установлении цитопении для выяснения ее происхождения производят исследование красного костного мозга (см. Миелограмма), применяют прямые или косвенные тесты на выявление соответствующих антител, например, проба Кумбса (см. Кумбса реакция) и др.
Лечение при цитопении направлено на основное заболевание.
Цитопения у детей. Показатели крови у детей (в норме и при патологии), по данным различных исследователей, имеют широкий диапазон колебаний. Количество форменных элементов крови у детей, по результатам гемограммы, изменяется в зависимости от возраста и веса ребенка (см. Кровь). Лабильность показателей крови, особенно у детей раннего возраста, обусловлена незавершенностью кроветворения и несовершенством эндокринной, иммунной систем и коры головного мозга.
У детей цитопения может быть как приобретенной, так и конституциональной, но чаще она связана с наследственными и врожденными факторами. Так, в раннем детском возрасте встречается эритроцитопения при парциальной гипопластической анемии Джозефса — Даймонда — Блекфена (см. Гипопластическая анемия), при к-рой, по данным некоторых исследователей, имеется генетически обусловленное нарушение обмена триптофана (см.), а также обнаружены антитела против клеток эритроидно-го ряда костного мозга. При другой форме гипопластической анемии — анемии Фанкони, к-рая чаще развивается у детей 5 — 7 лет, наблюдается нарушение всех ростков кроветворения со снижением не только эритроцитов, но и лейкоцитов и тромбоцитов крови.
У детей эритроцитопения может быть обусловлена также повышенным гемолизом, напр., при микро-сфероцитарной гемолитической анемии, овалоцитарной гемолитической анемии (см. Гемолитическая анемия), талассемиях (см.), при дефиците глюкозо-6-фосфат-дегидрогеназы (см. Энзимопеническая анемия). Эритроцитопении у новорожденных наблюдаются при несовместимости антигенов эритроцитов матери и ребенка (см. Гемолитическая болезнь новорожденных).
Быстрый рост ребенка в раннем возрасте требует повышенного синтеза гемоглобина и усиленного обмена железа, поэтому при неправильном питании может возникнуть дефицит фолиевой к-ты и витамина В12, в результате чего развивается эритроцитопения.
В отличие от взрослых эритроцитопении у детей реже связаны с кровопотерями, за исключением геморрагических диатезов (см.).
Из наследственных болезней системы крови у детей наблюдаются нейтропении, которые, как полагают, обусловлены нарушением миграции нейтрофилов, их фагоцитарной активности вследствие снижения активности щелочной фосфатазы и увеличения кислой фосфатазы (см. Нейтропении наследственные).
Среди приобретенных цитопений наиболее часто встречаются иммунные цитопении — аутоиммунные гемолитические анемии, нейтропении (см. Лейкопения)) и тромбоцитопении (см. Тромбоцитопения). Часто они протекают остро и наблюдаются после очаговой инфекции. Описаны транзиторные нейтропении и тромбоцитопении у новорожденных в результате присутствия материнских агглютининов к клеткам крови.
Проводится лечение основного заболевания.
Библиогр.: А л м а з о в В. А. и др. Лейкопении, Л., 1981; Гольдберг Д. И., и Гольдберг Е. Д. Справочник по гематологии с атласом микрофотограмм, Томск, 1980; Кассирский И. А. и Алексеев Г. А. Клиническая гематология, М., 1970; К и с л я к Н. С. и Л е н с к а я Р. В. Клетки крови у детей в норме и патологии, М., 1978; Мо-с я г и н а E. Н., ТорубароваН. А., и Владимирская Е.Б. Болезни крови у детей, Атлас, М., 1981; Новое в гематологии, под ред. А. И. Воробьева и Ю. И. Лорие, М., 1974; Руководство по гематологии, под ред. А. И. Воробьева и Ю. И. Лорие, М., 1979; Файнштейн Ф. Э. и д р. Болезни системы крови, Ташкент, 1980.
НОВАЯ КЛАССИФИКАЦИЯ МИЕЛОДИСПЛАСТИЧЕСКИХ (ПРЕДЛЕЙКЕМИЧЕСКИХ) СИНДРОМОВ
Миелодиспластические синдромы (МДС) — группа клональных заболеваний, связанных с поражением гемопоэтической стволовой клетки, харак-теризующихся цитопенией, наличием признаков дисплазии кроветворных кле-ток и повышенным риском развития острых лейкозов. В соответствии с новой классификацией ВОЗ выделяют следующие основные формы МДС: рефрактерные цитопении, рефрактерная анемия с кольцевыми сидеробластами, рефрактерная цитопения с мультилинейной дисплазией, рефрактерная анемия с избытком бластов (РАИБ-1, РАИБ-2), МДС неклассифицируемый, МДС, ассоциированный с del(5q), и рефрактерная анемия детского возраста.
Миелодиспластические синдромы (МДС) — гетерогенная группа клональных заболеваний, в основе возникновения которых лежит поражение гемопоэтической стволовой клетки (ГСК), сопровождающееся неэффективным гемопоэзом, диспластическими изменениями, затрагивающими клетки одной или нескольких линий миелопоэза, повышенным риском развития острых миелоидных лейкозов (ОМЛ).
мические вещества (свинец, мышьяк), противоопухолевые и антивирусные препараты. Термин «миелодиспластические синдромы» (синонимы — «дисмиелодиспластические синдромы», «олигобластный лейкоз») свидетельствует о наличии заболевания кроветворной ткани опухолевой природы, сочетающегося с признаками миелодисплазии.
МДС встречается преимущественно у лиц пожилого и преклонного возраста. Ежегодно заболеваемость в большинстве стран мира составляет 3,0–5,0 на 100 тыс. населения, но возрастает до 20,0 на 100 тыс. у лиц старше 70 лет [1]. Различают МДС, возникающие спонтанно (de novo), и вторичные МДС, развивающиеся в результате применения алкилирующих препаратов и/или лучевой терапии. К числу этиологических факторов, вызывающих возникновение первичных МДС, относят бензол, курение сигарет, воздействие химических веществ, применяющихся в сельском хозяйстве, а также органических растворителей [2].
При МДС могут поражаться все три ростка гемопоэза. Характерным является наличие признаков цитопении при исследовании периферической крови (ПК), сочетающейся с гиперили нормоклеточностью костного мозга (КМ). В качестве основного
патогенетического механизма МДС рассматривается увеличение степени апоптоза активно пролиферирующих ГСК. Процессы программированной гибели ассоциируются с изменениями экспрессии в кроветворных клетках прои антиапоптотических белков. В популяции CD34-положительных бластных клеток КМ у больных с МДС по сравнению с нормой увеличено соотношение продуктов экспрессии онкогенов c-MYC и BCL-2 (соответственно усиливающих апоптоз и повышающих выживаемость клеток) [1].
Важную роль в индукции апоптоза в клетках КМ играет система, включающая антиген Fas/Apo (CD95) и его лиганд Fas-L, которые при иммуноцитохимическом исследовании обнаруживаются на поверхностных мембранах клеток при МДС и не определяются на CD34 + CD14 + клетках в норме. Установлена также корреляция между интенсивностью программированной гибели клеток эритробластического, гранулоцитарного, мегакариоцитарного ряда и стромальных клеток при МДС и экспрессией фактора некроза опухоли α (ФНО-α) и трансформирующего фактора роста β (ТФР-β). С увеличением интенсивности апоптоза при МДС ассоциируется повышенная экспрессия белка р53.
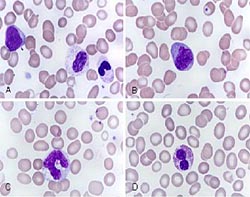
Современная классификация МДС (ВОЗ, 2008) позволяет более четко выделить гомогенные подгруппы больных и имеет большую прогностическую значимость [3]. Она основывается на определении процентного содержания бластов в КМ и ПК, типа и степени диспластических изменений в клетках эритробластического, гранулоцитарного и мегакариоцитарного ряда, данных кариотипирования и молекулярно-генетического анализа (таблица).
При диагностике МДС с целью выявления диспластических изменений должны использоваться идеально приготовленные из свежего материала и хорошо окрашенные мазки. Мазки из проб крови или КМ, подвергавшиеся действию антикоагулянтов на протяжении более двух часов, для этих целей непригодны. Процентное содержание бластов
Данные исследования ПК и КМ при МДС (ВОЗ, 2008)
Рефрактерная цитопения с однолинейной
дисплазией (РЦОД) Рефрактерная анемия (РА);
Рефрактерная нейтропения (РН);
Рефрактерная тромбоцитопения (РТ)
Однолинейная цитопения или бицитопения
Бласты отсутствуют или определяются крайне редко ( 9 /л моноцитов
Дисплазия в ≥ 10% клеток двух или более линий
миелопоэза (нейтрофилы и/или эритроидные предшественники и/или мегакариоциты)
Однолинейная или мультилинейная дисплазия
Отсутствие палочек Ауэра
Рефрактерная анемия с избытком бластов-2
5–9% бластов Палочки Ауэра ±
Однолинейная или мультилинейная дисплазия
10-19% бластов Палочки Ауэра ±
Миелодиспластический синдром некласси-
РЦОД составляет 10-20% всех случаев МДС и чаще встречается у пациентов пожилого возраста (около 65–70 лет), большинством из которых являются больные РА. Однако РН и РТ, наблюдающиеся крайне редко, требуют особого внимания при установлении диагноза. При установлении диагноза РЦОД должны быть исключены проявления дисплазии костномозгового кроветворения неклональной природы, связанные с действием лекарственных препаратов, токсических соединений, с вирусной инфекцией, а также с иммунологическими нарушениями, врожденными заболеваниями, недостаточностью витаминов и т.д.
Рефрактерная анемия. Эритроциты ПК — нормохромные и нормоцитарные, или нормохромные и макроцитарные. Варьирует степень анизоцитоза и пойкилоцитоза. Определяемая при проведении общего анализа крови анемия устойчива к проводимой терапии. Выраженная в умеренной степени лейкопения не сопровождается существенными изменениями в лейкограмме. Морфология нейтрофилов, как правило, не изменена. Лишь в некоторых случаях в ПК определяются агранулярные нейтрофильные палочкои сегментоядерные лейкоциты. Количество тромбоцитов колеблется в пределах нормы, лишь изредка обна-
руживаются гигантские тромбоциты. Бластные клетки в ПК встречаются редко. При этом их количество, как правило, не превышает 1%. Абсолютное количество моноцитов в крови — менее 1,0 х 10 9 /л.
Пунктат КМ у подавляющего большинства больных гиперклеточный. Значительно увеличено количество незрелых ядросодержащих клеток эритробластического ряда. Эритропоэз — нормобластический, макронормобластический или мегалобластический. Эритроидные клетки — с умеренными или выраженными признаками дисплазии. Характерными для дисэритропоэза являются изменения ядер клеток (фрагментация, дольчатость, наличие межъядерных мостиков, кариорексис, многоядерность). В цитоплазме происходят следующие изменения: вакуолизация, диффузное или гранулярное окрашивание при проведении PAS-реакции. Кольцевые сидеробласты, выявляемые при окраске по Перлсу, составляют не более 15% эритроидных клеток-предшественников. Миелобласты составляют менее 5% от общего количества миелокариоцитов. Палочки Ауэра в их цитоплазме не обнаруживаются. При гистологическом исследовании трепанобиоптатов КМ определяются признаки гиперплазии, преимущественно за счет клеток эритробластического ряда. У немногих больных КМ может быть нормоклеточным и даже гипоклеточным.
Различного типа приобретенные клональные цитогенетические аномалии при РА наблюдаются у 50% больных. Они важны для диагностики указанной формы МДС, но не являются специфическими. К числу наиболее часто встречающихся относятся del(20q), +8, аномалии хромосом 5 и/или 7.
Рефрактерная нейтропения. Характеризуется диспластическими изменениями в 10% и более нейтрофилов ПК и КМ, которые проявляются главным образом в наличии гиподольчатых ядер и гипогранулярной цитоплазмы. В клетках других линий миелопоэза значительных проявлений дисплазии не отмечается. Следует исключить вторичную нейтропению, вызванную применением лекарственных средств, воздействием токсических препаратов, обусловленную иммунными механизмами.
зующийся анемией, морфологическими признаками дисплазии в клетках эритробластического ряда и наличием кольцевых сидеробластов (КС) в КМ, количество которых превышает 15%. Выраженных признаков дисплазии в клеточных элементах других линий миелопоэза не отмечается. Содержание миелобластов в КМ ниже 5%, а в ПК они не определяются или их содержание в лейкограмме не превышает 1%. РАКС составляет 3–11% всех случаев МДС. Встречается преимущественно у пожилых людей, с одинаковой частотой у мужчин и женщин. Средний возраст больных составляет 60–73 года.
Клинические проявления обусловлены наличием нормохромной макроцитарной или нормохромной нормоцитарной анемии. У некоторых больных могут дополнительно обнаруживаться признаки тромбоцитопении и нейтропении. В части случаев в ПК может определяться популяция гипохромных ядросодержащих клеток эритробластического ряда с признаками дефектной гемоглобинизации цитоплазмы.
В КМ больных РАКС определяются признаки гиперплазии клеток эритробластического ряда. Признаки дисплазии проявляются в дольчатости ядер клеток эритробластического ряда, появлении клеток с мегалобластоидными признаками. Содержание клеток гранулоцитарного и мегакариоцитарного ряда с диспластическими признаками не достигает 10%. При окраске по Перлсу мазков из стернального пунктата КМ определяется 15% и более КС, содержащих пять и более гранул железа, окружающих не менее одной трети ядра. Нередко обнаруживается значительное количество содержащих гемосидерин макрофагов. При РАКС гранулы железа, которые на ультраструктурном уровне локализуются в митохондриях, определяются и в наименее дифференцированных клетках эритробластического ряда. Клональные хромосомные аномалии в кроветворных клетках выявляются у 5–20% больных РАКС.
Медиана выживаемости больных колеблется в пределах 69–108 мес. Трансформация в острый лейкоз происходит крайне редко (в 1–2% случаев). Рефрактерная цитопения с мультилинейной дисплазией (РЦМД). РЦМД составляет около 30% всех случаев МДС. Это тип МДС, при котором при исследовании ПК у больных, помимо анемии, отмечаются признаки бицитопении или панцитопении. Диспластические изменения обнаруживаются более чем в 10% клеток двух или более линий миелопоэза. Содержание бластных клеток в ПК — менее 1%, а в КМ — менее 5%. Количество моноцитов в ПК менее 1,0 х 10 9 /л. Палочки Ауэра в цитоплазме кроветворных клеток не обнаруживаются. РЦМД диагностируется преимущественно у людей старше 70 лет. Пик заболеваемости у мужчин, болеющих РЦМД несколько чаще, приходится на возраст 70–
74 года, а у женщин — на 75–79 лет.
При исследовании мазков из стернального пунктата, как правило, определяется гиперклеточность КМ. Диспластические изменения в нейтрофилах
проявляются в уменьшении количества гранул в цитоплазме и гипосегментации ядер (псевдопельгеровские лейкоциты). У некоторых больных наблюдается повышенное содержание молодых и незрелых клеток эритробластического ряда. Встречаются эритроидные клетки с ядрами неправильной формы и многодольчатыми, наличием вакуолизированной цитоплазмы. Обнаруживаются мегалобласты. При PAS-реакции в клетках эритробластического ряда отмечается диффузное или гранулярное окрашивание цитоплазмы. Наиболее часто повторяющиеся диспластические изменения в мегакариоцитах — гиподольчатость ядер и наличие микроформ с двудольчатыми ядрами [6].
Почти у 50% больных РЦМД выявляются клональные аномалии хромосом — трисомия 8, моносомия 7, del(7q), моносомия 5, del(5q), del(20q) и более сложные изменения кариотипа [5].
Прогностические факторы обусловлены выраженностью цитопении и дисплазии. Медиана выживаемости больных РЦМД составляет 30 мес. У больных со сложными изменениями кариотипа она сходна с наблюдающейся у больных с РАИБ [3]. Трансформация в острый лейкоз на протяжении первых двух лет заболевания у пациентов с РЦМД составляет до 10%.
При изучении срезов трепанобиоптатов КМ обнаруживаются изменения нормальной гистопографии. Отмечается смещение очагов эритропоэза и мегакариоцитопоэза к паратрабекулярным зонам, которые в норме заняты преимущественно клеточными элементами гранулоцитопоэза. Бласты при РАИБ имеют тенденцию к образованию кластеров, не связанных с костными трабекулами и сосудами. Прежде эти данные гистологического исследования расценивались в качестве аномальной локализации незрелых клеток-предшественников (ALIP). Для идентификации подобных кластеров особенно ценным может быть иммуногистохимическое определение CD34-положительных клеток. Почти у 15% больных с РАИБ при гистологическом исследовании трепанобиоптатов КМ обнаруживаются признаки выраженного фиброза. В этих случаях необходима дифференциальная диагностика с МДС, связанным с терапией, с миелопролиферативными новообразованиями и реактивными состояниями, сопровождающимися рядом других заболеваний (коллагенозы, метастатические поражения КМ, миелопатия при ВИЧ-инфекции и т.д.).
Важную роль в диагностике РАИБ призваны играть результаты иммунофенотипирования. В частности, при использовании методов проточной цитофлуориметрии в ПК и КМ определяется увеличенное количество клеток, экспрессирующих ассоциированные с гемопоэтическими клеткамипредшественниками антигены CD34 и/или CD117. На этих же клетках обычно выявляются антигены CD38, HLA-DR и миелоидно-ассоциированные антигены CD13 и/или CD33. В популяции бластных клеток может обнаруживаться асинхронная экспрессия антигенов, связанных с созреванием клеток гранулоцитарного ряда — CD15, CD11b и/или CD65. В 20% случаев на бластных клетках определяется аберрантная экспрессия антигена CD7 и у 15% больных — CD56. Крайне редко выявляется экспрессия других лимфоидных маркеров [6]. Клональные цитогенетические аномалии, включая
Для установления прогноза заболевания, определения выживаемости больных и частоты трансформации в ОМЛ важное значение имеет выделение 2 основных категорий РАИБ. Определяющим при идентификации РАИБ-1 является наличие до 5% бластов в ПК и 5–9% бластных клеток в КМ. Диагноз РАИБ-2 устанавливается при наличии в КМ 10–19% бластов. К этой же категории должны быть отнесены больные, у которых в КМ определяется менее 10% бластов, но содержание бластных клеток в ПК колеблется в пределах 5–19%. Наличие в бластах палочек Ауэра позволяет автоматически квалифицировать тот или иной случай как РАИБ-2, независимо от процентного содержания бластов в ПК и КМ. Медиана выживаемости больных с РАИБ-1 составляет 16 мес, а пациентов с РАИБ-2 — 9 мес. При наличии палочек Ауэра в цитоплазме клеток медиана выживаемости составляет 12 мес. С плохим прогнозом ассоциируется экспрессия на поверхностных мембранах бластных клеток антигена CD7 [3].
Миелодиспластический синдром с изолированной del(5q). МДС с изолированной делецией хромосомы 5 (5q-синдром) характеризуется наличием анемии с/без других видов цитопении и/или тромбоцитозом. Единственной выявляемой цитогенетической аномалией является del(5q). При 5q-синдроме содержание миелобластов составляет менее 5% всех ядросодержащих клеток КМ и менее 1% клеток ПК. Лейкоциты с палочками Ауэра в цитоплазме отсутствуют. Термин «5q-синдром», как правило, используется для обозначения случаев с наличием макроцитарной анемии, нормальным или повышенным количеством тромбоцитов и гиперплазией клеток эритробластического ряда в КМ.
РАКС, РЦМД, РАИБ. Встречается преимущественно у пожилых людей, но может диагностироваться и у детей. Симптоматика в основном такая же, как и при других формах МДС. Не выявляются и какиелибо специфические изменения цитоморфологических признаков кроветворных клеток.
Диагноз МДС-Н устанавливается в следующих случаях. Во-первых, у больных с рефрактерной цитопенией, затрагивающей один или два ростка гемопоэза, и однолинейной или мультилинейной дисплазией и наличием 1% бластов в ПК. Во-вторых, в случае МДС с однолинейной дисплазией, которая сочетается с панцитопенией. И, наконец, у больных с персистирующей цитопенией(ями) при содержании бластов в ПК менее 1% и в КМ менее 5% и наличии признаков дисплазии менее чем в 10% клеток одной или более линий миелопоэза. При этом должны определяться цитогенетические аномалии, выявляемые при том или ином подтипе МДС. Динамическое клинико-гематологическое наблюдение позволяет проследить эволюцию МДС-Н в один из специфических подтипов заболевания.
Миелодиспластический синдром в детском возрасте. МДС в детском возрасте встречается нечасто, составляя менее 5% всех опухолей кроветворной и лимфоидной тканей у детей младше 14 лет. Ежегодная заболеваемость МДС составляет 0,18 на 100 тыс. детского населения, в то время как частота ОЛЛ — 3,85, а ОМЛ — 0,54. Первичный, или возникающий de novo, МДС следует отличать от «вторичных МДС», обусловленных врожденными или приобретенными нарушениями костномозгового кроветворения, и МДС, связанного с терапией, развивающегося после действия цитотоксических препаратов, которые применяются для лечения детей с опухолями или с неонкологическими заболеваниями. Кроме того, в соответствии с новой классификацией ВОЗ (2008), к рассматриваемой нозологической форме не относится МДС, ассоциированный с синдромом Дауна. Наряду с ОМЛ и транзиторным аномальным миелопоэзом, он включен в новую категорию «Миелоидные пролиферации, связанные с синдромом Дауна».
У детей с МДС отмечаются те же морфологиче-
ские, цитохимические и иммунофенотипические признаки, что и у взрослых больных. В то же время наблюдаются и существенные отличия, особенно у тех пациентов, у которых не обнаружено увеличения содержания бластов в ПК и КМ. Так, у детей крайне редко диагностируются такие подтипы заболевания, как РАКС и МДС с изолированной del(5q) аномалией хромосом. Анемия, которая служит основным признаком, позволяющим заподозрить РА у взрослых, не так часто определяется у детей. В детском возрасте манифестация заболевания чаще связана с развитием нейтропении и тромбоцитопении [2]. У детей с МДС значительно чаще, чем у взрослых, наблюдается гипоклеточность КМ. Эти различия подчеркиваются введением в современную классификацию (ВОЗ, 2008) опухолей кроветворной
и лимфоидной тканей в качестве новой нозологической формы «Рефрактерная цитопения детского возраста (РЦДВ)».
РЦДВ (синоним — рефрактерная анемия детского возраста) — разновидность МДС, характеризующаяся персистентной цитопенией с наличием менее 5% бластов в КМ и менее 2% бластов в ПК [3]. Для установления диагноза РЦДВ требуется выявление диспластических изменений. Однако цитологическая оценка дисплазии — лишь один из аспектов установления морфологического диагноза. При диагностике РЦДВ обязательным является гистологическое изучение трепанобиоптата КМ. У 75% детей с РЦДВ наблюдается выраженная гипоклеточность КМ. При этом чрезвычайно важно дифференцировать РЦДВ и другие нарушения костномозгового кроветворения, особенно при приобретенной апластической анемии и наследственных нарушениях костномозгового кроветворения. РЦДВ — наиболее частый подтип МДС в детском возрасте. На его долю приходится почти 50% всех случаев заболевания. Диагностируется во всех возрастных группах, с одинаковой частотой у мальчиков и девочек. Предполагаемый источник возникновения — ГСК с мультилинейным потенциалом.
Наиболее частые клинические проявления — недомогание, кровоточивость, лихорадка, инфекции. Не отмечается наличия спленои гепатомегалии. Вторичная лимфаденопатия, связанная с локальным или системным инфекционным процессом. У 75% детей с РЦДВ содержание тромбоцитов в крови не превышает 150 х 10 9 /л, у 50% больных выявляется анемия. Как правило, наблюдается снижение количества лейкоцитов в ПК, а у 25% больных отмечается выраженная нейтропения. В мазках из пунктата КМ содержится менее 5% миелобластов, выявляются диспластические изменения в клетках двух различных линий миелопоэза или более чем в 10% клеток одной линии. В гистологических срезах трепанобиоптатов, являющихся нормоили гиперклеточными, отмечается некоторое усиление эритропоэза с увеличением количества незрелых клеток эритробластического ряда, в основном проэритробластов. Незрелые клетки эритробластического ряда образуют островки, содержащие не менее 10 клеток. Эти небольшие очаги эри-
тропоэза сочетаются с относительно равномерно рас
пределенными в срезах клетками гранулоцитарного ряда. Увеличивается количество мегалобластоидных клеток. Содержание бластов, не образующих кластеров, не достигает 5%, и для их идентификации используется иммуногистохимическое определение антигена CD34. Количество мегакариоцитов уменьшено, в них определяются диспластические изменения.
Для идентификации микромегакариоцитов в срезах трепанобиоптатов КМ при РЦДВ проводится иммуногистохимическое исследование с использованием моноклональных антител к антигену CD61 (гликопротеину IIIa), к антигену CD41 (гликопротеину IIb/IIIa) или фактору Виллебранда.
К числу наиболее частых цитогенетических аномалий относится моносомия 7. У большинства же больных РЦДВ, независимо от клеточного состава КМ, определяется нормальный кариотип. У больных с моносомией 7 отмечается более быстрое прогрессирование заболевания, чем у пациентов с трисомией 8 или нормальным кариотипом. В настоящее время у некоторых пациентов с РЦДВ эффективной является иммуносупрессивная терапия. Методом выбора может быть трансплантация ГСК.