Fish исследование что это
FISH-возможности использования в гематологической клинике

За последнее десятилетие в гематологической цитогенетике произошли принципиально важные изменения, связанные с появлением и быстрым развитием молекулярно-цитогенетических исследований. Развитие молекулярной цитогенетике позволило перейти на новый уровень изучения клональных генетических нарушений, лежащих в основе развития онкогематологических заболеваний.
Предметом анализа в подобном исследовании являются не только метафазы, но и неделящиеся клетки, составляющие абсолютное большинство клеток в любой популяции. Гибридизация происходит со всеми клетками независимо от фазы клеточного цикла. Это означает что для анализа доступны клеточные популяции в целом, что координально изменяет ситуацию по сравнению с классической цитогенетикой. Становятся доступными для анализа те случаи, когда невозможно получить делящиеся клетки. Кроме того, исключается фактор выборочного выхода в митоз определенных популяций клеток, который при анализе метафаз способен порой существенно исказить реальную картину. Возможность анализа всех без исключения клеточных популяций, присутствующих в исследуемом препарате, включая терминально-дифференцированные клетки, делает метод FISH объективным и репрезентативным методом исследования. С введением в практику этого метода стремительно стало нарастать количество исследований по его использованию в клинической цитогенетике, в том числе применительно к онкогематологическим заболеваниям. В настоящее время метод FISH является важнейшем инструментом для цитогенетического анализа клональных нарушений у гематологических больных.
ДНК-зонды, используемые для FISH-исследования представляют собой созданные по специальным технологиям нуклеотидные последовательности ограниченного размера. ДНК-зонд несет «метку», то есть содержит нуклеотиды, напрямую связанные с флуорохромом, или связанные с гаптеном для дальнейшей визуализации антителами, несущими флуорохром. В основе метода лежит проведение реакции гибридизации между ДНК-зондом и комплементарным ему участком ядерной ДНК препарата, нанесенного на предметное стекло. Связанная с ДНК-зондом метка может быть визуализирована с помощью флуоресцентного микроскопа и позволяет определить место связывания зонда в интерфазном ядре или на метафазной пластинке.
Флуоресцентная гибридизация in situ включает несколько обязательных этапов: денатурации, гибридизации, выявления (детекции) ДНК-зонда.
Полученные одиночные полинуклеотидные цепи ДНК вступают затем в реакцию гибридизации с предварительно денатурированным в тех же условиях ДНК-зондом. Обязательным условием эффективной гибридизации является многократное избыточное количество зонда по отношению к количеству ядерной ДНК. Только в этом случае зонд может успешно конкурировать за место связывания со второй комплементарной цепью ДНК, присутствующей на стекле. Инкубацию проводят в гибридизационном буфере при 37 °C, время гибридизации зависит от типа используемого зонда. В результате гибридизации вновь образуется двухцепочечная молекула, включившая ДНК-зонд, связанный с комплементарной ему последовательностью нуклеотидов. После этого полученные препараты многократно отмывают для удаления несвязавшегося избытка зонда и предотвращения возможного неспецифического связывания его с другими участками ДНК.
Задачей следующего этапа является идентификация встроенного ДНК-зонда и проведения визуального анализа с помощью флуорисцентного микроскопа. Этот этап зависит от типа используемого ДНК-зонда. В случае, если ДНК-зонд был «помечен» гаптеном, для его детекции применяют иммунохимическое связывание с несущими флуорохром антителами. При использовании ДНК-зондов, уже содержащих в своем составе флуорохром, этого этапа не требуется.
Следующим шагом является контрастное по цвету окрашивание клеточных ядер с помощью ДНК-специфичного флуоресцентного красителя. После этого препарат готов к анализу с помощью флуоресцентного микроскопа, где под воздействием возбуждающего света определенного спектра, молекулы флуорохромов начинают испускать кванты света, длина волны которых зависит от свойств используемого флуорохрома. Анализ флуоресцентных сигналов позволяет получить объективную информацию о состоянии исследуемого хромосомного локуса.
ДНК-зонды являются центральным и определяющим звеном при проведении in situ гибридизации. Необходимо всегда помнить, что та или иная хромосомная аномалия может быть выявлена только в том случае, если в распоряжении исследователя имеется соответствующий задаче ДНК-зонд. От типа зонда зависит и система анализа наблюдаемых флуоресцентных сигналов. Поэтому полная информация о специфике используемого зонда является залогом успешной гибридизации и правильной оценки полученных результатов FISH-анализа.
ДНК-зонды бывают двух типов – непрямые и прямые, в зависимости от того, каким образом они помечены. В непрямых ДНК-зондах в синтезированную полинуклеотидную цепь включены нуклеотиды, к которым присоединены гаптены: биотин (витамин H) или дигоксигенин (фитогормон). Эти биологически активные вещества имеют небольшого размера молекулы, обладают термоустойчивостью и легко выдерживают жесткие условия тепловой денатурации ДНК и горячего отмывания препаратов при проведении гибридизации, кроме того они недороги и удобны в работе.
Детекция биотинилированных ДНК-зондов основана на высоком сродстве к биотину белка авидина. Конъюгированный с флуорохромом авидин необратимо связывается с молекулами биотина, наблюдается затем флуоресцентный сигнал позволяет обнаружить ДНК-зонд в клеточном ядре. Меченые дигоксигенином ДНК-зонды инкубиуют с антителами к дигоксигенину, конъюгированными с флуорохромом. Интенсивность флуорисценции непрямых зондов может быть усилена за счет дополнительной инкубации с меченными флуорохромом антителами. Эта возможность усиления флуорисцентного сигнала повышает чувствительность метода при использовании непрямых зондов.
При использовании прямых ДНК-зондов, уже содержащих в своем составе флуорохром, дополнительного инкубирования с антителами естественно не требуется.
В качестве флуорохромов для мечения зондов чаще всего используют зеленый флуоресцеин (FITC), красные родамин и техасский красный (Texas Red). Для визуализации ядерного материала на препараты наносят раствор, содержащий флуорохром, тропный кДНК. В состав раствора входит также вещество, предохраняющее флуорохромы от быстрого истощения.
Основными флуорохромами, используемыми для визуализации клеточных ядер, являются красный пропидиум йодид (PI) и голубой 4.6 диамино-2-фенилиндол (DAPI). Главный принцип при подборе флуорохромов – это принцип цветового контраста.
ДНК-зонды, применяемые в гематологической цитогенетике, можно подразделить на несколько групп.
ДНК-зонды к центромерным участкам хромосом предназначены для идентификации центромерных регионов хромосом и выявления количественных нарушений кариотипа в интерфазных ядрах и метафазах. Эти зонды содержат сравнительно короткие последовательности нуклеотидов, комплементарные многочисленным хромосом-специфическим альфа-сателлитным ДНК-повторам, локализованным в центромерных участках хромосом. Поэтому для зондов этого типа характерна строгая хромосомная специфичность и яркость генерированного флуоресцентного сигнала.
Для выявления диагностически и прогностически значимых количественных хромосомных нарушений в гематологии используют индивидуальные центромерные зонды, например к хромосомам 7,8,12,X/Y. При использовании одного центромерного ДНК-зонда в нормальном интерфазном ядре или метафазе наблюдается два ярких флуоресцентных сигнала. В случае изменения числа копий данной хромосомы наблюдается один (моносомия), три (трисомия) или более сигналов.
При использовании комбинированного ДНК-зонда к хромосомам X/Y центромерные участки половых хромосом помечены флуорохромами генерирующими сигнал разного цвета. Клетки с женским кариотипом в этом случае характеризуются двумя одноцветными сигналами, в клетках с мужским кариотипом наблюдается два сигнала разного цвета.
ДНК-зонды к теломерным участкам хромосом предназначены для выявления делеций и перестроек, затрагивающих концевые участки плечей хромосом. Теломерные ДНК-зонды специфичны для p или q плечей хромосом и комплементарны участку длиной около 300 kb от конца хромосомы. Как правило, зонды к теломерным участкам p и q плечей связаны с разными флуорохромами. Это обстоятельство позволяет проводить детекцию двух различных концевых хромосомных участков на одном цитогенетическом препарате. При проведении анализа концевых делеций с помощью подобных зондов в интерфазных ядрах возникает неопределенность. Отсутствие одного сигнала может свидетельствовать как о делеции концевого участка хромосомы, так и о потере хромосомы. В этом случае удобно одновременно использовать ДНК-зонд к центромерному участку той хромосомы, связанный с флуорохромом другого цвета. В интерфазном ядре, несущем делецию, будет наблюдаться два флуоресцентных сигнала от центромерных участков хромосомы и только один сигнал другого цвета – от теломерного участка.
Локус-специфичные ДНК-зонды составляют еще одну группу зондов. К этому виду относят все ДНК – зонды, которые гибридизуются с уникальными (неповторяющимися) последовательностями ДНК. Среди них заметное место занимают зонды, предназначенные для выявления диагностически и прогностически значимых в гематологии транслокаций, делеций, инверсий.
Проведенные исследования эффективности применения FISH-анализа при различных онкогематологических заболеваний в сравнении с результатами, полученными при кариотипировании, показали, что FISH-анализ позволяет выявлять исследуемые хромосомные абберации достоверно чаще. Во-первых, во всех без исключения случаях(100 %), когда они были обнаружены при стандартном кариотипировании. Во-вторых, в ряде случаев, когда был зарегистрирован нормальный кариотип либо другие хромосомные аномалии, а также в отсутствие делящихся клеток. Кроме того, FISH-анализ позволяет эффективно решить задачу выявления малых клеточных клонов с хромосомными аберрациями, не обнаруженных при стандартном исследовании. Для клинической практики это особенно актуально при детекции минимальной остаточной болезни, выявлении ранних рецидивов, исследовании опухолей с низким митотическим индексом.
Фиш анализ при раке молочной железы
13 марта 2020 г. 9:07
Пациенты с раком имеют подавленную иммунную систему и более восприимчивы к инфекциям.
12 марта 2020 г. 8:26
Исследователи представили структуру и механизм белков, которые экспрессируются при различных формах рака и связаны с плохим прогнозом пациента.
9 марта 2020 г. 12:07
В низких дозах тетродотоксин заменяет опиоиды для облегчения боли, связанной с раком.
5 марта 2020 г. 14:24
Новый метод картирования сил, которые кластеры клеток оказывают на микроокружение, может помочь в изучении развития тканей и метастазирования рака.
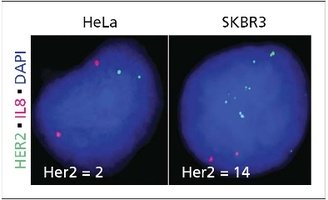
Современный лабораторный комплекс клиники Ассута проводит ФИШ (FISH) анализ для оценки раковых патологий груди:
Позвоните, чтобы узнать, как оформиться на лечение. Восстановите здоровье в крупнейшем госпитале на территории Ближнего Востока.
Фиш тест при раке молочной железы – механизм развития онкологии
Рецепторы гена HER2 отвечают за выработку HER2 белков, которые являются рецепторами, присутствующими в злокачественных клетках. При активизации рецепторов в раковые клетки поступает сигнал о необходимости деления и размножения. В норме HER 2 рецепторы регулируют рост клеток молочной железы, поддерживая баланс здоровья в тканях.
Однако доказано, что ген HER 2 избыточно вырабатывается в одном из пяти случаев онкологии. Это означает, что вместо одной копии гена у человека присутствует ген от каждого родителя. Это объясняет избыток HER рецепторов в организме, вызывая бесконтрольный и агрессивный рост опухоли.
Пройти фиш анализ при раке молочной железы необходимо для того, чтобы узнать, насколько причина развития патологии в организме связана с аномальным продуцированием рецепторов. Вы должны знать, является ли тип рака HER2 положительным или отрицательным. Существуют методы лечения, специально разработанные для рецепторов HER 2 положительного рака груди. Анализ позволяет не терять время на поиск результативных методов воздействия.
Когда проводится fish реакция при раке молочной железы, врач использует профильные окрашивающие вещества для визуализации хромосомных нарушений. Нанесенный на изучаемые ткани раствор дает возможность увидеть аномалии. Преимуществом ФИШ анализа является то, что с его помощью можно обнаружить генетические отклонения, которые слишком малы для изучения под микроскопом альтернативными методами.
Виды анализов
Для выяснения положительной или отрицательной природы HER2 врачи клиники Ассута направляют пациента на тестирование в собственную лабораторию. Различают два типа тестов:
Очень редко fish анализ бывает неопределенным или двусмысленным. При таком стечении обстоятельств требуется еще одна биопсия и новая фиш реакция при раке молочной железы для подтверждения диагноза.
Как проходит фиш тест при раке молочной железы – руководство для пациента
Для грамотной диагностики статуса HER 2 врач проводит биопсию, в процессе которой изымает образцы измененных патологией тканей. В большинстве случаев используется местная анестезия, чтобы нейтрализовать дискомфорт. В дальнейшем извлеченная ткань направляется на исследование в лабораторию, где с ней работает патолог. Очень важно, чтобы лаборатория являлась авторитетной в медицинской среде, потому что от правильности постановки диагноза напрямую зависит жизнь пациента. Доказано, что fish тест при раке молочной железы – безопасная процедура. Он не требует много времени, отдельных процедур кроме биопсии и дополнительной травматизации тканей.
Почему изначально проводится IHC тестирование? Это проще и доступнее. Однако, если анализы неубедительны, тестирование ФИШ обязательно к проведению. В редких случаях возможна повторная биопсия с забором проб. Но это, действительно, происходит крайне редко. Если анализ fish при раке молочной железы показал положительный HER2 результат, вам будет назначено эффективное лечение HER2 положительного рака. Несмотря на то, что это агрессивная форма патологии, перспективы для людей с таким диагнозом в последние годы значительно улучшились. Это связано с новыми и эффективными методами лечения рака груди в Израиле, нацеленными на HER 2 рецепторы.
FISH анализ трисомии 12 хромосомы (+12) (кровь) в Москве
Молекулярно-цитогенетическое исследование для дифференциальной диагностики трисомии хромосомы 12. Исследование проводится для постановки или опровержения диагноза и подбора терапии.
Приём и исследование биоматериала
Когда нужно сдавать анализ FISH анализ трисомии 12 хромосомы (+12) (кровь)?
Диагностика и оценка прогноза течения B-клеточного хронического лимфоцитарного лейкоза.
Подробное описание исследования
Основное заболевание, для которого характерно выявление трисомии по хромосоме 12, — В-клеточный хронический лимфоцитарный лейкоз (B-ХЛЛ, лимфолейкоз), или лимфома из малых лимфоцитов (ЛМЛ). B-ХЛЛ и ЛМЛ — это форма опухоли, где наблюдается лимфоцитоз (повышенное количество лимфоцитов). Хронический лимфолейкоз сопровождается образованием атипичных (опухолевых) B-лимфоцитов, которые накапливаются в селезенке, печени, костном мозге и лимфоузлах. В-ХЛЛ и ЛМЛ являются заболеваниями второй половины жизни — болезнь встречается чаще в пожилом возрасте (старше 65 лет), реже у детей.
Изучение трисомии 12 хромосомы (+12) для больных с хроническим лимфолейкозом имеет прогностическое значение. Как правило, аномалия выявляется у 10-20% пациентов. Если «+12» определяется как единственная аномалия, это свидетельствует об относительно благоприятном прогнозе. По разным источникам, мутацию также определяют как промежуточный, или нейтральный, прогностический фактор.
У более 10% больных с B-ХЛЛ трисомия по 12 хромосоме, наряду с трисомиями 13 и 16 хромосом, ассоциирована с развитием опасного осложнения лимфолейкоза — синдромом Рихтера. Синдром Рихтера — это агрессивная трансформация хронического лимфоцитарного лейкоза в диффузную B-крупноклеточную лимфому. Больные отмечают резкое похудение, лихорадку, обильное ночное потоотделение и быстрый рост лимфоузлов по всему телу.
Диагностики трисомии хромосомы 12 является флуоресцентная гибридизация in situ — FISH (фиш) анализ. Данный метод позволяет определить хромосомные мутации в ядрах клеток, которые в данный момент не делятся. К преимуществам FISH-метода можно отнести высокую чувствительность и специфичность, а также его способность анализировать более 500 клеток одновременно.
FISH анализ перестроек PDGFRb (кровь) в Москве
Лабораторный анализ для установления клинической формы и определения прогноза миелопролиферативных заболеваний.
Приём и исследование биоматериала
Когда нужно сдавать анализ FISH анализ перестроек PDGFRb (кровь)?
Оценка клинической формы и прогноза миелопролиферативных заболеваний.
Подробное описание исследования
Хромосома — это внутриядерный элемент клетки, в котором наследственная информация хранится в форме гена. Она состоит из множества генов — участков молекул ДНК. Также хромосома имеет в своем составе длинное «q» и короткое «p» плечо, которые соединены перетяжкой — центромерой. Всего в каждой клетке, кроме сперматозоидов и яйцеклеток, представлено 23 пары или 46 хромосом. Если нарушается их количество или структура, развиваются хромосомные заболевания. Данное исследование определяет нарушение структур хромосом, связанных с мутациями гена PDGFRb.
Ген PDGFRb расположен на 5q32 — 32 сегменте длинного плеча 5 хромосомы. Он кодирует (образует) белок PDGFR-β — рецептор фактора роста тромбоцитов B. Белок PDGFRb связывается с тромбоцитарными факторами роста, которые регулируют рост и созревание клеток крови, а также заживление ран. Особенно их функция важна в развитии кроветворных тканей.
Нарушение структуры — перестройка, мутация — гена PDGFRb приводит к развитию онкологических заболеваний кроветворной и других тканей. Наиболее частые виды перестройки:
5q-синдром — это процесс утраты (делеции) части генетического материала 5 хромосомы, в результате чего PDGFRb и два других гена — CSF2, CSF1R — отрываются от хромосомы. Это способствует развитию миелодиспластического синдрома — опухоли кроветворной ткани — с тяжелой анемией.
Транслокация — это патологический обмен участков между двумя непарными хромосомами. Чаще всего длинное плечо 5 хромосомы обменивается участком, содержащим ген PDGFRb, с коротким плечом 13 хромосомы, содержащим ген ETV6. В результате этого обмена происходит слияние двух генов: образуется новый не существующий в норме — химерный — ген PDGFRb-ETV6. Клетка с подобным химерным геном мутирует и приобретает злокачественные свойства, она начинает бесконтрольно делиться и впоследствии превращается в опухоль. В основном такие мутации приводят к развитию миелопролиферативных заболеваний.
Миелопролиферативные заболевания (МПЗ) — это группа опухолевых гематологических патологий, которые берут свое начало из одной мутировавшей стволовой клетки в костном мозге. Известно, что патологический ген PDGFRb-ETV6 помимо роста опухолевых клеток участвует в избыточном образовании эозинофилов — это подвид лейкоцитов, которые в норме защищают организм от паразитов. В данном случае их повышение в крови (эозинофилия) никак не связано с паразитами, это последствия опухолевого роста. Пациентов с мутацией PDGFRb относят в отдельную форму МПЗ — миелопролиферативное новообразование с перестройками гена PDGFRb.
Помимо PDGFRb в диагностике опухолевых заболеваний миелоидной кроветворной ткани также определяют и другие генетические аномалии — PDGFRa и FGFR1. Мутации всех трех генов обычно сопровождаются эозинофилией, их оценивают для определения клинической формы миелопролиферативного новообразования и оценки прогноза. МПЗ с перестройками PDGFRb и PDGFRa относят к благоприятному прогнозу. Определение мутации FGFR1 чаще свидетельствует о неблагоприятном прогнозе. Благоприятный прогноз при перестройках PDGFRb и PDGFRa связан с их хорошей чувствительностью к химиопрепаратам — ингибиторам тирозинкиназы. Также их используют в качестве критериев ответа на химиотерапию.
Одним из основных методов диагностики перестроек PDGFRb является метод флуоресцентной гибридизации in situ, или FISH (фиш) анализ. Данный молекулярный цитогенетический метод позволяет определить хромосомные мутации в ядрах клеток, которые в данный момент не делятся. К преимуществам FISH-метода можно отнести высокую чувствительность и специфичность, а также возможность анализировать более 500 клеток одновременно.
Fish исследование что это
Научный руководитель проекта ГЕНОМЕД
Геномед – это инновационная компания с командой врачей-генетиков и неврологов, акушеров гинекологов и онкологов, биоинформатиков и лабораторных специалистов, представляющая комплексную и высокоточную диагностику наследственных заболеваний, нарушений репродуктивной функции, подбор индивидуальной терапии в онкологии.
В сотрудничестве с мировыми лидерами в области молекулярной диагностики мы предлагаем более 200 молекулярно-генетических исследований, основаных на самых современных технологиях.
Использование секвенирования нового поколения, микроматричного анализа с мощными методами биоинформационного анализа позволяют быстро поставить диагноз и подобрать правильное лечение даже в самых сложных случаях.
Наша миссия заключается в предоставлении врачам и пациентам комплексных и экономически эффективных генетических исследований, информационную и консультационную поддержку 24 часа в сутки.
ГЛАВНЫЕ ФАКТЫ О НАС
Руководители направлений
Жусина
Юлия Геннадьевна
Окончила педиатрический факультет Воронежского государственного медицинского университета им. Н.Н. Бурденко в 2014 году.
2015-2016 – врач терапевт ВГКБСМП №1.
С 2017 года ординатура по специальности «Генетика» на базе РМАНПО.
Канивец
Илья Вячеславович
Канивец Илья Вячеславович, врач-генетик, кандидат медицинских наук, руководитель отдела генетики медико-генетического центра Геномед. Ассистент кафедры медицинской генетики Российской медицинской академии непрерывного профессионального образования.
Окончил лечебный факультет Московского государственного медико-стоматологического университета в 2009 году, а в 2011 – ординатуру по специальности «Генетика» на кафедре Медицинской генетики того же университета. В 2017 году защитил диссертацию на соискание ученой степени кандидата медицинских наук на тему: Молекулярная диагностика вариаций числа копий участков ДНК (CNVs) у детей с врожденными пороками развития, аномалиями фенотипа и/или умственной отсталостью при использовании SNP олигонуклеотидных микроматриц высокой плотности»
C 2011-2017 работал врачом-генетиком в Детской клинической больнице им. Н.Ф. Филатова, научно-консультативном отделе ФГБНУ «Медико-генетический научный центр». С 2014 года по настоящее время руководит отделом генетики МГЦ Геномед.
Основные направления деятельности: диагностика и ведение пациентов с наследственными заболеваниями и врожденными пороками развития, эпилепсией, медико-генетическое консультирование семей, в которых родился ребенок с наследственной патологией или пороками развития, пренатальная диагностика. В процессе консультации проводится анализ клинических данных и генеалогии для определения клинической гипотезы и необходимого объема генетического тестирования. По результатам обследования проводится интерпретация данных и разъяснение полученной информации консультирующимся.
Является одним из основателей проекта «Школа Генетики». Регулярно выступает с докладами на конференциях. Читает лекции для врачей генетиков, неврологов и акушеров-гинекологов, а также для родителей пациентов с наследственными заболеваниями. Является автором и соавтором более 20 статей и обзоров в российских и зарубежных журналах.
Область профессиональных интересов – внедрение современных полногеномных исследований в клиническую практику, интерпретация их результатов.
Время приема: СР, ПТ 16-19
Прием врачей осуществляется по предварительной записи.
Шарков
Артем Алексеевич
Шарков Артём Алексеевич – врач-невролог, эпилептолог
В 2012 году обучался по международной программе “Oriental medicine” в университете Daegu Haanu в Южной Корее.
В 2013 году окончил Педиатрический факультет Российского национального исследовательского медицинского университета имени Н.И. Пирогова.
C 2013 по 2015 год обучался в клинической ординатуре по неврологии в ФГБНУ «Научный центр неврологии».
С 2015 года работает неврологом, научным сотрудником в Научно- исследовательском клиническом институте педиатрии имени академика Ю.Е. Вельтищева ГБОУ ВПО РНИМУ им. Н.И. Пирогова. Также работает врачом- неврологом и врачом лаборатории видео-ЭЭГ мониторинга в клиниках «Центр эпилептологии и неврологии им. А.А.Казаряна» и «Эпилепси-центр».
В 2015 году прошел обучение в Италии на школе «2nd International Residential Course on Drug Resistant Epilepsies, ILAE, 2015».
В 2016 году прошел обучение в Италии на школе «San Servolo international advanced course: Brain Exploration and Epilepsy Surger, ILAE, 2016».
В 2017 году – школа «NGS в медицинской генетике 2017», МГНЦ
В настоящее время проводит научные исследования в области генетики эпилепсии под руководством профессора, д.м.н. Белоусовой Е.Д. и профессора, д.м.н. Дадали Е.Л.
Утверждена тема диссертации на соискание ученой степени кандидата медицинских наук «Клинико-генетические характеристики моногенных вариантов ранних эпилептических энцефалопатий».
Основные направления деятельности – диагностика и лечение эпилепсии у детей и взрослых. Узкая специализация – хирургическое лечение эпилепсии, генетика эпилепсий. Нейрогенетика.
Киевская
Юлия Кирилловна
В 2011 году Окончила Московский Государственный Медико-Стоматологический Университет им. А.И. Евдокимова по специальности «Лечебное дело» Обучалась в ординатуре на кафедре Медицинской генетики того же университета по специальности «Генетика»
В 2015 году окончила интернатуру по специальности Акушерство и Гинекология в Медицинском институте усовершенствования врачей ФГБОУ ВПО «МГУПП»
С 2013 года ведет консультативный прием в ГБУЗ «Центр Планирования Семьи и Репродукции» ДЗМ
С 2017 года является руководителем направления «Пренатальная Диагностика» лаборатории Геномед
Регулярно выступает с докладами на конференциях и семинарах. Читает лекции для врачей различных специальной в области репродуции и пренатальной диагностики
Проводит медико-генетическое консультирование беременных по вопросам пренатальной диагностики с целью предупреждения рождения детей с врождёнными пороками развития, а так же семей с предположительно наследственной или врожденной патологией. Проводит интерпретацию полученных результатов ДНК-диагностики.
СПЕЦИАЛИСТЫ
Латыпов
Артур Шамилевич
Латыпов Артур Шамилевич – врач генетик высшей квалификационной категории.
После окончания в 1976 году лечебного факультета Казанского государственного медицинского института в течение многих работал сначала врачом кабинета медицинской генетики, затем заведующим медико-генетическим центром Республиканской больницы Татарстана, главным специалистом министерства здравоохранения Республики Татарстан, преподавателем кафедр Казанского медуниверситета.
Автор более 20 научных работ по проблемам репродукционной и биохимической генетики, участник многих отечественных и международных съездов и конференций по проблемам медицинской генетики. Внедрил в практическую работу центра методы массового скрининга беременных и новорожденных на наследственные заболевания, провел тысячи инвазивных процедур при подозрении на наследственные заболевания плода на разных сроках беременности.
С 2012 года работает на кафедре медицинской генетики с курсом пренатальной диагностики Российской академии последипломного образования.
Область научных интересов – метаболические болезни у детей, дородовая диагностика.
Время приема: СР 12-15, СБ 10-14
Прием врачей осуществляется по предварительной записи.
Габелко
Денис Игоревич
В 2009 году закончил лечебный факультет КГМУ им. С. В. Курашова (специальность «Лечебное дело»).
Интернатура в Санкт-Петербургской медицинской академии последипломного образования Федерального агентства по здравоохранению и социальному развитию (специальность «Генетика»).
Интернатура по терапии. Первичная переподготовка по специальности «Ультразвуковая диагностика». С 2016 года является сотрудником кафедры кафедры фундаментальных основ клинической медицины института фундаментальной медицины и биологии.
Сфера профессиональных интересов: пренатальная диагностика, применение современных скрининговых и диагностических методов для выявления генетической патологии плода. Определение риска повторного возникновения наследственных болезней в семье.
Участник научно-практических конференций по генетике и акушерству и гинекологии.
Консультация по предварительной записи
Прием врачей осуществляется по предварительной записи.
Гришина
Кристина Александровна
Окончила в 2015 году Московский Государственный Медико-Стоматологический Университет по специальности «Лечебное дело». В том же году поступила в ординатуру по специальности 30.08.30 «Генетика» в ФГБНУ «Медико-генетический научный центр».
Принята на работу в лабораторию молекулярной генетики сложно наследуемых заболеваний (заведующий – д.б.н. Карпухин А.В.) в марте 2015 года на должность лаборанта-исследователя. С сентября 2015 года переведена на должность научного сотрудника. Является автором и соавтором более 10 статей и тезисов по клинической генетике, онкогенетике и молекулярной онкологии в российских и зарубежных журналах. Постоянный участник конференций по медицинской генетике.
Область научно-практических интересов: медико-генетическое консультирование больных с наследственной синдромальной и мультифакториальной патологией.
Консультация врача-генетика позволяет ответить на вопросы:
являются ли симптомы у ребенка признаками наследственного заболевания какое исследование необходимо для выявления причины определение точного прогноза рекомендации по проведению и оценка результатов пренатальной диагностики все, что нужно знать при планировании семьи консультация при планировании ЭКО выездные и онлайн консультации
Горгишели
Кетеван Важаевна
Является выпускницей медико-биологического факультета Российского Национального Исследовательского Медицинского Университета имени Н.И. Пирогова 2015 года, защитила дипломную работу на тему «Клинико-морфологическая корреляция витальных показателей состояния организма и морфофункциональных характеристик мононуклеаров крови при тяжелых отравлениях». Окончила клиническую ординатуру по специальности «Генетика» на кафедре молекулярной и клеточной генетики вышеупомянутого университета.
ринимала участие в научно-практической школе «Инновационные генетические технологии для врачей: применение в клинической практике», конференции Европейского общества генетики человека (ESHG) и других конференциях, посвященных генетике человека.
Проводит медико-генетическое консультирование семей с предположительно наследственной или врожденной патологией, включая моногенные заболевания и хромосомные аномалии, определяет показания к проведению лабораторных генетических исследований, проводит интерпретацию полученных результатов ДНК-диагностики. Консультирует беременных по вопросам пренатальной диагностики с целью предупреждения рождения детей с врождёнными пороками развития.
Кудрявцева
Елена Владимировна
Врач-генетик, врач акушер-гинеколог, кандидат медицинских наук.
Специалист в области репродуктивного консультирования и наследственной патологии.
Окончила Уральскую государственную медицинскую академию в 2005 году.
Ординатура по специальности «Акушерство и гинекология»
Интернатура по специальности «Генетика»
Профессиональная переподготовка по специальности «Ультразвуковая диагностика»
Помимо консультирования пациентов, занимается научной и преподавательской деятельностью – работает в должности доцента на кафедре акушерства и гинекологии факультета повышения квалификации УГМУ.
Регулярно участвует в научных конференциях и симпозиумах.
Является автором ряда статей и методических рекомендаций.
Работает в МЦ «Геномед» с 2015 года
Общий стаж работы – 11 лет
Удалова
Василиса Юрьевна
Является выпускницей Нижегородской государственной медицинской академии, лечебного факультета (специальность «Лечебное дело»). Окончила клиническую ординатуру ФБГНУ «МГНЦ» по специальности «Генетика». В 2014 году проходила стажировку в клинике материнства и детства (IRCCS materno infantile Burlo Garofolo, Trieste, Italy).
С 2016 года работает на должности врача-консультанта в ООО «Геномед».
Регулярно участвует в научно-практических конференциях по генетике.
Основные направления деятельности: Консультирование по вопросам клинической и лабораторной диагностики генетических заболеваний и интерпретация результатов. Ведение пациентов и их семей с предположительно наследственной патологией. Консультирование при планировании беременности, а также при наступившей беременности по вопросам пренатальной диагностики с целью предупреждения рождения детей с врожденной патологией.













