За счет чего альфа спирали могут обвиваться друг вокруг друга
Альфа-спираль-между NH группой 1 аминокислоты и СО другой
3) Нерегулярная структура (синонимы: беспорядочный клубок, аморфные области) – тип вторичной структуры, в котором расположение различных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь различную конформацию.
Выделяют два общих типа третичной структуры:
1) В фибриллярных белках (например, коллаген, эластин) молекулы которых имеют вытянутую форму и обычно формируют волокнистые структуры тканей, третичная структура представлена либотройной альфа-спиралью (например, в коллагене), либо бета-складчатыми структурами.
Связи, стабилизирующие третичную структуру (рис.1):
1. электростатические силы притяжения между R-группами, несущими противоположно заряженные ионогенные группы (ионные связи);
2. водородные связи между полярными (гидрофильными)R-группами;
3. гидрофобные взаимодействия между неполярными (гидрофобными) R-группами.Гидрофобное ядро существует у большинства белков.
4. дисульфидные связи между радикалами двух молекул цистеина. Эти связи ковалентные. Они повышают стабильность третичной структуры, но не всегда являются обязательными для правильного скручивания молекулы. В ряде белков они могут вообще отсутствовать.
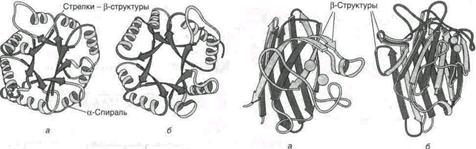
Примеры фибриллярных белков (рис.2).
Структурным белком, построенным преимущественно в виде α-спирали, является α-кератин. Волосы (шерсть), перья, иглы, когти и копыта животных состоят главным образом из кератина. Кератин (цитокератин) является важнейшей составной частью цитоскелета. В кератинах большая часть пептидной цепи свернута в правую α-спираль. Две пептидные цепи образуют единую левую суперспираль (или димер). Димеры кератина объединяются в тетрамеры, которые агрегируют с образованием протофибриллдиаметром 3 нм. Наконец, восемь протофибрилл образуют микрофибриллыдиаметром 10 нм.
Волосы построены из таких же фибрилл. Так, в отдельном волокне шерсти диаметром 20 мкм переплетены миллионы фибрилл. Отдельные цепи кератина скреплены поперечно многочисленными дисульфидными связями, что придает им дополнительную прочность.
Дата добавления: 2015-09-14 ; просмотров: 4589 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Структура альфа-спирали и функциональное значение
альфа спираль является самой простой вторичной структурой, которую белок может принять в пространстве в соответствии с жесткостью и свободой вращения связей между его аминокислотными остатками.
Он характеризуется спиральной формой, в которой расположены аминокислоты, которые, по-видимому, располагаются вокруг воображаемой продольной оси с группами R снаружи этого.
Альфа-спирали были впервые описаны в 1951 году Полингом и его коллегами, которые использовали имеющиеся данные о межатомных расстояниях, углах связи и других структурных параметрах пептидов и аминокислот, чтобы предсказать наиболее вероятные конфигурации, которые могут принять цепи. полипептид.
Описание альфа-спирали возникло в результате поиска всех возможных структур в пептидной цепи, которые были стабилизированы водородными связями, где остатки были стехиометрически эквивалентными, а конфигурация каждого была плоской, как показывают данные из резонанс пептидных связей, которые были доступны на сегодняшний день.
Эта вторичная структура является наиболее распространенной среди белков, и ее принимают как растворимые, так и интегральные мембранные белки. Считается, что более 60% белков существуют в форме альфа-спирали или бета-листа.
структура
Как правило, каждый виток альфа-спирали имеет в среднем 3,6 аминокислотных остатка, что примерно эквивалентно 5,4 Å в длину. Однако углы и длины вращения варьируются от одного белка к другому со строгой зависимостью от аминокислотной последовательности первичной структуры.
Большинство альфа-спиралей имеют правосторонний поворот, но в настоящее время известно, что белки с альфа-спиралями могут существовать с левосторонним поворотом. Условие для того или иного условия состоит в том, что все аминокислоты находятся в одной и той же конфигурации (L или D), поскольку они отвечают за направление поворота..
Стабилизация этих важных структурных причин для мира белка дается водородными связями. Эти связи возникают между атомом водорода, присоединенным к электроотрицательному азоту пептидной связи, и электроотрицательным атомом карбонового кислорода аминокислоты четырьмя положениями позже, в N-концевой области по отношению к себе.
Каждый виток спирали, в свою очередь, связан с последующим водородными связями, которые имеют основополагающее значение для достижения общей стабильности молекулы.
Не все пептиды могут образовывать стабильные альфа-спирали. Это определяется внутренней способностью каждой аминокислоты в цепи образовывать спирали, что напрямую связано с химической и физической природой ее заместителей R групп..
Например, при определенном значении рН многие полярные остатки могут приобретать один и тот же заряд, поэтому они не могут быть расположены последовательно в спирали, поскольку отталкивание между ними может привести к значительным искажениям в нем..
Размер, форма и положение аминокислот также являются важными детерминантами спиральной стабильности. Если не идти дальше, такие остатки, как Asn, Ser, Thr и Cys, расположенные в непосредственной близости в последовательности, также могут оказывать негативное влияние на конфигурацию альфа-спирали.
Таким же образом, гидрофобность и гидрофильность альфа-спиральных сегментов в данном пептиде зависят исключительно от идентичности групп R аминокислот.
В составных мембранных белках имеются обильные альфа-спирали с остатками сильного гидрофобного характера, которые строго необходимы для вставки и конфигурации сегментов между аполярными хвостами составляющих фосфолипидов..
Растворимые белки, напротив, имеют альфа-спирали, богатые полярными остатками, которые делают возможным лучшее взаимодействие с водной средой, присутствующей в цитоплазме или интерстициальных пространствах.
Функциональное значение
Мотивы альфа-спирали имеют широкий спектр биологических функций. Конкретные паттерны взаимодействия между спиралями играют критическую роль в функции, сборке и олигомеризации как мембранных белков, так и растворимых белков..
Эти домены присутствуют во многих транскрипционных факторах, важных с точки зрения регуляции экспрессии генов. Они также присутствуют в белках, имеющих структурную значимость, и в мембранных белках, которые выполняют функции транспорта и / или передачи сигналов различного типа..
Вот несколько классических примеров белков с альфа-спиралями:
миозин
коллаген
Одна треть общего содержания белка в организме человека представлена коллагеном. Он является наиболее распространенным белком во внеклеточном пространстве и имеет в качестве отличительной характеристики структурный мотив, состоящий из трех параллельных нитей со спиральной левой конфигурацией, которые соединяются вместе, образуя тройную спираль с направлением по часовой стрелке.
кератин
Кератины представляют собой группу нитевидных белков, которые вырабатываются некоторыми эпителиальными клетками у позвоночных. Они являются основным компонентом ногтей, волос, когтей, панциря черепах, рогов и перьев. Часть его фибриллярной структуры образована альфа-спиральными сегментами.
гемоглобин
Кислород в крови транспортируется гемоглобином. Глобиновая часть этого тетрамерного белка состоит из двух идентичных альфа-спиралей по 141 остаток в каждой и двух бета-цепочек по 146 остатков в каждой..
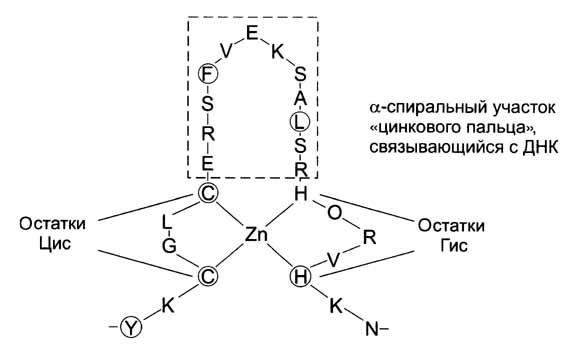
Белки типа «цинковый палец»
Эукариотические организмы обладают множеством белков цинкового пальца, которые работают для разных целей: распознавания ДНК, упаковки РНК, активации транскрипции, регуляции апоптоза, сворачивания белка и т. Д. Многие белки цинковых пальцев обладают альфа-спиралями как основным компонентом их структуры, и они необходимы для их функционирования.
Уровни структурной организации белковых молекул



Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, соединенных прочными пептидными связями. За счет внутримолекулярных взаимодействий белки образуют определенную пространственную структуру, называемую «конформация “белков.
Структура белковых молекул отличается значительной сложностью и своеобразной организацией. Различают 4 уровня структурной организации белка: первичную, вторичную, третичную и четвертичную.
Первичная структура – это последовательность аминокислот в полипептидной цепи, соединенных пептидными связями. К настоящему времени полностью расшифрована первичная структура многих белков: инсулина, гемоглобина, миоглобина, трипсиногена, лизоцима и др. Установлены не только межвидовые, но и выявляются индивидуальные особенности первичной структуры отдельных белков.
Последовательность аминокислот в полипептидной цепи определяет последующие уровни структурной организации белка, его важнейшие физико-химические, биологические свойства и является уникальной в каждом отдельном случае (закрепленной генетически).
Вторичная структура – это конфигурация полипептидной цепи в пространстве, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова.
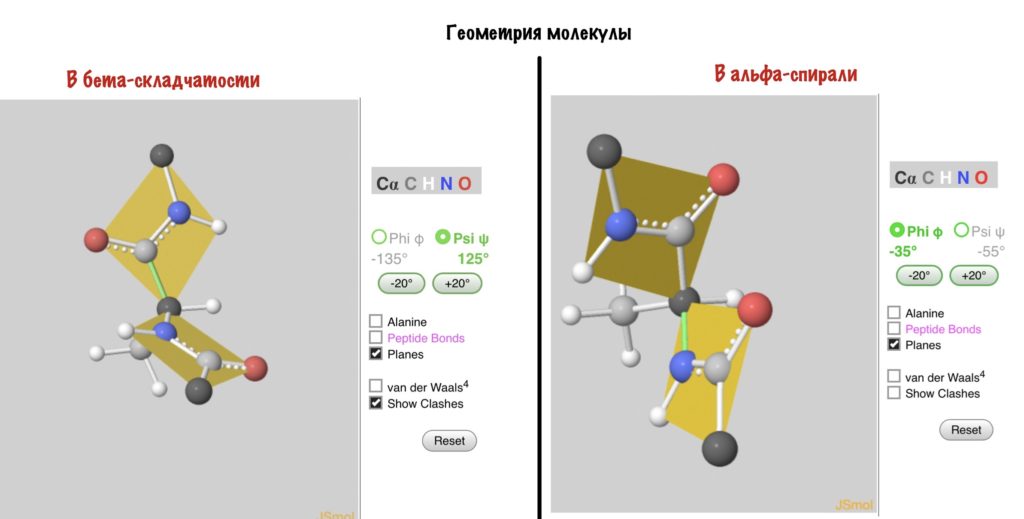
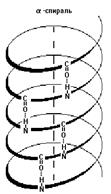
Вторичная структура белков (a-спираль). Полипептидная цепь образует спираль вращением вокруг воображаемого цилиндра.
Вид с торца a-спирали – проекции боковых групп ориентированы произвольно.
Водородные связи как бы сшивают спираль, удерживая полипептидную цепь в закрученном состоянии. Некоторые аминокислоты в силу строения их боковых групп препятствуют спирализации цепи. Например, пролин или оксипролин не содержат атома водорода в пептидной группе и, следовательно, не могут образовывать водородные связи. Поэтому участки полипептидной цепи, где есть пролин или оксипролин не способны к спирализации и полипептидная цепь делает изгиб “шпильку”.
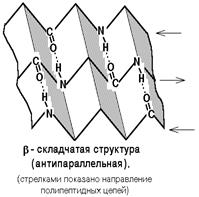
Структура складчатого листа
бета – структура формируется между линейными участками одной полипептидной цепи, образуя при этом складки или между разными полипептидными цепями. Полипептидые цепи или их части могут формировать параллельные и антипараллельные альфа-структуры.
Структура складчатого листа характерна для фибриллярных белков (нитевидных).
Во многих белках одновременно имеются a-спиральные участки, b-структуры и соединительные петли. Природных белков, состоящих на 100% из a-спирали практически нет. Белки имеют неодинаковую степень спирализации. Высокая степень альфа-спирализации характерна для белков миоглобина, гемоглобина.
Определенные сочетания альфа-спиралей и бета-структур в некоторых белках называют супервторичной структурой белков. Они имеют специфические названия: структура «бета-бочонка», «цинковый палец» и др.
Фрагмент ДНК-связывающего белка в форме «цинкового пальца»
а) Дисульфидные связи возникают между молекулами цистеина, расположенными на различных участках полипептидной цепи (идет окислительно-восстановительный процесс).
б) Ионные взаимодействия возможны между различными участками полипептидной цепи, имеющими разноименно заряженные группы. Этот вид взаимодействия возможен между моноаминодикарбоновыми кислотами (асп, глу), боковые цепи которых имеют отрицательный заряд и диаминомонокарбоновыми аминокислотами (лизин, аргинин), боковые цепи которых имеют положительный заряд.
в) Гидрофобные взаимодействия
Полипептидная цепь укладывается таким образом, что гидрофильные боковые группы (R- группы) аминокислот обращены наружу, а гидрофобные располагаются внутри. Гидрофобные группировки, испытывая отвращение к воде, стремясь избежать соприкосновения с ней, теснее сближаются друг с другом и взаимодействуют между собой.
Примером фибриллярных белков являются белки соединительных тканей коллаген, эластин. Типичными глобулярными белками являются гемоглобин, миоглобин. Некоторые белки могут существовать как в глобулярной, так и в фибриллярной форме. Например, сократительный белок мышц актин.
Типы связей, участвующих в стабилизации третичной структуры.
Строение и функции белков. Денатурация белка
Перед тем, как начать разбираться со строением белка и его функциями нужно кое-что прояснить. А что вообще такое белок? Как организм создает такое многообразие белков, если имеет ограниченный запас аминокислот?
Белок — это полимерная молекула, которая состоит из молекул поменьше — мономеров. Мономеры для белка — аминокислоты, которые соединяются между собой пептидными связями. Но здесь появляется вопрос, а сколько аминокислот нужно соединить между собой для того, чтобы получить белок? Больше 50. Если их будет меньше, то такая молекула называется пептид.
Все аминокислоты соединяются друг с другом в определенной последовательности, которая уникальна для каждого белка. Кто это контролирует? ДНК — ведь она и кодирует все эти аминокислоты. Ну а теперь можем начинать разбираться со структурой.
Первичная структура белка
Представляем себе огромную цепь, которая состоит из кучи звеньев. Такой же вид у первичной структуры белка — это просто полипептидная цепь, которая включает в себя аминокислоты. Их всего 20 штук. Но представьте себе сколько комбинаций можно сделать с этими 20 аминокислотами, соединяя их в разных последовательностях? Правильно, бесконечное множество.
Теперь посмотрим на молекулу поближе. Можно увидеть, что у этой большой молекулы есть свободная аминогруппа — N-конец, и свободная карбоксильная группа — C-конец. Молекулу всегда рисуют с N-конца и заканчивают C-концом.
Все остальные аминокислоты связаны друг с другом пептидной связью. Сумма всех пептидных связей — это пептидный остов. В него не входят радикалы, N-концы и C-концы. Будет понятнее, если я нарисую всё в одну линию.
В первичной структуре есть только пептидные связи
Важный момент! Первичная структура определяет какими будет вторичная, третичная и четвертичная (если такая есть) структуры. Это как мини-ДНК для белковой молекулы. Но я об этом еще напомню, даже несколько раз, вот такая я зануда.
Вторичная структура белка
Ну что, а теперь давайте усложнять все! Что можно сделать с цепью, которую мы рассмотрели до этого? Может закрутим цепь вокруг чего-то? Или просто растянем ее вдаль? Можно даже растянуть цепь и повернуть ее обратно, чтобы начало и конец были в одном месте. Что вам больше нравится?
Какой бы вариант не выбрали — он верный, но все зависит от того, какой тип вторичной структуры будет у белка. Напоминаю, что это определяется первичной :]
1. Альфа-спираль
Это для ребят, которые выбрали закрутить цепь вокруг чего-то. Правда закручивается она вокруг самой себя. В этой цепи происходит образование водородной связи между кислородом (карбоксильного атома углерода) и водородом (связан с азотом).
Далековато как-то. Как так выходит? Все из-за того, что происходит закручивание пептидного остова. Сделаем такую же картинку как сверху, но в виде атомов. Не забудем крутануть её немного…
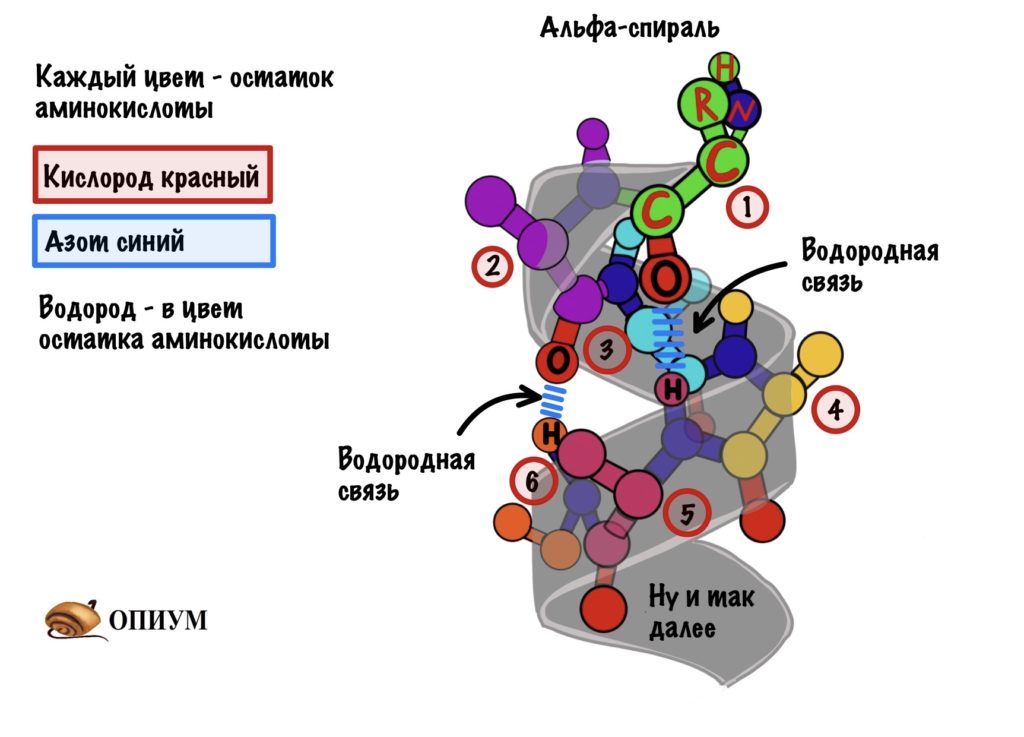
Каждый цвет — это остаток аминокислоты, только азоты и кислороды я оставил одного цвета, а то запутаемся ещё. Ещё альфа-углерод тут трех валентный и все атомы отмечать не стал, а то слишком громоздко получается. Думаю, что смысл понятен.
Какой сделаем вывод? Альфа-спираль похожа на корсет. Правда вместо него — водородные связи, которые стягивают её. Если присмотреться к радикалам, то они выглядывают как иголки из ёлки в разные стороны. Вот рисунок попроще.
Ой, а вы, наверное, ждали какой то супер крутой рисунок? А я тут такое подсунул, ладно держите вот немного получше. Правда он без радикалов и водородных связей. Но здесь лучше видно, что на один виток спирали приходится 3,6 аминокислотных остатка.
Альфа-спираль, конечно, очень красивый вариант, но он не всегда образуется. Есть аминокислоты, которые могут помешать этому:
Пролин. В его молекуле находится жесткое кольцо, которое всегда вызывает поворот. Такая уж у него структура. Если вставить его в альфа спираль, то произойдет поворот на 180 градусов. Ещё у пролина нет свободного водорода у азота. Получается, что он не может образовывать водородную связь, которая так важна для альфа-спирали.
Глицин. Если пролин слишком жесткий, то глицин, наоборот, очень гибкий. У него ведь нет радикала, поэтому если вставить слишком много глицинов, то прощай альфа-спираль. Иногда из-за него тоже происходит поворот молекулы на 180 градусов — прямо как на картинке выше.
Аминокислоты с большими радикалами. Большие радикалы круто, но если они будут расположены рядом, то это может помешать формированию альфа-спирали. Они просто мешают друг другу.
И последнее, одинаково заряженные аминокислоты. При одинаковом заряде они отталкиваются допустим: рядом расположены лизин и аргинин, или аспартат и глутамат. Ну и другие комбинации.
Если в полипептидной цепи много включений с такими радикалами, то чаще всего образуется…
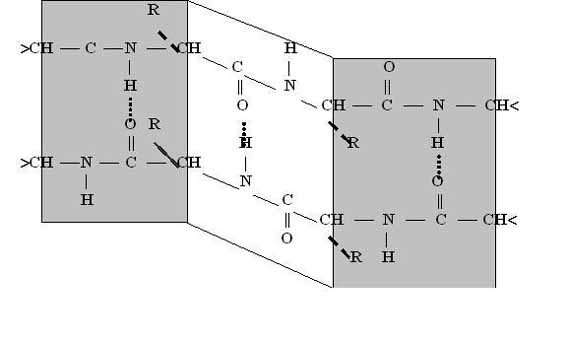
2. Бета-складчатый слой
Здесь молекула будет похожа на лист, который состоит из нескольких тяжей. А они похожи на горки из игры Gravity defied. Хотя кому я это говорю….
Ладно, давайте просто посмотрим на рисунок, а лучше на два — один сбоку, а другой сверху. Что видим? Один тяж с горками, которые идут то вверх, то вниз. Радикалы аминокислот расположены над или под плоскостью листа.
Теперь можно составить из тяжей бета-складчатый слой. Здесь, как всегда, несколько вариантов. Первый вариант — параллельный лист, тогда направление тяжей одинаковое. Если оно разное, то он антипараллельный. Стабилизируется этот лист тоже с помощью водородных связей, прямо как альфа-спираль. Только вот есть один нюанс. Если в альфа-спирали есть четкая зависимость образования связей — через 4 аминокислотных остатка, то здесь такого нет. Например, водородными связями могут соединяться 5 остаток и 22.
Когда мы разбирали альфа-спираль, то сказали что пролин и иногда глицин вызывают поворот на 180 градусов. У этого есть свое название: бета-поворот.
3. Беспорядочный клубок
Это последний вариант. Здесь нет никаких спиралей или бета-складчатости, просто получается вот такая белиберда.
Что общего у всех вторичных структур? В их образовании участвует только пептидный остов. Радикалы пока что отдыхают. Ну и второе:
Водородные связи стабилизируют вторичную структуру
Ой, а от чего зависит какую вторичную структуру примет молекула?
А действительно, почему какая-то молекула принимает форму альфа-спирали, а другая бета-складчатости? Хороший вопрос, и у меня есть ответ на него: от торсионных углов. Я разбирал это в прошлой статье — кликай сюда, а потом возвращайся. Так, мы говорили о том, что углы бывают разными, но для каждой вторичной структуры характерны строго определенные углы. Есть специальные карты Рамачандрана, на которых указаны эти углы — все данные получены экспериментально.
Здесь можно посмотреть как будут выглядеть молекулы аминокислот с такими углами. Но вот вам фоточка, если лень.
Надеюсь, что теперь понятно почему и как формируется вторичная структура. Ах да, конечно же, все эти углы определяются первичной структурой!
Супервторичная
структура белка
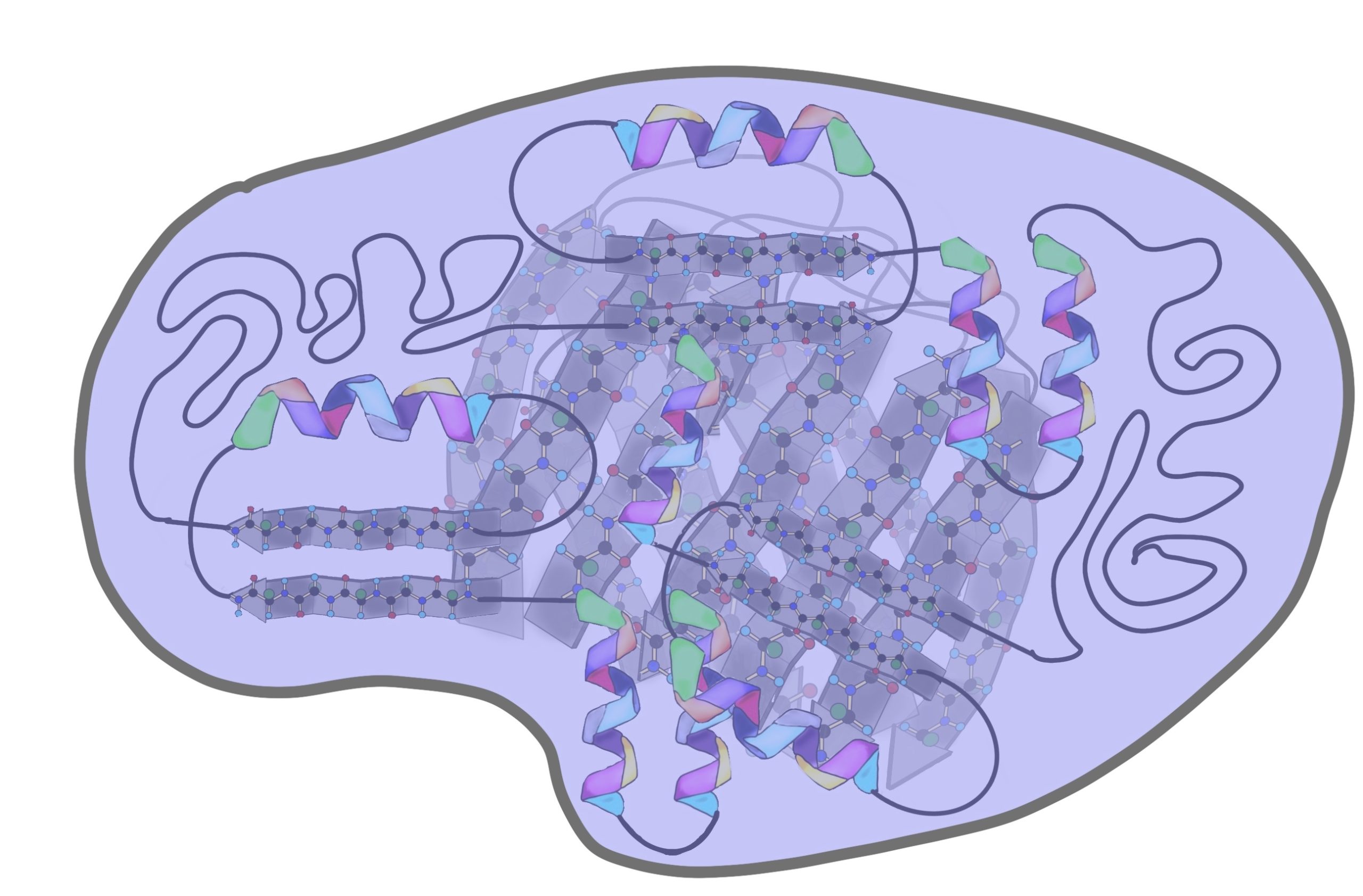
До этого мы разбирали вторичные структуры изолированно, но представьте себе очень длинную полипептидную цепь. Не может же она вся закручиваться в альфа-спираль или становиться бета-складчатой. Хотя иногда и может, но об этом позднее. Чаще всего белок — это комбинация из альфа-спиралей, бета-тяжей и беспорядочных клубков. То есть может это выглядеть примерно вот-так.
Поймите, что супервторичная структура белка не стоит выше, чем вторичная. Это просто название, которое неправильно отражает суть, поэтому оно мне не нравится. На западе используют другое название — структурные мотивы, оно намного лучше. Вот в чем его суть: хоть у нас огромное количество самых разных белков, но в них есть определенные повторяющиеся паттерны — это и есть мотивы. Наиболее частые из них: бета-тяж + альфа-спираль + бета-тяж (бета-альфа-бета петля); альфа-спираль + бета-поворот + альфа-спираль; бета-бочонок.
Мотивов очень много, но думаю смысл понятен. Простые мотивы могут объединяться и образовывать мотивы посложнее.
Я использовал в иллюстрациях прошлые картинки, но помните, что эти альфа-спирали и бета-тяжи отличаются друг от друга аминокислотными остатками — они очень разные! Просто перерисовывать все это не хочется.
Третичная структура белка
Вот этот уровень уже повыше, на нем белок начинает выполнять свою функцию — впахивать, как проклятый. Но сначала нужно остановиться ненадолго и поговорить. Спокойно, я же сказал — ненадолго.
Согласитесь, что у белков очень много функций. Какой-то переносит кислород, а другой входит в состав кости и обеспечивает ее прочность. Белки мышечной ткани вообще обеспечивают движение. Давайте попробуем выделить две глобальные, но не совсем верные, функции: структурная и связывания. Одни белки входят в структуру мышц, костей, волос и так далее. А другие что-то связывают: ферменты связываются с субстратом, а гемоглобин с кислородом. А где-то бравое антитело падает на амбразуру для того, чтобы не пропустить бактерию в организм. Это конечно все очень грубо, но пусть будет так.
И все это я к чему. Существует два больших класса белков: фибриллярные — коллаген, эластин, кератин. Эти ребята занимаются поддержкой, такие вот суппорты. Фибрилла — это нить. Так что они очень длинные, а когда огромное количество нитей связывается в одну, то они становятся очень прочными. Фибриллярные белки — это атланты, которые держат наш организм на своих плечах. А мы не особо благодарные ребята, потому что забьем на них. Но только в этой статье.
В основном биохимия занимается другим классом — глобулярными белками. Эти ребята не только связывают — у них огромное количество функций. С этими функциями и пытается разобраться биохимия. Глобула — шар. Вроде это все, теперь можем приступать.
На прошлом этапе мы собрали разные вторичные структуры в мотивы, ну а дальше то что? Теперь нам нужно скрутить все это в компактный шарик — глобулу. Здесь, наконец-то, пригодятся наши лентяи — радикалы. Вспоминаем, что радикалы бывают полярные и неполярные. Когда глобула скручивается, то она прячет гидрофобные остатки аминокислот внутрь этого шарика, а гидрофильные выставляет наружу. Оно и понятно, все-таки глобулы находятся в организме, а у нас почти везде вода.
Скручивание — удивительный процесс. Здесь начинают взаимодействовать очень (очень-очень!) отдаленные аминокислотные остатки. Представьте, что тридцатый остаток взаимодействует с триста семидесятым. При этом все настолько предопределено первичной структурой, что радикалы взаимодействуют максимально точно. А взаимодействий ведь не мало!
Кстати о них, какими они бывают:
Про все эти связи у меня есть статейка ;] Ещё раз сказу, что здесь взаимодействуют только радикалы.
Когда глобула сложилась в пространстве, то всю эту сложную структуру называют конформацией (получается, что конформация — это положение атомов друг относительно друга в пространстве). Есть еще кое-что интересное: посмотрите на связи, которые образуют эту структуру. Большая часть из них — это силы слабого взаимодействия между молекулами. Это значит, что они очень легко рвутся, даже простого повышения температуры на несколько градусов хватит для того, чтобы эти связи разорвались. Как выйти из такого положения такой большой молекуле? Дело в том, что таких связей настолько много, что существует конформационная лабильность. По сути это означает, что некоторые связи могут рваться, а другие тут же образовываться.
Какой можно сделать вывод из всего этого? Не стоит думать о третичной структуре белка, как о чем-то статичном. Представьте ее как дом, который меняет свой цвет при повышении или понижении температуры, еще он может менять свой размер в зависимости от того идет дождь или нет. Какой странный дом…. В таком долго не проживешь.
Некоторые участки глобулы такие чсвшники, что собираются отдельно от всей остальной молекулы. Эти части называются доменами. Домен собирается в мини-третичную структуру самостоятельно, их даже может быть несколько. Чаще всего они имеют какую-то важную задачу, например, входят в состав активного центра.
Строение активного центра
Стоп-стоп-стоп. Это тиво еще такое? Ты про это ничего не говорил. Точно, помните мы сказали, что с этого уровня белок начинает пахать? А задача глобулы — это связать что-то, опять же грубо. Так вот, как она все это делает? Да-да, через активный центр, такие вы умные конечно… В чем прикол активного центра? Он должен соответствовать молекуле, с которой будет взаимодействовать. Это называется комплементарностью. Не путать с комплиментами.
Активный центр — это замок, а другая молекула — ключ, которые должны подходить друг другу. Такие вот соулмейты. Хотя к некоторым активным центрам могут подходить много ключиков. Связи, которые образуются в активном центре — слабые: чаще всего ионные, водородные и Ван-дер-Вальсовы. Но иногда могут быть и ковалентными, но не будем забегать вперёд — об этом мы поговорим, когда будем разбирать ферменты.
Ну а теперь, как все это работает. В активном центре располагается уникальная последовательность аминокислот, допустим там будет две положительнозаряженных и две отрицательнозаряженных аминокислоты. А у молекулы, с которой происходит взаимодействие, будет: две отрицательных группы и две положительных. Форма молекулы совпадает с формой активного центра. Кстати, у молекулы, которая взаимодействует с активным центром тоже есть свое название — лиганд. Надоели уже эти названия? Мне тоже…
Ах, да — вся третичная структура определяется первичной…. Я знаю, что вы запомнили, но хочу немного понадоедать.
5 типов связей стабилизируют третичную структуру: водородные, гидрофобные, Ван-дер-Вальсовы, ионные и дисульфидные. Эти связи образуются между радикалами.
Четвертичная структура белка
Последняя, но самая большая! Не пугайтесь, только по размеру. Она есть не у всех белков, некоторые прекрасно работают в виде третичной структуры и не парятся. Но представьте, что мы возьмем несколько третичных структур и как соединим их вместе. Пусть их будет 4 штуки, берем 4 шарика и соединяем их. Получаем четвертичную, но не из-за того, что мы взяли 4 шарика….
Эти шарики комплементарны друг другу в участках связывания — не активный центр, но чем-то похоже. Таких участков связывания много, поэтому ошибиться и не узнать своего товарища очень трудно.
Каждая глобула, которую мы взяли — это отдельная полипептидная цепь. Прочитай это еще раз. До этого все касалось только одной полипептидной цепи, а теперь их несколько. Такая цепь называется мономером (или субъединицей), а при соединении мономеров образуется олигомер. Так что вся большая молекула — это олигомер.
Какие связи все это стабилизируют? Чаще всего это водородные, ионные и Ван-дер-Вальсовы, так как каждый мономер прячет свои гидрофобные остатки вглубь молекулы, то они образуются редко. Получается, что четвертичную структуру стабилизируют силы слабого взаимодействия, ковалентных связей здесь почти никогда не бывает — очень редко могут быть дисульфидные. Поэтому можем спокойно забить на них.
В чем отличие четвертичной структуры от третичной? Ну кроме того, что тут объединено несколько полипептидных цепей. А вот какое — у олигомерных белков есть не только активный центр, но и другой — аллостерический центр. К этому замку не подойдут лиганды от активного центра, у него есть свои собственные ключики. Это очень важно, нужно запомнить! Господи, я превращаюсь в препода….
Проведем аналогию с нашим домиком, только теперь их будет несколько. У каждого будет по главному и черному входу! Главный вход — активный центр, а черный ход — это аллостерический центр.
Аллострические центры дают кое-что важное — регуляцию. Маленькая молекула, которая соединится с аллостерическим центром может остановить работу целого огромного белка. Круто? Получается, что размер не важен — не удержался.
Но каким образом одна молекула останавливает работу целого белка? Очень просто — хотел бы я так сказать. Присоединение молекулы к мономеру изменяет его конформацию. А это ведет к тому, что мономер изменяет конформацию других мономеров — происходят конформационные изменения всей структуры белка. В результате этих изменений закрывается активный центр — лиганд не может к нему подойти. У всех этих изменений есть, как и всегда, свое название — кооперативный эффект.
И опять я про дом, если открыть черный ход, то нельзя открыть главный вход, ну и наоборот. Не всегда регуляция работает в таком ключе: черный ход может, наоборот, открывать парадную дверь. Но сейчас это не суть, главное понять смысол. Кстати, на самом деле чаще одна субъединица несет на себе аллостерический центр, а другая активный. Я решил запихнуть все в одну — думаю, что так будет нагляднее.
Кроме этого, присоединение к активному центру также изменяет конформацию остальных мономеров, что приводит к облегченному присоединению лигандов. Хоть на картинке этого и не видно, но поверьте на слово!
В четвертичной структуре взаимодействуют несколько полипептидных цепей!
Стабилизируется молекула силами слабого взаимодействия.
Давайте заканчивать уже со строением.
Простые и сложные белки
До этого мы говорили, что белок — это полипептидная цепь, которая что-то там делает. Иногда даже несколько цепей соединяются и образуют олигомер. Но мы кое-что упускали все это время. Ведь не все белки состоят только из полипептидных цепей. У гемоглобина есть гем, а это не белковая часть, ого! Белки, которые располагаются на поверхности мембран соединяются с углеводами, которые спасают их от разрушения.
Получается, что у некоторых белков есть дополнительные компоненты. Есть простые белки — они состоят только из аминокислотных остатков, а есть белки сложные. Они включают в себя белковую часть (апопротеин), и небелковую (простетическая группа). Простетические группа связана с белком с помощью ковалентных связей — просто так её не оторвёшь. Она очень важна, потому что белки без неё уже не могут работать. Простетических групп очень много — это могут быть металлы, углеводы, гем, липиды и еще куча всего. Но это так, для общего развития.
У нас осталось последнее.
Денатурация белка
Так долго мы добирались до четвертичной структуры, но теперь время все УНИЧТОЖИТЬ. Денатурация — это потеря функции белка, через разрушение его четвертичной, третичной и вторичной структуры. Но не первичной! Процесс может остановиться и раньше, не дойдя до первичной. Но самое важное — белок перестает работать. Это значит вот что: если у белка есть только третичная структура, то её потеря приведёт к потере функций. Тоже самое касается белков с четвертичной структурой.
Денатурирующие факторы делятся на физические и химические.
Физические факторы
У всех этих факторов общий механизм действия. Они вносят в систему дополнительное количество энергии. Это вызывает увеличение амплитуды колебательных движений фрагментов полипептидной цепи. Из-за этого рвутся слабые связи, стабилизирующие белковую молекулу — водородные, гидрофобные и Ван-дер-Вальсовы. Вот некоторые из этих факторов:
Химические факторы
Химические денатурирующие факторы различаются по механизму действия. Так что разбираемся с каждым отдельно. Представим, что мы рвём каждую связь:
1) Добавим кислоту или щелочь в раствор, где находится белок — произойдет изменение заряда некоторых аминокислот. Раз изменился заряд, то происходит разрушение водородных и ионных связей.
2) Детергенты — это вещества, у которых есть гидрофобные и гидрофильные участки. Если засунуть их внутрь молекулы, то гидрофобное взаимодействие нарушится. Примеры детергентов — фенолы, додецилсульфат.
3) С помощью тяжелых металлов мы порвем дисульфидные мостики в третичной структуре. Такими тяжелыми металлами будут: свинец, медь и ртуть.
4) Восстанавливающие агенты — восстанавливают дисульфидные связи. Смысл такой же, как и с тяжелыми металлами: разрушение дисульфидных мостиков. Пример — меркаптоэтанол.
5) Вещества, образующие водородные связи — мочевина. Это ужасная воровка, она перетягивает водородные связи с белка на себя.
Но, мы сказали, что это разрушает вторичную, третичную и четвертичную структуры, но не первичную. Она остается целой. А так как она отвечает за формирование всех остальных, то при удалении денатурирующего фактора белок может снова стать работоспособным, восстановив свою структуру. Это процесс называется ренативация белка. Для этого нужны определённые условия, но они не всегда достижимы в клетке. Поэтому для большинства белков денатурация — это необратимый процесс.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.