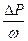Жидкость в однофазном состоянии что это
Жидкость в однофазном состоянии что это
Вы производите оборудование, работающее под избыточным давлением: сосуды, аппараты, теплообменники, колонны, трубопроводы, котлы и т.п., тогда Вам нужно идти к нам!
А если серьезно, то наша компания одна из первых аккредитовалась на ТР ТС 032/2013
(далее Технический регламент «Оборудование, под давлением…») и, что не маловажно, начала проводить работы по сертификации в соответствии с этим регламентом. Когда многие
не хотели быть первыми и ждали реакции большинства, мы делали все в соответствии
с написанным в регламенте на свой страх и риск. Технический регламент «Оборудование,
под давлением…» достаточно сложный регламент. Он не похож на все предыдущие технические регламенты Таможенного союза, которые вступили силу до него. Редактировался он с участием Федеральной Службы по Экологическому, Технологическому и Атомному надзору (Ростехнадзор) и похож немного на правила промышленной безопасности, которые существовали ранее.
Для того, чтобы определиться требуется проводить подтверждение соответствия ТР ТС 032/2013 нужно не так много: определить для какой среды предназначено ваше оборудование, определить вместимость вашего оборудования или диаметр и максимально допустимое рабочее давление. Это все. Зная эти три параметра, вы четко для себя можете понять каким требованиям должна соответствовать ваша продукция. Если вы знаете для какой среды применяется оборудование, тогда определите к какой группе относится Ваша среда.
Если рабочая среда может быть разная, то нужно выбирать самую опасную. Технический регламент «Оборудование, под давлением…» разделяет среды на две группы первую и вторую.
Группа 2 – это все остальные среды, кроме сред относящихся к группе 1. Теперь вы знаете,
к какой группе относится Ваша рабочая среда. Далее нужно открыть приложение 1 к ТР ТС 032/2013. Там есть несколько таблиц. Таблицы делятся по оборудованию и по рабочей среде. Конкретней таблицы делятся на сосуды, котлы и трубопроводы. В свою очередь сосуды делятся на две группы и так же котлы и трубопроводы.
Что это значит? Если Ваша среда относится к группе 1 и вы производите сосуды, тогда Вам нужна таблица 1. И по таблице вы уже смотрите, зная вместимость и максимально допустимое рабочее давление, и выбираете категорию вашего оборудования.
Гидростатика



Силы, действующие в жидкости.
Модели жидкостей.
Однофазные и многофазные жидкости.
Ньютоновские и неньютоновские (аномальные) жидкости.
Жидкость, вязкость которой определяется природой и состоянием (температура, давление), называется ньютоновской (вода, пар, воздух).
Жидкость, вязкость которой не является постоянной, а зависит от времени действия и величины касательных напряжений, называется неньютоновской (растворы полимеров, пластичные материалы, обладающие порогом текучести).
Ньютоновские жидкости представляют собой жидкости однофазной системы. На практике чаще всего встречаются двухфазные системы.
Жидкость – пар (система отопления, конденсат).
В зависимости от решаемой задачи в гидравлике используют следующие модели жидкости:
1) Невязкая и несжимаемая.
Т.е. такая жидкость, в которой отсутствуют силы трения и плотность не изменяется с изменением температуры и давления. (идеальная)
2) Невязкая и сжимаемая.
Т.е. такая жидкость, в которой отсутствуют силы трения, а плотность изменяется с изменением давления и температуры. Используется для газов.
3) Вязкая и несжимаемая.
Т.е. такая жидкость, в которой присутствуют силы трения, плотность постоянна. Используется при движении капельных жидкостей.
4) Вязкая и сжимаемая.
Т.е. такая жидкость, в которой присутствуют силы трения, плотность непостоянна. Это наиболее точная модель, отвечающая как жидкостям, так и газам.
Различают внешние, внутренние, массовые и поверхностные силы.
Внешние – такие силы, которые действуют на жидкость извне, со стороны других материальных тел.
Внутренние – силы, которые возникают, если из жидкости выделяется некоторый объем, а оставшаяся часть отбрасывается. Действие же отброшенной части заменяется силой, так же как и действие выделенного элемента на отброшенную часть жидкости.
Внутренние – силы, равные по величине и противоположенные по направлению. Всегда парные. А в целом в объеме жидкости сумма всех внутренних сил равна нулю.
Массовые – силы, действующие на единицу массы жидкости и пропорциональные этой массе (сила тяжести, инерции, центробежная сила).
Поверхностные – силы, которые действуют на поверхность жидкости и пропорциональны ее площади (трение, поверхностное натяжение).
В гидравлике принято иметь дело с единичной массовой силой.
Единичная массовая сила – сила, отнесенная к массе, она численно равна ускорению.
Лекция 2
Гидростатика- раздел гидравлики, изучающий равновесие жидкостей.
Рассмотрим часть жидкости, находящуюся в равновесии. Мысленно делим эту жидкость плоскостью на 2 части.
Одну часть мысленно отбросим. Действие отброшенной части на вторую заменяем силой для сохранения равновесия (Р), площадь, на которую действует сила – ω. Тогда средним гидростатическим давлением будем называть отношение силы давления к площади, на которую она действует.
ρ = Р/ ω.
Давлением точки будем называть предел, к которому стремится ρср, если ω→0.
ρ = 
Гидравлическое давление обладает 2 свойствами:
1) Всегда направлено по внутренней нормали к поверхности, на которую оно действует и создает только сжимающее напряжение.
2) Величина в точке не зависит от направления площадки, по которой оно определяется (используется при решении задач)
Давление слева от точки равно давлению справа от точки.
Документы
ФАЗОВОЕ СОСТОЯНИЕ ПРИРОДНЫХ ГАЗОВЫХ СИСТЕМ
Процесс испарения жидкостей, происходящий в результате увеличения давления, создаваемого газом. — явление, обычное для условий нефтяных месторождений.
Знание фазового состояния углеводородных смесей необходимо для правильного подхода к использованию природных углеводородных систем газ —- жидкость. Цель изучения фазового поведения смесей состоит в том, чтобы, зная состав смеси, иметь возможность предвидеть количественные соотношения жидкой и газовой фаз, находящихся в равновесии, при любых значениях давления и температуры. Правильное представление о поведении индивидуальных углеводородов помогает предсказать свойства вещества, находящегося в однофазном состоянии. Знание природы простых омесей облегчает изучение поведения более сложных систем, к числу которых относятся природные газы.
§ 1. ИНДИВИДУАЛЬНЫЕ ВЕЩЕСТВА. УПРУГОСТЬ ПАРОВ
Индивидуальные вещества в зависимости от температуры и давления могут находиться в парообразном, жидком или твердом состоянии. Если вещество находится в однофазном состоянии, то его объем V будет определяться температурой вещества Т и давлением р. На рис. III. 1 [III. 66] дано соотношение pVT для индивидуального вещества в пространственной системе координат. Фазовое состояние вещества на этом рисунке изображается поверхностями среза. Вследствие того, что пользоваться такими пространственными диаграммами более сложно, чем двухразмерными, обычно при изучении фазового состояния компонентов природного газа применяют графики зависимости давление — объем (проекция диаграммы рис. III. 1 на плоскость с осями давление — объем)’при постоянной температуре (рис. 111.3) и давление— температура (рис. III. 2) при постоянном объеме.
Рис. III. 1. Пространственная диаграмма давление — объем — температура для индивидуального вещества [111.66].
/ — твердое состояние: 2 — твердое состояние + жидкость; 3 — жидкость; 4 — жидкость + пар; 5 — пар; б —твердое состояние + пар.
Условия, при которых в одно и то же время часть вещества мйжет существовать в газообразном, а часть в жидком состоянии, выделены на рис. III. 1 площадью HbCdl. Линии, проведенные внутри этой площади, параллельны плоскости основания диаграммы, поэтому проекции линий СЬН или Cdl на плоскость с координатами давление — температура обращаются в одну кривую (НС на рис. III. 2), известную как кривая давле-
Рис. III. 2. Диаграмма давление — температура.
/ _ твердое состояние: 2 — жидкость;
3 — пар; 4—-тройная точка; 5 — сжатая жидкость; 6 — перегретый пар или газ.
В точке Н одновременно существуют все три фазы При этом индивидуальный компонент может находиться в равновесном трехфазном состоянии только при значениях давления и температуры, соответствующих этой точке.
Линии, соответствующие постоянной температуре (такие, как abde на рис. III. 1), могут быть нанесены как изотермы (рис. III 3) на графике, выражающем зависимость объема от давления. Данные изменения плотности насыщенных фаз (представляющие величины, обратные удельным объемам) приведены на рис. III. 4. Необходимо отметить, что при увеличении температуры удельный объем жидкой фазы увеличивается (плотность уменьшается), а объем газообразной фазы, наоборот, уменьшается (плотность растет), причем в критической точке С их удельные объемы и плотности становятся одинаковыми. В точке, соответствующей критической температуре и критическому давлению, становятся одинаковыми и все другие свойства обеих фаз.
Если на графике рис. III. 4 провести линию среднего значения плотностей насыщенного жидкостью газа и насыщенной газом жидкости, то эта линия пересечет кривую плотности в критической точке. Этот факт известен под названием правила прямолинейного диаметра, а методика предложена Кайлететом и Матиасом (Cailletet and Mathias) в 1886 г. [III. 12]. Изучение явления и обзор свойств углеводородов в критической точке сделаны Кобе и Линном (Кове and Lynn) [III. 38].
Рис. III. 3. Диаграмма давление — объем для метана [111.42].
Рис. 111.4. Ортобарическая плотность метана [111.37].
/ — насыщенная жидкость; 2 — средняя плотность; 3 — насыщенный пар; 4 — критическая точка.
Наиболее важные свойства индивидуальных веществ выражаются кривой упругости пара, представляющей зависимость температуры кипения от давления. Индивидуальные углеводороды встречаются в различных технологических процессах или в лабораторных исследованиях, поэтому необходимо знать характер кривых упругости пара. На рис. III. 5 и III. 8 приведены кривые упругости пара различных легких углеводородов, встречающихся в газовой промышленности.
Рис. III. 7. Упругость паров для газов при низких температурах.
UO 50 60 70 80 90 100 150 200 250 300 350 Ш 500
Рис. HI. 6. Упругость паров метановых
j _ изобутан, 2-метилпропан; 2 — нсопснтан, 2,2-диметилпропан;
5 — диизопропил, 2,3-диметилбутан; 6 — 2-метилпентая; бутил, 2,5-диметилгексан; № — 2, 2, 3, 3-тетраметилбутаи;
метилоктан; 14 — 2,7-диметилоктан;
UO 50 60 70 80 90 100 150 200 250 300 350 Ш 500
углеводородов изомерного строения.
3 — нзопентан, 2-метилбутан: 4 — неогексан, 2,2-диметилбутап;
7 — 3-метилпентан; S — изооктан, 2. 2, 4-триметилпентан; 9 — диизи» // — 2. 2. 4,4-тетраметилпентан; 12 — 3-3-ДЧЭТИЛпентан; 13 — 2.6-ди-15 2-метилгептэдекац.
Абсолютное давление, am
Рис. III. 8. Упругость паров
27 — ундекен-1 СцНаа; 28 — ундекен-1
&Q 50 60 70 80 90 100 150 200 250 300 350 ЬПО 50В
Абсолютное давление ат
29 — ундекин-1 С i г 1 ‘ 1 *»-
Правило фаз, впервые сформулированное Уиллардом Гиббсом (J. Willard Gibbs) в 1876 г. [III. 14, III. 21], является важнейшим инструментом изучения фазового состояния. Это правило применяется к системам, находящимся в условиях равновесия. Состояние равновесия между фазами может быть достигнуто или путем длительного выдерживания системы при постоянных давлениях и температуре, или путем интенсивного перемешивания системы. В условиях равновесия каждая фаза системы однородна по своему составу. Отдельные ком. попенты из одной фазы в другую не переходят. В газовой и нефтяной промышленности большое количество систем газ — жидкость практически находится в состоянии равновесия. Но даже если система не находится в состоянии равновесия, законы, управляющие равновесием, накладывают на систему определенные ограничения. Если разные фазы находятся в равновесии друг с другом, то говорят, что фазы находятся в состоянии полного взаимного насыщения.
Правило фаз обычно выражается следующим уравнением:
где С — число независимых компонентов; Р — число фаз; F — число переменных величин, необходимых для определения состояния системы в условиях равновесия, или число степеней свободы.
Кейс (Case) [III. 14] указывал, что «правило фаз является простым средством решения некоторых химических и физических задач с помощью простых алгебраических действий» и что «число независимых уравнений должно быть равно числу переменных, чтобы из этих уравнений можно было найти значения этих переменных». Степени свободы для системы учитывают температуру, давление и состав фаз. Для системы, состоящей из двух или более фаз, концентрация входящего в нее компонента не относится к числу переменных правила фаз, хотя концентрация в данной фазе является переменной правила фаз.
Двухкомпонентные системы, находящиеся в двухфазном состоянии, имеют две степени свободы. В этом случае состояние системы будет определяться температурой и давлением. Для определения состояния трехкомпонентной системы, существующей одновременно в виде жидкости и пара, необходимо знать температуру, давление и какое-либо переменное, характеризующее состав фаз. Этой величиной может быть концентрация одного компонента в какой-либо фазе или (что бывает чаще) отношение концентрации одного компонента к концентрации другого компонента. Для определения системы природного газа, состоящего из семи компонентов и находящегося в двухфазном состоянии, требуется знание семи переменных: температуры, давления и пяти значений концентрации компонентов в какой-либо фазе. Обычно известны только давление и температура многокомпонентных смесей и неизвестны концентрации компонентов в фазах. При определении фазовых соотношений смеси по температуре и давлению удобнее исходить из предположения, что смеси подчиняются законам идеальных растворов.
§ 3. НЕПРЕРЫВНОСТЬ ПАРОВОЙ И ЖИДКОЙ ФАЗ
Термины «пар» и «жидкость» удобно использовать для того, чтобы разграничить более плотную фазу от менее плотной. Однако при критических условиях разница между паровой и жидкой фазами исчезает.
В 1869 г. Томас Андрьюс (Thomas Andrews) [III. 3] прочёл лекцию «о непрерывности газообразного и жидкого состояния вещества», в которой указал, что «обычнее газовое состояние и обычное жидкое состояние являются по существу резко отдельными формами материи существования одного и того вещества и из одного состояния в другое можно перевести вещество путем постепенного перехода без разрыва непрерывности».
В подтверждение этой мысли рассмотрим изменение состояния метана (рис. III. 2). В точках, лежащих на линии НС (рис. 111.2), пар и жидкость существуют одновременно. Если от этой смеси в точке bd отводить тепло, то количество жидкости в смеси будет увеличиваться. Когда же вся смесь превратится в жидкость, температура начнет понижаться. Поэтому вполне естественно, что площадь, расположенная выше и левее кривой НС, соответствует жидкому состоянию. Область же, расположенная по другую сторону от кривой НС, соответствует парообразному состоянию и на рисунке обозначена как пар. Чтобы проиллюстрировать положение о том, что термины «пар» и «жидкость» служат для характеристики менее плотной и более плотной фаз в случае, когда вещество находится в двухфазном состоянии, а не для описания однофазного состояния вещества, рассмотрим жидкость в точке Ь (рис. III. 2) и поведение системы при изменении условий по траектории brfghqd. В точке Ь система находится в жидком состоянии. При движении системы по вышеуказанной траектории не имеется никаких фазовых изменений. Находится ли вещество в точке d в состоянии пара? Если да, то каким образом жидкость из точки Ь переходит в парообразное состояние в точке d без каких-либо изменений?
Чтобы иллюстрировать непрерывность паровой и жидкой фаз в закритической области, на рис. III. 9 приведена диаграмма давление — температура р—Т, на которой фазы различаются интенсивностью окраски. Чем слабее окраска, тем менее плотной является фаза. Резкое различие в фазах наблюдается лишь вдоль кривой и исчезает в критической точке.
Состояние чистого вещества, находящегося в закритической области при высоком давлении, удобнее назвать однофазным, так как применение терминов «пар» или «жидкость» без указания значений плотности или других свойств может привести к заблуждению. В об*
ласти на рис. III. 2, обозначенной «жидкость», вещество может быть названо сжатой жидкостью, а при температурах, превышающих температуры, соответствующие кривой давления насыщенного пара, — перегретым паром. Однако по мере приближения условий, в которых находится вещество, к критическим (критическая температура и давление) эти термины становятся менее определенными. Термины «газ» и «пар» являются равнозначными. Термин «пар» может иметь значение, обозначающее близость вещества к жидкому состоянию, а термин «газ», наоборот, отдаленность состояния вещества от условий образования жидкости. Иногда термин «газ» используется для названия состояния вещества, находящегося при температуре выше критической, а термин «пар» для обозначения состояния вещества, находящегося при температуре ниже критической, т. е. состояния, при котором вещество путем повышения давления можно перевести в жидкость.
Рис. III. 9. Непрерывность парообразного и жидкого состояний [111.28].
§ 4. РЕТРОГРАДНЫЕ ЯВЛЕНИЯ
Одним из первых фазовое состояние смеси веществ в критической области исследовал Кюнен (Kuenen) в 1892 г. [III. 39, 111.28]. Он изучил фазовое состояние смеси углекислого газа с метилхлоридом. Кюнен заметил, что изменения фазовых состояний смесей веществ отличаются от изменений фазовых состояний индивидуальных веществ. Эти аномальные явления он назвал ретроградными [111.28]. В качестве иллюстрации на графике рис. III. 10 показано изменение состояния угле-
от точки К до точки В не вызывает появление второй фазы, а соответствует однофазному состоянию вещества. В точке В, названной точкой кипения, в жидкости появляются пузырьки пара, находящиеся в равновесии с жидкостью. При дальнейшем уменьшении давления содержание пара возрастает, достигая 20% по объему в точке F. Точки кривой ABC называются точками кипения смеси.
С другой стороны, увеличение давления при постоянной температуре от точки J до точки Е также соответствует однофазному состоянию вещества. Начиная с точки Е, в паровой фазе начинают образовываться капельки жидкости, находящиеся в равновесии с паровой фазой. Дальнейшее увеличение давления, начиная от точки Е, приводит к увеличению количества жидкости, конденсировавшейся из паровой фазы. Уменьшение давления от точки L до D также приводит к появлению капелек жидкости в паровой фазе. Кривая EJDC называется кривой точек росы. Уменьшение давления от точки М до точки С приводит к внезапному изменению состояния вещества. Из однофазного состояния в точке М вещество переходит в точке С в двухфазное, состоящее примерно на 50% из пара и на 50% из жидкости. Это получается потому, что свойства пара вдоль кривой точек росы и свойства жидкости вдоль кривой точек кипения меняются таким образом, что становятся в точке С одинаковыми. Точка С называется критической точкой смеси. Физически критическую точку найти очень трудно, и поэтому эта точка быстрее находится графически как точка пересечения кривых точек кипения и точек росы с линиями процентного содержания жидкости в смеси.
Рис. III. 10. Диаграмма фазового состояния смеси.
водородной смеси. Внутри кривой ABCDITE смесь находится в двухфазном состоянии (пар и жидкость). Вне этой кривой вещество находится в однофазном состоянии. Уменьшение давления при постоянной температуре
Сжатие индивидуальных веществ, находящихся в парообразном состоянии, до кривой давления насыщенного пара приводит к образованию капелек жидкости, т. е. поведение системы от точки J до точки Е является обычным для индивидуального вещества. Необычным является поведение смеси веществ при переходе из точки L в точку G через точку D. В этом случае в отличие
от индивидуальных веществ при снижении давления из паровой фазы образуется жидкость. Явление образования жидкости при изотермическом расширении однофазного вещества называется ретроградной конденсацией [III. 28]. При расширении от точки D до / максимально увеличивается процентное содержание жидкой фазы в точке G при данной температуре системы. При дальнейшем уменьшении давления жидкая фаза начинает нормально испаряться целиком, переходя в точке Е в паровую фазу. Во время увеличения давления в смеси от точки G до D при постоянной температуре жидкая фаза также испаряется. Этот процесс испарения жидкости, происходящий при повышении давления, йазывает-ся ретроградным испарением. Этот термин применяется при испарении жидкости, происходящем в процессе сжатия системы пар — жидкость. Терминами «ретроградная конденсация» и «ретроградное испарение» можно характеризовать и изобарический процесс для смеси, в котором изменение фазового состояния обратно изменению фазового состояния, имеющего место при тех же условиях для индивидуального вещества. На рис. III. 10 заштрихованная площадь CDIGC представляет собой единственную область диаграммы, соответствующую ретроградным явлениям.
В веществе, находящемся вблизи критической точки, происходит изменение цвета. Это явление известно под названием критической опалесценции [111.70]. Видимо, молекулярная агрегация, хотя и недостаточна для разделения смеси на фазы, все же вызывает рассеяние света. При уменьшении давления от значения, соответствующего однофазному состоянию, до давления, соответствующего граничной кривой вблизи критической точки, система окрашивается в красновато-коричневый цвет в проходящем свете или в светло-голубой цвет в отраженном свете. В небольших пределах изменения давления окраска сохраняется в обеих фазах. Сравнительно более интенсивно окрашены смеси, содержащие более высококипящие углеводороды. Интенсивность окраски является наибольшей при критической температуре и еще может наблюдаться при температуре, отличающейся от критической на 17—22°С.
В литературе имеются данные о растворимости газообразных компонентов в жидкостях. При определении растворимости газов испарением жидкостей пренебрегали. Однако было установлено, что летучестью жидкости при высоких давлениях пренебрегать нельзя и, следовательно, в этом случае необходимо рассматривать состав обеих фаз системы. До 1896 г. Виллард (Villard) [111.72] провел уникальные эксперименты, в которых он наблюдал испарение брома, йода и парафина при повышении давления, создаваемого метаном, до 280 ат. Эти эксперименты указывали на возможность растворения жидкостей и твердых тел в газах. Мергам и Кобе
В работе Дау и Калкина (Dow and Calkin) [III. 18] исследована растворимость природного газа в нефти. Изучению растворимости метана в различных углеводородных жидкостях посвящена работа Сэджа и Леси (Cage and Lacey) [111.59]. Фролих (Frolich) с соавторами определяли растворимость метана, водорода и азота в различных жидких смесях [III. 20]. Скоч (Schoch) с соавторами исследовал влияние химической природы растворителя на растворимость метана [111.65].
Обычно принято представлять данные фазового состояния бинарных систем в виде изотерм на диаграмме давление — состав системы или изобар на диаграмме температура — состав системы, как это сделано для бинарных систем на рис. III. 16, III. 17 и III. 18. Значения плотности насыщенных пара и жидкости системы этан — гептан, полученные Кеем (Kay) [Щ. 30], приведены на рис. III. 19.
80 120 /60 200 Температура, °С