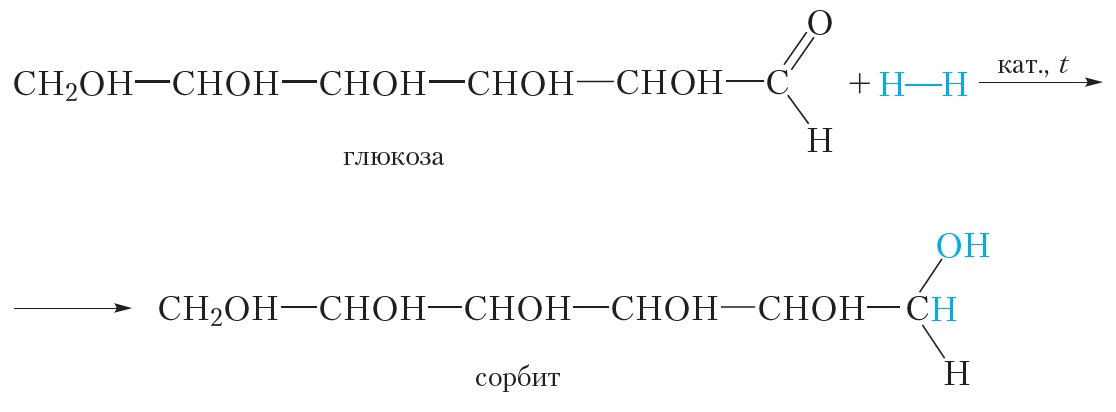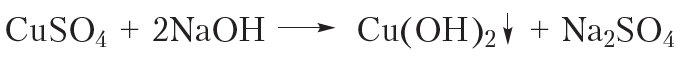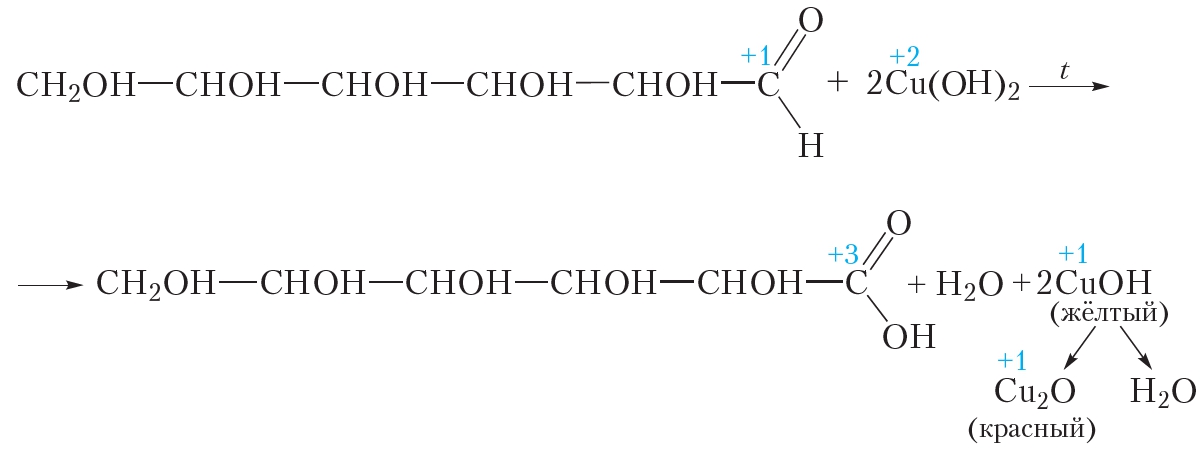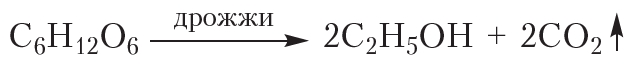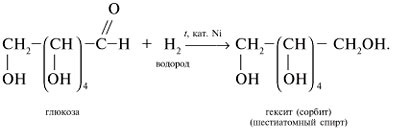Доказать что глюкоза альдегидоспирт
Химия. 10 класс
§ 41. Химические свойства глюкозы
Химические свойства глюкозы
В молекуле глюкозы имеются альдегидная и гидроксильные группы, поэтому для неё характерны химические свойства как альдегидов, так и многоатомных спиртов.
Сначала рассмотрим реакции с участием альдегидной группы молекулы глюкозы. Поскольку альдегидная группа имеется только в линейной форме глюкозы, в уравнениях реакции будем записывать формулу глюкозы в линейной форме.
1. Присоединение водорода. Восстановление
Альдегидная группа глюкозы может присоединить молекулу водорода. Эта реакция сопровождается разрывом π-связи между атомами углерода и кислорода альдегидной группы:
Образующийся шестиатомный спирт называется сорбит. Он имеет сладкий вкус и используется в качестве заменителя сахара.
В результате присоединения водорода молекула глюкозы восстанавливается, поэтому реакцию с водородом также называют реакцией восстановления.
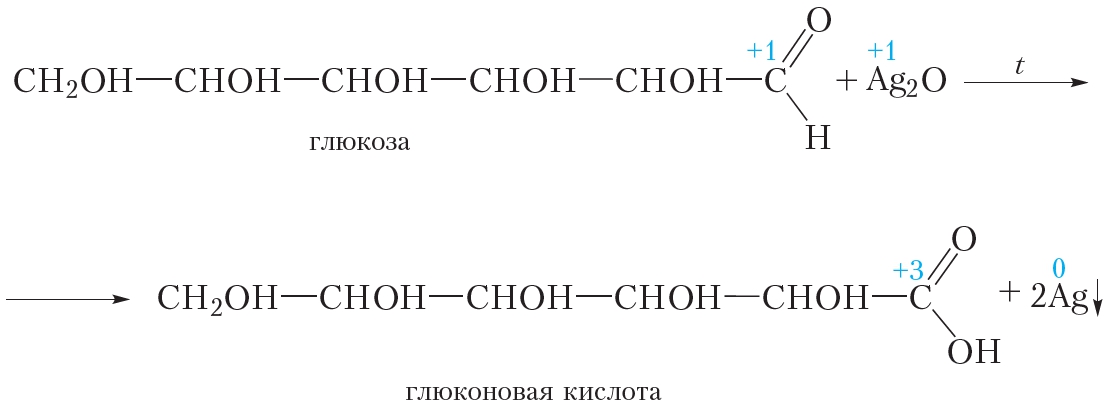
2. Окисление аммиачным раствором оксида серебра
Глюкоза даёт качественную реакцию на альдегиды, восстанавливая серебро из аммиачного раствора оксида серебра (реакция «серебряного зеркала»). При этом альдегидная группа молекулы глюкозы окисляется до карбоксильной:
В результате реакции образуется глюконовая кислота.
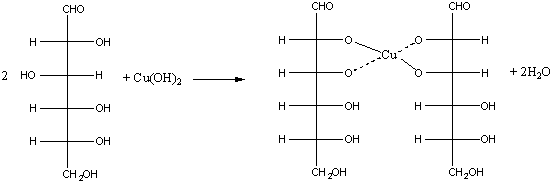
3. Взаимодействие с гидроксидом меди(II)
Взаимодействие с гидроксидом меди(II) является качественной реакцией как на многоатомные спирты, так и на альдегиды. Глюкоза проявляет свойства как многоатомных спиртов, так и альдегидов. Рассмотрим, что будет наблюдаться при взаимодействии глюкозы с гидроксидом меди(II). Смешаем в пробирке растворы щёлочи и сульфата меди(II). При этом выпадает голубой осадок гидроксида меди(II):
При добавлении в пробирку водного раствора глюкозы происходит растворение гидроксида меди(II) и образуется прозрачный раствор васильково-синего цвета. Такой же эффект наблюдается при действии многоатомных спиртов на свежеосаждённый гидроксид меди(II). Как и в случае многоатомных спиртов, растворение гидроксида меди(II) при взаимодействии с глюкозой происходит вследствие образования растворимого в воде комплексного соединения (§ 25). Эта реакция является качественной реакцией на многоатомные спирты.
В то же время взаимодействие глюкозы с гидроксидом меди(II) имеет интересную особенность, которая позволяет легко отличить глюкозу от многоатомных спиртов. Нагреем содержимое пробирки на пламени спиртовки. В случае многоатомного спирта васильково-синий раствор закипит, но окраска его не изменится. Проба с глюкозой ведёт себя совершенно иначе. При нагревании в пробирке сначала образуется жёлтый осадок, который затем краснеет. Образующаяся смесь напоминает морковный сок. Уравнение протекающей реакции:
Красный осадок представляет собой оксид меди(I) Cu2O. В данной реакции гидроксид меди(II) восстанавливается до оксида меди(I), а глюкоза окисляется до глюконовой кислоты.
В описанном эксперименте глюкоза сначала проявляет свойства многоатомного спирта, растворяя свежеосаждённый гидроксид меди(II). При нагревании смеси происходит реакция уже с альдегидной группой глюкозы — ионы меди(II) окисляют её до карбоксильной группы.
4. Спиртовое брожение
Некоторые микроорганизмы, например дрожжи, обладают способностью преобразовывать глюкозу в этиловый спирт. Этот процесс называется спиртовым брожением глюкозы:
Молочнокислые бактерии обладают способностью преобразовывать глюкозу в молочную кислоту. Этот процесс называется молочнокислым брожением глюкозы:
Молочная кислота является замечательным природным консервантом. Она образуется при скисании молока и содержится в кисломолочных продуктах (простокваша, кефир, творог и др.) которые, в отличие от свежего молока, могут храниться достаточно долго. Наличием молочной кислоты обусловлен кислый вкус этих продуктов. Молочная кислота образуется также в процессах квашения капусты, мочения яблок, силосования зелёных кормов, она препятствует протеканию процессов гниения и позволяет сохранять продукты долгое время.
Глюкоза широко встречается в природе в составе многих овощей и фруктов. Особенно много её в винограде, поэтому глюкозу часто называют виноградным сахаром.
Глюкоза используется в медицине как лекарственный препарат, в частности при ослаблении и интоксикации организма.
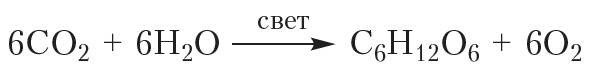
В природе глюкоза образуется в зелёных растениях в процессе фотосинтеза:
В промышленности глюкозу получают из целлюлозы и крахмала, подробнее об этом — в следующих параграфах.
В молекуле глюкозы имеются альдегидная и гидроксильные группы, поэтому для неё характерны химические свойства как альдегидов, так и многоатомных спиртов.
Глюкоза даёт качественную реакцию на многоатомные спирты — образование раствора васильково-синего цвета при взаимодействии со свежеосаждённым гидроксидом меди(II).
Глюкоза даёт качественные реакции на альдегидную группу, окисляясь до глюконовой кислоты при нагревании с гидроксидом меди(II) или аммиачным раствором оксида серебра.
Как и альдегиды, глюкоза присоединяет водород. При этом происходит восстановление глюкозы и образуется шестиатомный спирт сорбит.
Под действием бактерий глюкоза подвергается спиртовому брожению с образованием этанола и молочнокислому брожению с образованием молочной кислоты.
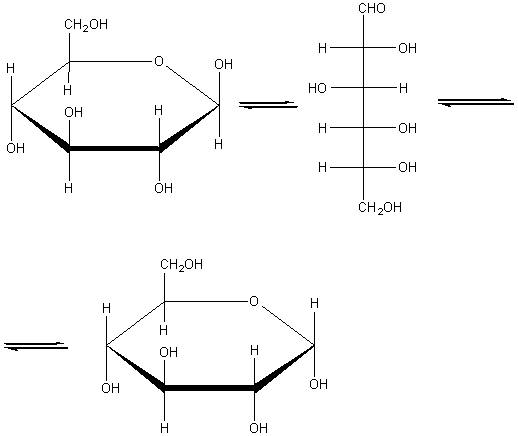
Глюкоза C6H12O6 (альдегидоспирт).
Глюкозу называют также виноградным сахаром, так как она содержится в большом количестве в виноградном соке. Кроме винограда глюкоза находится и в других сладких плодах и даже в разных частях растений. Распространена глюкоза и в животном мире: 0,1% ее находится в крови. Глюкоза разносится по всему телу и служит источником энергии для организма. Она также входит в состав сахарозы, лактозы, целлюлозы, крахмала.
В организме человека глюкоза содержится а мышцах, крови, и в небольших количествах во всех клетках.
В природе глюкоза на ряду с другими углеводами образуется в результате реакции фотосинтеза:
6СО2+6Н2О хролофил С6Н12О6+6О2-Q.
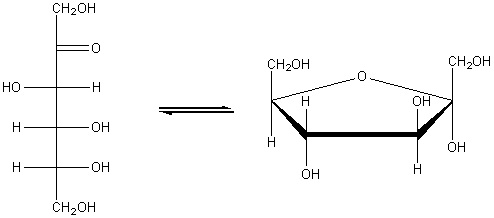
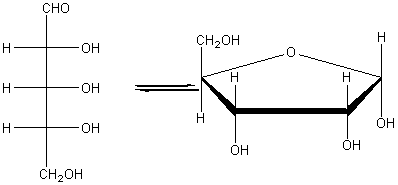
Глюкоза может существовать в линейной и циклической формах:
Получение.
Первый синтез простейших углеводов из формальдегида в присутствии гидроксида кальция был произведен А. М. Бутлеровым в 1861 г. На производстве глюкозу чаще всего получают гидролизом крахмала в присутствии серной кислоты:
(С6Н10О5)n + nН2О Н2SO4, t nС6Н12О6
Химические свойства:
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами.
1) Реакции альдегидной группы:
а) реакция «серебряного зеркала»:
б) реакция с гидроксидом меди (II):
2) Реакции гидроксильной группы:
а) взаимодействие с гидроксидом меди (II): Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная реакция). Осадок гидроксида меди(II) сначала растворяется, затем при нагревании становится желто-оранжевым, что говорит о наличии альдегидной группы.
При действии бромной водой глюкоза также окисляется в глюконовую кислоту.
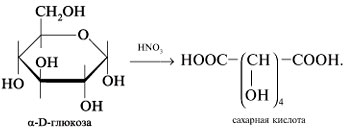
-Окисление глюкозы азотной кислотой приводит к двухосновной сахарной кислоте:
Восстановление глюкозы в шестиатомный спирт сорбит:
Cорбит содержится во многих ягодах и фруктах.
б) брожение – расщепление глюкозы под действием ферментов (специфические реакции)
Существуют специфические свойства глюкозы, подобно алифатическим альдегидам она присоединяет молекулу синильной кислоты. Что позволяет увеличить длину цепи углевода:
Фруктоза C6H12O6 (кетоноспирт). В растительном мире широко распространена фруктоза или фруктовый (плодовый) сахар. Фруктоза содержится в сладких плодах, меде. Извлекая из цветов сладких плодов соки, пчелы приготавливают мед, который по химическому составу представляет собой в основном смесь глюкозы и фруктозы. Также фруктоза входит в состав сложных сахаров, например тростникового и свекловичного.
Химические свойства:Фруктоза вступает во все реакции, характерные для многоатомных спиртов, однако реакции карбонильной (альдегидной) группы, в отличие от глюкозы, для нее не характерны.
Рибоза C5H10O5 – пентоза (альдегидоспирт)
Химические свойства аналогичны глюкозе.
Дисахариды.
Сахароза C12H22O11 – дисахарид. Сахароза образована остатками a-глюкозы и b-фруктозы:
Химические свойства:
Сахароза глюкоза фруктоза
2) Взаимодействие с гидроксидом кальция с образованием сахарата кальция.
3) Сахароза не реагирует с аммиачным раствором оксида серебра, поэтому ее называют невосстанавливающим дисахаридом.
Индусы еще за 300 лет до нашей эры умели получать тростниковый сахар из тростника. В наше время получают сахарозу из тростника, произрастающего в тропиках (на о.Куба и в других странах Центральной Америки).
В середине 18 века дисахарид был обнаружен и в сахарной свекле, а в середине 19 века был получен в производственных условиях.
В сахарной свекле содержится 12-15% сахарозы, по другим источникам 16-20% (сахарный тростник содержит 14-26% сахарозы).
Тростниковый сахар применяется в медицине для изготовления порошков, сиропов, микстур и т.д.
Свекловичный сахар широко применяется в пищевой промышленности, кулинарии, приготовлении вин, пива и т.д.
Значение лактозы очень велико, т.к. она является важным питательным веществом, особенно для растущих организмов человека и млекопитающихся животных.
Солодовый сахар широко распространен как в растительных, так и в животных организмах. Например, он образуется под влиянием ферментов пищеварительного канала, а также при многих технологических процессах бродильной промышленности: винокурения, пивоварении и т.д.
Мальтоза С12H22O11 – дисахарид, образованный двумя остатками a-глюкозы.
Лактоза состоит из остатков (3-галактозы и а-глюкозы в пиранозной форме, соединенных через 1-й и 4-й атомы углерода. Все эти вещества представляют собой бесцветные кристаллы сладкого вкуса, хорошо растворимые в воде. Химические свойства дисахаридов определяются их строением. При гидролизе дисахаридов в кислой среде или под действием ферментов связь между двумя циклами разрывается и образуются соответствующие моносахариды, например:
По отношению к окислителям дисахариды делят на два типа: восстанавливающие и невосстанавливающие. К первым относятся мальтоза и лактоза, которые реагируют с аммиачным раствором оксида серебра по упрощенному уравнению:
Эти дисахариды могут также восстанавливать гидроксид меди (II) до оксида меди (I):
человека. Лактоза содержится в молоке (от 2 до 8%) и получается из молочной сыворотки. Мальтоза содержится в проросших семенах хлебных злаков. Мальтоза также образуется при неполном гидролизе крахмала.
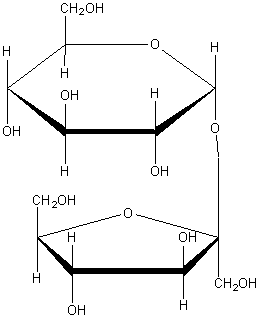
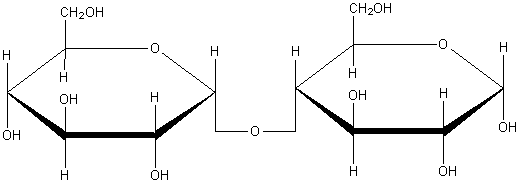
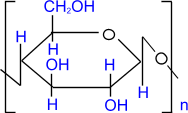
Полисахариды: Молекулы полисахаридов можно рассматривать как продукт поликонденсации моносахаридов. Важнейшие из полисахаридов – это крахмал и целлюлоза (клетчатка). Они построены из остатков глюкозы. Общая формула этих полисахаридов (C6H10O5)n
Физические свойства: Внешний вид крахмала хорошо всем известен: это белое вещество, состоящее из мельчайших зерен, напоминающих муку, поэтому его второе название «картофельная мука». Крахмал не растворим в холодной воде, в горячей набухает и постепенно растворяется, образуя вязкий раствор (клейстер).При быстром нагревании крахмала происходит расщепление гигантской молекулы крахмала на мелкие молекулы полисахаридов, называемых декстринами. Декстрины имеют общую молекулярную формулу с крахмалом (С6Н12О5)х, разница лишь в том, «х» в декстринах меньше «n» в крахмале. Пищеварительные соки содержат несколько разных ферментов, которые при низкой температуре доводят гидролиз крахмала до глюкозы:
Крахмал легко подвергается гидролизу: при нагревании в присутствии серной кислоты образуется глюкоза. (C6H10O5)n(крахмал) + nH2O –– H 2SO 4,t ° ® nC6H12O6(глюкоза)
Химические свойства:
2) Крахмал дает интенсивно синее окрашивание с йодом за счет образования внутрикомплексного соединения(качественная реакция).
3) Крахмал не вступает в реакцию «серебряного зеркала».
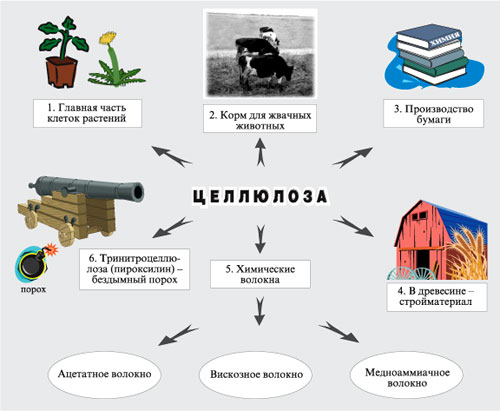
Получение: Образцом почти чистой целлюлозы является вата, полученная из очищенного хлопка. Основную массу целлюлозы выделяют из древесины, в которой она содержится вместе с другими веществами. Наиболее распространенным методом получения целлюлозы в нашей стране является так называемый сульфитный. По этому методу измельченную древесину в присутствии раствора гидросульфита кальция Ca(HSO3)2 или «гидросульфита натрия NaHSO3 нагревают в автоклавах при давлении 0,5— 0,6 МПа и температуре 150 «С. При этом все другие вещества разрушаются, а целлюлоза выделяется в сравнительно чистом виде. Ее промывают водой, сушат и направляют на дальнейшую переработку, большей частью на производство бумаги.
Химические свойства:
2) Образование сложных эфиров с азотной и уксусной кислотами:
 целлюлоза целлюлоза | + 3n HNO3 | H2SO4 ––––® | 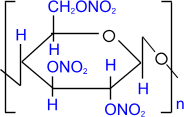 тринитрат целлюлозы тринитрат целлюлозы | + 3n H2О |
Целлюлоза представляет собой твердое волокнистое вещество, нерастворимое в воде, но растворимое в аммиачном растворе гидроксида меди (II) (реактиве Швейцера).
Контроль знаний:
1.Какой дисахарид лежит в нашей сахарнице?
2.Почему жизнь на Земле основана на углероде?
3. Какие вещества относятся к углеводам? Как классифицируют углеводы и почему?
4. Какие характерные химические свойства глюкозы и крахмала.
5. Приведите примеры значения углеводов.
6.Составьте уравнение реакций, при которых сахарозу можно превратить в этанол?
7. Изобразите известные вам процессы брожения глюкозы и укажите их практическое значение.
8.Вычислите, какой объём (в л.) оксида углерода (IV) образуется при окислении 0,25 моль сахарозы.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр.146-152,153-156,157-161,162-165,пересказ конспекта лекции №13.
Лекция № 14.
Тема: Амины. Понятие об аминах. Анилин как ароматический амин, органическое основание. Взаимное влияние атомов в молекуле анилина: ослабление основных свойств и взаимодействие с бромной водой. Применение анилина на основе свойств.
Аминокислоты. Получение аминокислот из карбоновых кислот и гидролизом белков. Химические свойства аминокислот как амфотерных органических соединений: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации). Пептидная связь и полипептиды. Применение аминокислот на основе свойств.
Белки. Получение белков реакцией поликонденсации аминокислот. Первичная, вторичная и третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз и цветные реакции. Биохимические функции белков. Генетическая связь между классами органических соединений.
Основные понятия и термины по теме: классификация аминокислот и структуры белков, изомерия. характеристика представителей, химические свойства, качественные реакции.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Понятие об аминах. Анилин как ароматический амин, органическое основание.
2.Способы получения аминокислот.
3.Химические свойства аминокислот как амфотерных органических соединений.
5.Получение белков реакцией поликонденсации аминокислот
6.Первичная, вторичная и третичная структуры белков.
7.Качественные реакции на белки.
8.Биохимические функции белков.
9.Генетическая связь между классами органических соединений.
Углеводы
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Классификация углеводов
По числу структурных звеньев
Некоторые важнейшие углеводы: